藜麦WOX转录因子家族的鉴定及表达分析
朱满喜,杨雅舒,杨小兰,张 芳,杨利艳,王创云
(1.山西师范大学生命科学学院, 中国 临汾 041000;2.山西省农业科学院作物科学研究所, 中国 太原 030031)
WOX (WUSCHEL-related homeobox) 转录因子是植物特有的转录因子,对植物干细胞稳态维持、胚胎发生与胚胎后发育、激素信号转导、初生和次生物质代谢及抗逆响应等均起着重要的调节作用[1]。WOX家族成员在拟南芥、棉花、水稻、玉米、番茄等植物中已得到鉴定,证实它是一类广泛存在的转录因子[2]。拟南芥WOX基因家族中包含WUS和WOX1~WOX15[3],棉花中发现有37个成员[4],水稻和番茄中分别发现有12个、10个成员[5,6]。系统发育树分析发现,WOX家族蛋白被分为进化支(WUS支)、中间支、古老支3个分支,其中中间支和古老支的起始氨基酸不固定,进化支成员有固定的起始氨基酸,为T-L[2]。对WOX的功能研究表明,拟南芥的WUS和WOX5分别在茎尖和根尖的分生组织表达,维持干细胞的分裂能力,抑制分化,其中WUS基因通过影响子房和花药的发育促进叶和花序的形成[7-10]。AtWOX3功能保守,与花瓣的形成有关,并参与营养器官的发育过程[11,12]。AtWOX4在原形成层发育过程中通过识别不同的DNA靶点和互作蛋白而影响维管束的形成[13]。AtWOX9将发育信号与细胞周期调控相结合,在维持细胞分裂和防止细胞过早分化中起重要作用[14]。
藜麦(ChenopodiumquinoaWilld.)是起源于安第斯山脉的苋科藜亚科藜属植物,已有7千年的种植历史,称为“伪谷物”,其营养全面,油脂、蛋白质组成平衡,是被FAO认定的唯一一种单作物即可满足人类所需全部营养的食品,是一种极具潜力的世界性粮食作物[15]。藜麦不仅营养丰富,其特殊的生长环境使藜麦同时具有较强的耐盐、耐旱、耐贫瘠等特性[16,17]。
高质量藜麦基因组数据的公布极大地促进了对藜麦重要基因家族功能的研究[18]。本研究利用生物信息学方法和转录组技术获得藜麦WOX家族成员,并对其理化性质、系统进化、基因结构、保守结构域、保守基序、组织表达特异性和氮胁迫下基因表达进行分析,为理解WOX基因家族在藜麦生长发育过程中的功能奠定基础,同时为筛选响应低氮胁迫WOX基因提供线索。
1 材料与方法
1.1 转录组和基因组数据来源
RNA-Seq数据下载于NCBI,拟南芥WOX蛋白下载于拟南芥全基因组数据库 TAIR(https://www.arabidopsis.org/),水稻WOX蛋白下载于水稻全基因组数据库RGAP(http://rice.plantbiology.msu.edu/),藜麦基因组数据从Phytozome v12 (http://phytozome.jgi.doe.gov/pz/)中的Chenopodium quinoa v1.0获得。
1.2 藜麦WOX基因家族成员的鉴定及序列分析
利用TAIR数据库中已经鉴定的所有拟南芥WOX家族蛋白,通过藜麦基因组数据库进行Blastp比对搜索,筛选出藜麦中所有的WOX 转录因子家族蛋白,运用Pfam(http://pfam.xfam.org/)分析候选WOX蛋白结构,去除无WOX蛋白典型保守结构域的成员,最终得到WOX转录因子家族的所有成员。
将WOX家族的所有蛋白序列输入ExPasy 网站(http://au.expasy.org/tool.html),使用Compute pI/MW功能对蛋白序列的长度、相对分子质量、等电点等理化性质进行分析。
1.3 系统进化树构建
利用BioEdit软件的Clustal W功能对藜麦、拟南芥和玉米的WOX蛋白序列进行多重比对,使用MEGA7 软件(邻接法)(bootstrap=1 000)构建无根进化树。
1.4 藜麦WOX基因结构分析
将藜麦WOX基因的CDS序列和全长序列输入GSDS 2.0 (http://gsds.cbi.pku.edu.cn/)网站,对其基因结构进行分析。
1.5 藜麦WOX蛋白的保守域、保守基序分析
藜麦WOX蛋白保守域用DNAMAN 6.0软件进行分析。通过Pfam网站获得藜麦WOX蛋白保守域的氨基酸起始位置,以此在IBS软件中绘制结构域位置图。通过MEME网站 (http://memesuite.org/tools/meme)对藜麦WOX 蛋白保守基序进行分析。参数如下:基序数目(Motif number)设置为10,基序宽度(motif width)设置为6~100。并运用TBtools软件绘制Motif位置图。
1.6 藜麦WOX基因表达分析
1.6.1 表达的组织特异性 藜麦种子和6周龄叶片、茎、幼苗的RNA-Seq数据下载于NCBI数据库,以此来分析藜麦各组织的表达情况。运用TBtools软件绘制藜麦WOX基因表达的热图(表达量取log2TPM值)。
1.6.2 藜麦WOX家族成员响应氮胁迫的表达分析 以藜麦品种ZK7(Chenopodiumquinoacv. ZK7)为材料,进行不同氮素水平下的WOX基因表达分析。藜麦种子由山西省农业科学院作物科学研究所提供。用10%次氯酸钠溶液消毒5 min,冲洗干净后将种子置于湿润的滤纸上,发芽后置于人工气候培养箱,用Hoagland全营养液(N浓度:7.1 mmol/L)培养,培养条件为光照 16 h,黑暗 8 h,温度为23 ℃。幼苗长到6~8叶后,选取生长一致的幼苗进行以下处理。低氮处理:20%N Hoagland营养液培养,N浓度为1.42 mmol/L;缺氮处理:0%N Hoagland营养液处理,N浓度为0;以Hoagland全营养液处理(N浓度为7.1 mmol/L)为对照。处理时间设置为5 d和30 d。每个处理设 3个生物学重复。采集的幼苗叶片立即置于液氮中速冻,送至北京百迈客生物科技有限公司进行有参转录组分析。
2 结果与分析
2.1 藜麦WOX基因家族成员的鉴定及序列分析
利用已经鉴别出的所有拟南芥WOX蛋白,通过Phytozome藜麦蛋白数据库进行Blastp比对,Pfam网站去除无WOX蛋白典型保守结构域的蛋白,共鉴定出13个藜麦WOX蛋白家族成员,并获得了每个成员的全基因序列、CDS序列及相应的蛋白序列(表1)。对藜麦WOX蛋白理化性质分析发现,不同藜麦WOX蛋白存在较大差异,蛋白序列长度为159~676 aa,相对分子质量为18 510~76 730。蛋白序列越长,相对分子质量越大(AUR62009597最大,AUR62017610最小)。蛋白质等电点为5.27~9.56,其中AUR62035466最高,AUR62003747最低,等电点大于7的蛋白质共有5个,为碱性蛋白,其余8个蛋白质均为酸性蛋白。藜麦WOX家族蛋白质具有不同的理化性质,推测它们可能具有不同的功能。
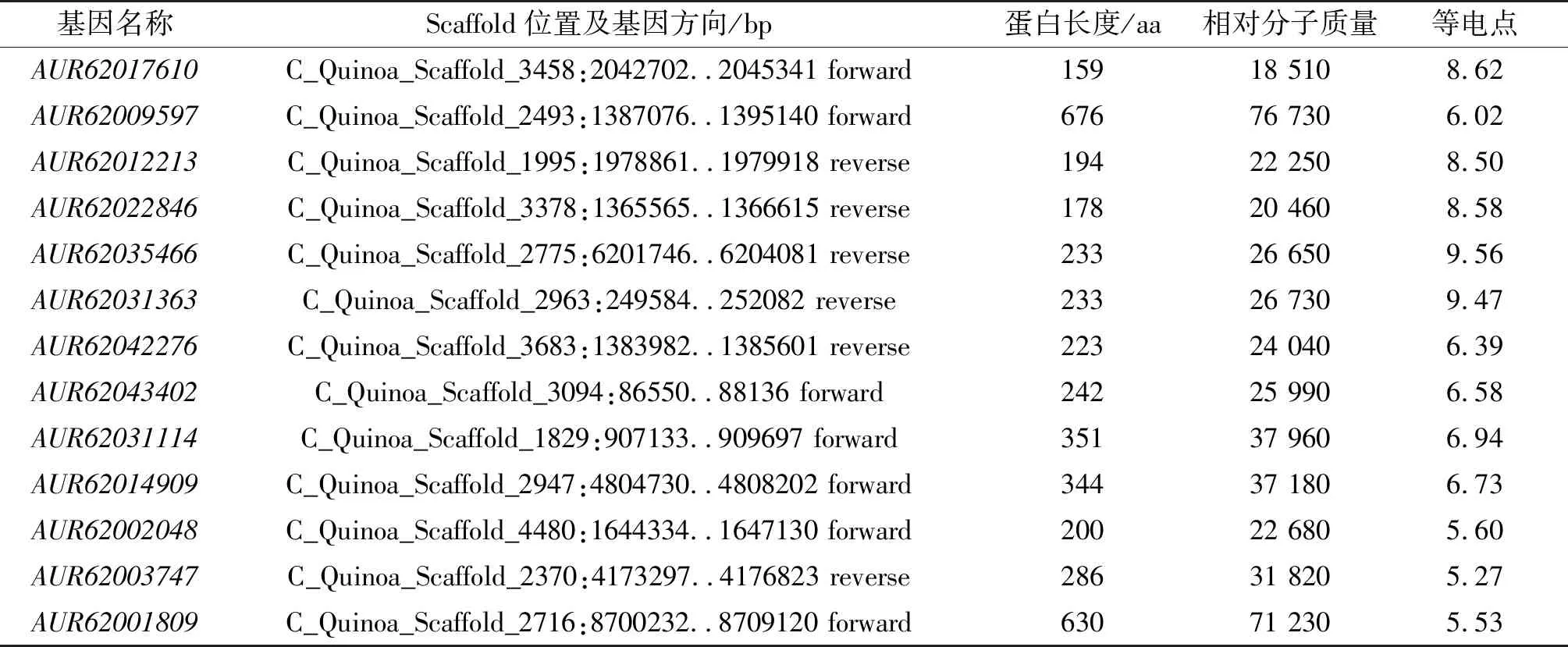
表1 藜麦WOX基因家族成员基本信息Tab. 1 Basic information of WOX gene family members in quinoa
2.2 藜麦、拟南芥与水稻WOX 家族蛋白系统发育树分析
为了解藜麦WOX家族的演化关系,将拟南芥、水稻和藜麦的WOX蛋白序列进行多重比对,构建一个无根的NJ系统发育树(图1)。根据发育树分支结果,13个藜麦WOX 蛋白、12个水稻WOX 蛋白、14个拟南芥WOX 蛋白分为3组,即Class A,Class B和Class C(图1)。17个WOX 蛋白被分到Class A组 (包括7个藜麦WOX 蛋白), 8个WOX 蛋白被分到Class B 组(包括2个藜麦WOX 蛋白),14个WOX 蛋白被分到Class C组 (包括4个藜麦WOX 蛋白)。拟南芥WOX蛋白分为远古支、中间支和进化支,其中远古支包含WOX10,WOX13及WOX14共 3个成员,中间支包含WOX8,WOX9,WOX11和WOX12共4个成员,进化支包含WOX1~WOX7共7个成员[8]。据此可知,藜麦WOX基因有2个属于远古支、4个属于中间支、7个属于进化支。3个物种的WOX家族成员在3个分支中均有分布,说明WOX家族的分化在藜麦、拟南芥、水稻物种分化之前。
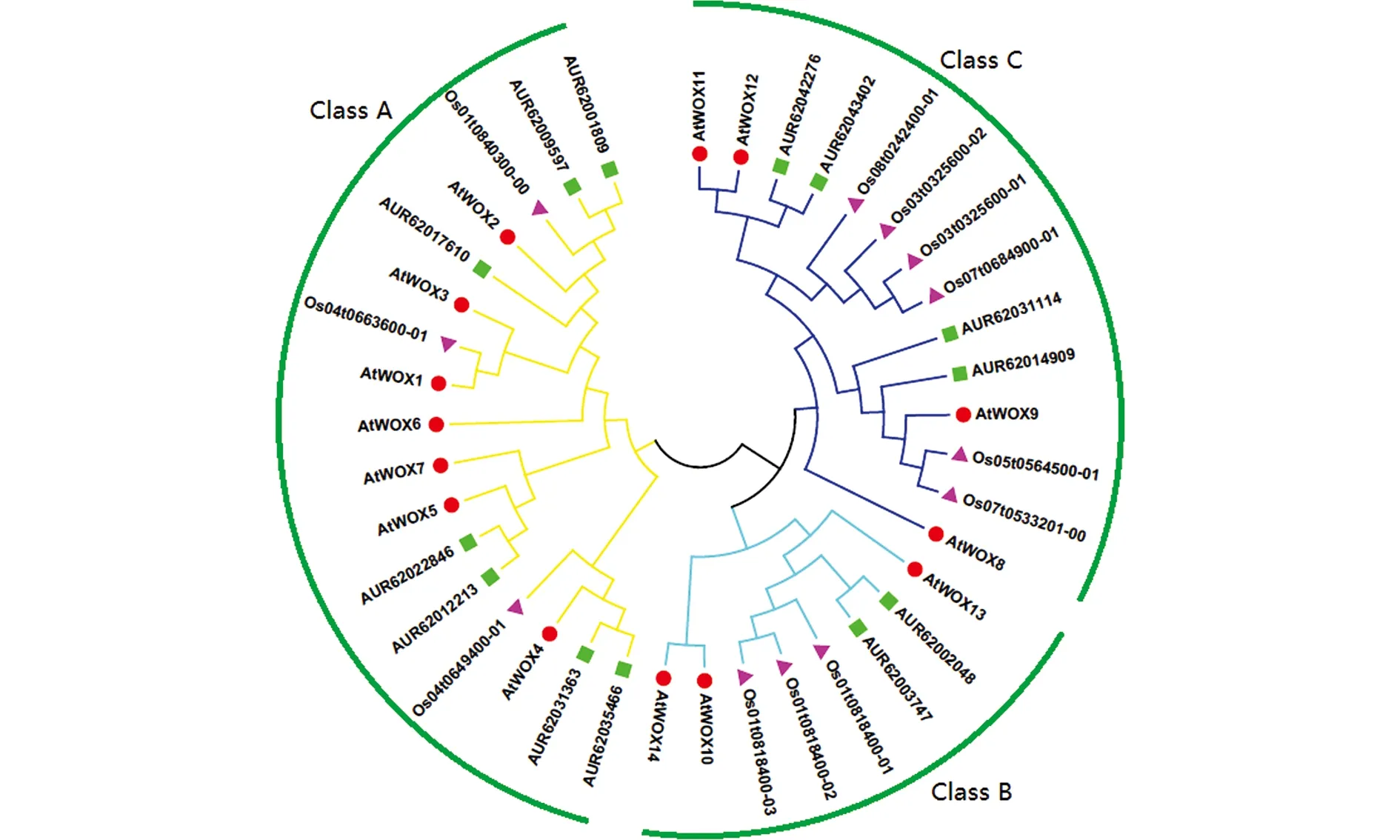
图1 藜麦、拟南芥和水稻WOX 蛋白系统发育树Fig. 1 Phylogenetic tree of WOX family in quinoa, Arabidopsis, and rice
2.3 藜麦WOX基因家族结构分析
基因结构能为基因家族的进化规律提供进一步的证据。从Phytozome v12中获得藜麦WOX基因的CDS序列和全基因组序列,利用GSDS 2.0网站对其基因结构进行分析,结果表明(图2):不同WOX基因结构存在较大差异,成员内含子数目为1~4个,外显子数目为2~5 个,不同的进化支之间差异较大;只有AUR62003747,AUR62031363及AUR62035466同时存在5′非翻译区和3′非翻译区,AUR62002048只含有5′非翻译区,AUR62014909只具有3′非翻译区,其余8个WOX基因不存在非翻译区。

图2 藜麦WOX基因家族进化树与基因结构Fig. 2 Phylogenetic tree and gene structure of WOX gene family in quinoa
2.4 藜麦WOX家族基因保守结构域、保守基序分析
13个基因中存在6组旁系同源基因,每一组旁系同源基因的结构相似。如AUR62031363和AUR62035466作为一对同源基因,都含有3个外显子、2个内含子,并且同时存在5′非翻译区和3′非翻译区;AUR62014909和AUR62031114是一对同源基因,都有4个外显子、3个内含子,但AUR62014909存在3′非翻译区,AUR62031114则没有。不同进化支内成员的外显子、内含子数目不同,AUR62031114,AUR62002048及AUR62001809分别含有4,2及5个外显子。WOX基因家族进化过程中外显子数目的变化可能是WOX基因功能多样性的主要原因。
对藜麦WOX蛋白序列进行分析表明,13个WOX蛋白均含有Homeobox结构域,且均位于蛋白质的N端;同源基因的蛋白长度和保守结构域的位置都具有一定的相似性(图3)。将Homeobox结构域的氨基酸序列进行多重比对,进一步分析藜麦WOX蛋白Homeobox结构域的保守性,发现Homeobox结构域由34~60个氨基酸组成,其具有螺旋-环-螺旋-转角-螺旋结构 (T-L-X-L-F-P-X-X, 其中X代表任一氨基酸),并且多个氨基酸位点具有保守性(图4),推测这些位点的氨基酸残基在藜麦WOX家族基因的表达中起重要作用。
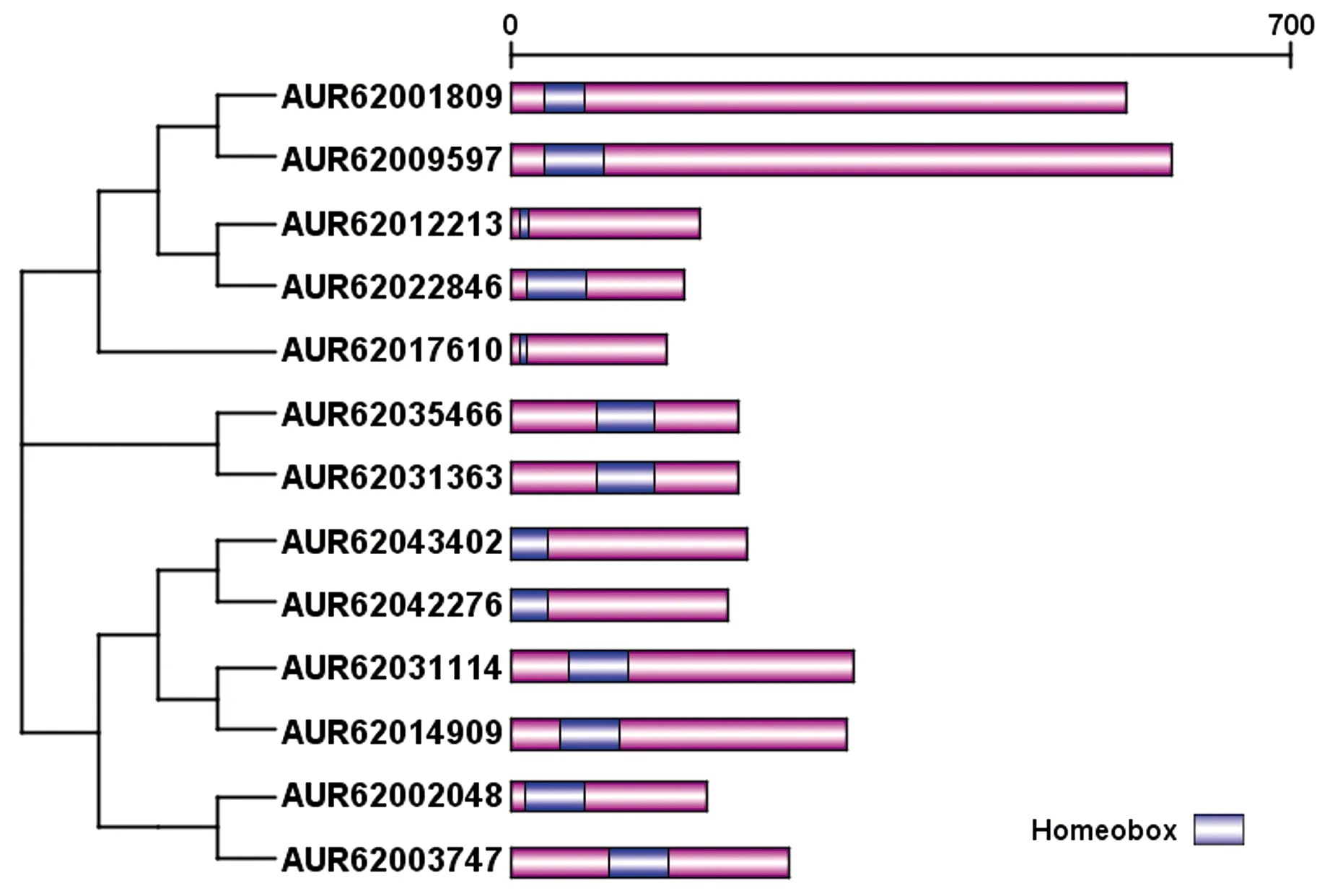
图3 藜麦WOX蛋白保守结构域分析Fig. 3 Analysis of conserved domain of WOX proteins in quinoa

图4 藜麦WOX蛋白Homeobox结构域的氨基酸序列比对Fig. 4 Amino acid sequence alignment of Homeobox domain of WOX proteins in quinoa
对鉴定的藜麦WOX家族成员的保守基序分析表明,共鉴定出10个独立的Motif,命名为Motif 1~Motif 10(表2)。其中Motif 1位于5′端,存在于所有的藜麦WOX蛋白中,保守性较高;Motif 6为WUS-box 基序(TLXLTP),存在于Class B和Class C 所有成员中,而在Class A 支中未预测到;Motif 9和Motif 10的保守性不高,仅存在于AUR62001809和AUR62009597这一对同源基因中(图5)。
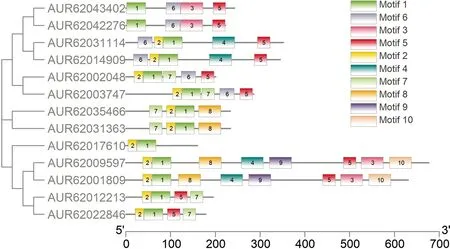
图5 玉米WOX蛋白Motif分析Fig. 5 Motif analysis of WOX proteins in quinoa

表2 Motif氨基酸序列Tab. 2 Amino acid sequence of Motif
2.5 藜麦WOX基因家族的表达分析
2.5.1 组织特异性 为明确藜麦WOX基因在不同组织中的表达特性,对6 周龄的茎、叶、幼苗和种子4个组织器官中的13个WOX基因的表达情况进行分析。结果表明,不同藜麦WOX基因在不同组织中表达差异明显(图6,彩图见封三)。AUR62012213,AUR62022846,AUR62009597,AUR62001809及AUR62017610在茎、叶、幼苗、种子中都未见表达,推测这5个基因与以上器官的生长发育关系不大,其组织表达特性有待进一步验证。在其余7个WOX基因中,除AUR62031363在种子中不表达外,其它WOX基因均在种子中有表达, 说明这些基因可能与藜麦种子的发育有关;AUR62043402,AUR62014909,AUR62031114及AUR62042276只在种子中表达,说明这些基因对藜麦种子的发育有重要调控作用;AUR62003747和AUR62002048在叶中表达量较高,即这2 个基因可能参与了藜麦叶的发育过程;AUR6200374,AUR62031363,AUR62035466及AUR62002048均在茎中表达量最高,它们可能对藜麦茎的生长有重要作用。综上可知,藜麦WOX基因具有明显的组织表达特异性,在茎中的表达量最高, 其次是种子和叶, 在幼苗中的表达量最低, 暗示它们在藜麦不同组织中的生物学功能可能存在较大差异。
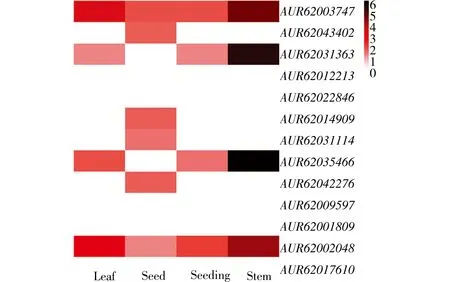
图6 WOX基因在藜麦不同组织中的表达模式分析Fig. 6 Expression profile analysis of WOX genes in different tissues of quinoa
2.5.2 藜麦WOX基因家族成员响应氮胁迫的表达分析 根据转录组测序结果分析,13个藜麦WOX基因中AUR62031363,AUR62003747及AUR62035466对氮胁迫有显著响应。低氮条件下,AUR62031363和AUR62035466基因的表达量在5 d和30 d均较对照提高,即低氮诱导了二者的表达,特别是在处理30 d后,这两个基因的表达急剧上升,AUR62035466尤为明显,表达量增加272%。在缺氮条件下,AUR62031363和AUR62035466基因表达量较低氮下明显下降,处理30 d时,二者的表达量分别降低54.9%和57.7%。AUR62003747则有不同的表达模式,低氮和缺氮处理均抑制了该基因的表达:5 d时,AUR62003747的表达量随氮胁迫加深而降低;30 d时,其表达量有所上升。

注:基因表达量以FPKM值表示。图7 不同氮素水平下藜麦WOX基因的表达Fig. 7 Expression profile of WOX genes in quinoa seedling leaves under different nitrogen levels
3 讨论
近年来基因组测序技术飞速发展,为深入研究分子生物学创造了良好的条件,许多物种的全基因组被测定并陆续公布,为基因家族鉴定、功能基因挖掘和研究提供了便利。本研究通过生物信息学分析,共鉴定出13个藜麦WOX蛋白,比水稻有更多的WOX蛋白,可能与藜麦WOX基因在进化过程中经历全基因组倍增事件有关[19]。对系统发育树分析发现,7个藜麦WOX蛋白、7个拟南芥WOX蛋白、3个水稻WOX蛋白被分到Class A支,表明它们有共同的祖先,但在进化过程中WOX蛋白在水稻中出现丢失现象,而在藜麦和拟南芥中保留下来。分析藜麦WOX基因的结构发现,不同进化支的基因结构差异较大,同一进化支的基因结构有很高的保守性。大量基因家族分析表明,同一分支中的蛋白质其基序保守性很高,如MYB基因家族[20],这也证明了本研究构建的进化树的可靠性。
WOX转录因子在植物的生长发育过程中发挥着重要作用。通过分析藜麦WOX基因家族在不同组织中的表达数据, 发现藜麦WOX家族的基因在茎、叶、幼苗、种子中均有表达, 并且在茎中的表达量较高。AUR62031363和AUR62035466在茎中的表达量明显高于其他WOX基因,它们在拟南芥中的同源基因AtWOX4可以调节原形成层分生组织的分化[13],因此推测以上两个基因可能对茎的生长和茎尖的分裂有重要作用[21]。AUR62043402,AUR62014909,AUR62031114和AUR62042276只在种子中表达,而AUR62043402和AUR62042276的同源基因AtWOX11和AtWOX12参与了叶片外植体新根器官的发生[22],因此笔者推测该基因家族在藜麦和拟南芥中的功能发生了分化。
WOX转录因子还在植物响应非生物胁迫中起重要的调节作用[23,24]。前人研究表明,拟南芥AtWOX6突变株在冷胁迫中生长较慢,开花较晚,并且对冷冻更敏感[25];水稻的根长受WOX11基因的调控,超表达WOX11可以增加水稻对干旱胁迫的抗性[26]。本研究转录组分析表明藜麦AUR62031363,AUR62003747和AUR62035466基因对氮胁迫有显著响应,后期可作为氮胁迫响应的候选基因进一步验证。综上所述,藜麦WOX全基因组的鉴定和表达模式的分析可为深入研究WOX基因在藜麦生长发育和抗逆性响应提供基础。
4 结论
在藜麦中共鉴定出13个WOX基因家族成员,分属Class A,Class B和Class C亚族,具有典型的Homeobox保守结构域,组织表达特异性明显,在茎中表达量最高。AUR62031363,AUR62003747和AUR62035466明显受低氮胁迫诱导,但对低氮的响应程度不同。

