西黄胶囊减少头颈部肿瘤放化疗副反应的回顾性对照研究
彭美玲,张 瑶,李 敏,卢晓云,刘 劲,唐 黎,符 佳,范莎莎,段华新
(湖南师范大学附属第一医院湖南省人民医院肿瘤科,中国 长沙 410081)
目前,肿瘤已成为我国城市居民最主要的死亡原因,也是农村居民第二大死亡原因[1]。鼻咽癌是我国最常见的头颈部恶性肿瘤之一[2,3],其次是口腔癌、口咽癌、喉癌、鼻窦癌、涎腺癌等。鳞状细胞癌是头颈部肿瘤最常见的病理类型[4]。饮酒是头颈部恶性肿瘤发生的危险因素[5],吸烟、人乳头瘤病毒(human papilloma virus,HPV)感染也是常见病因[6]。鼻咽癌,特别是未分化鳞状细胞鼻咽癌的发病主要与爱泼斯坦-巴尔(Epstein-Barr,EB)病毒感染有关[7]。鼻咽癌因解剖位置特殊,对放疗敏感,因此对于非远处转移鼻咽癌患者,单纯放疗或联合同期化疗是其根治性治疗手段[8]。根据头颈部肿瘤分期及部位不同,目前主要治疗方法包括手术、放疗、化疗等方式。早期肿瘤可通过根治性手术治疗,而不能行手术治疗或手术后具有高危因素的患者,则需要放疗或同期放化疗等治疗以减少术后复发,延长患者总生存时间。
头颈部化疗主要是以铂类为主同期化疗增敏方案,化疗副反应为恶心、呕吐、骨髓抑制、放射性口腔黏膜炎等。同期放化疗会加重头颈部肿瘤患者的毒副反应,但对于III-IVa患者,同期放化疗可以提高头颈部肿瘤局部控制率。骨髓抑制3~4级粒细胞减少,特别是3~4级血小板减少是同期放化疗治疗中断的主要原因。目前的常用治疗方法为粒细胞集落刺激因子支持治疗,但血小板减少仍无快速有效的支持治疗方法。且临床上仍没有有效的预防骨髓抑制发生的药物。放射性口腔黏膜炎表现为口腔咽部黏膜红肿、白膜形成,甚至溃疡,最主要症状为疼痛、口干、味觉异常,影响患者食欲,甚至进食困难。目前治疗放射性口腔黏膜炎研究虽多,但尚无标准治疗方案[9]。放射性口腔黏膜炎防治策略专家共识(2019)[10]指出局部使用糖皮质激素(抗炎)能减轻水肿,抑制炎症反应,缓解患者临床症状,全身使用糖皮质激素有减少放疗中断的趋势,但长期使用糖皮质激素,无论是局部还是全身使用均可能导致不良副反应。因此寻找预防及治疗头颈部肿瘤放化疗不良反应的方法,对减少放疗中断、提高患者治疗效果有重要意义。
西黄胶囊成份为体外培育牛黄、人工麝香、醋乳香、醋没药,有抗炎、增强免疫力、抗肿瘤的疗效。西黄胶囊对治疗放射性口腔黏膜炎有积极作用[11,12]。西黄胶囊可减少食管癌放化疗、肺癌化疗、结肠癌副反应的发生,包括减少疼痛、感染、骨髓抑制[13-15]。西黄胶囊较为广泛地应用于临床肿瘤患者,但西黄胶囊对头颈部肿瘤放化疗副反应的研究不多。因此本研究拟回顾性对照研究既往病例,对西黄胶囊在头颈部肿瘤同期放化疗过程中的作用进行研究。
1 研究对象及方法
1.1 研究对象
回顾2017年1月—2020年2月入住湖南省人民医院肿瘤科头颈部肿瘤患者资料,共纳入122例。
纳入标准:
1)年龄18~75岁;
2)经组织病理学或细胞学初次诊断为头颈部肿瘤;
3)ECOG评分0~1分;
4)患者均予连续性放射治疗,行6 MX适型调强放疗,每周照射5次,每次1.8~2.3 Gy,总剂量为50~74 Gy;
5)均完成放疗计划;
6)血常规:血红蛋白质量浓度≥120 g·L-1;白细胞计数(WBC)≥4.0×109·L-1;中性粒细胞计数≥2×109·L-1;血小板计数≥100×109·L-1;红细胞计数≥4×1012·L-1;
7)血生化:总胆红素浓度≤25 μmol·L-1;丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)活性≤100 U·L-1,白蛋白质量浓度≥35 g·L-1,前白蛋白质量浓度≥200 mg·L-1;血清肌酐浓度≤132 μmol·L-1;肌酐清除率≥60 mL·min-1。
排除标准:
1)抗肿瘤治疗前出现感染或使用抗生素患者;有慢性感染疾病病史;
2)有活动性龋齿、口腔溃疡、慢性口腔疾病等患者;
3)使用靶向治疗或免疫治疗;
4)有药物、食物过敏病史;治疗期间出现视神经炎;
5)妊娠期或哺乳期妇女;
6)有严重的认知障碍;有精神病病史;
7)持续严重或不可控制的系统性疾病(如不稳定或者失代偿的心脏、肝脏或肾脏疾病);合并有肾病综合征患者;蛋白尿连续两个大于+1(24 h尿蛋白小于1.5 g或蛋白质肌酐比值小于1.5除外);
8)有远处器官转移;
9)有已知的中枢系统疾病病史(比如癫痫症、惊厥等);
10)胃肠道出血、机械性肠梗阻或穿孔;
11)同时存在其它部位原发肿瘤患者;
12)入院前有疼痛并需口服止痛药缓解疼痛或慢性疼痛患者;
13)有风湿免疫系统等疾病病史或需要长期使用激素患者;
14)有糖尿病史;有消化道溃疡病史;
15)有慢性酒精中毒;
16)心电图QT间期超过480 ms;
17)连续暂停放射治疗5天的患者;
18)治疗前及治疗过程中行胃管置入的患者;
19)有支气管哮喘、慢性阻塞性肺疾病病史;
20)有慢性皮炎病史;有消化道溃疡病史。
1.2 分组
根据是否使用西黄胶囊分为观察组和对照组,观察组79例,对照组43例。观察组口服西黄胶囊,1~1.5 g·次-1,每日两次(若患者仅能进食流质,则西黄胶囊碾碎兑水口服);对照组非服用西黄胶囊。
1.3 记录数据
记录两组患者使用雾化总天数、静脉激素使用总天数,记录治疗期间毒副反应最严重等级,是否使用肠外营养,是否使用强阿片止痛药物(盐酸羟考酮缓释片、芬太尼透皮贴剂、盐酸吗啡片、盐酸吗啡缓释片等)。
1.4 不良反应评价标准
不良反应评价标准按照常见不良反应术语评定标准4.0版(The Common Terminology Criteria for Adverse Events, CTCAE 4.0)毒性指标及分级标准。
1.5 统计学分析
应用 SPSS 25.0版软件进行统计分析。正态分布计量数据采用t检验(检验水准α=0.05),以均数±标准差(x±s)表示;非正态分布计量数据采用Mann-Whitney U检验(检验水准α=0.01);计数资料检验方法:行×列理论频数不小于1,且1≤理论频数<5的格子数没有超过总格子数的1/5时,则采用行×列表资料的卡方检验;当行×列理论频数小于1或1≤理论频数<5的格子数超过总格子数的1/5时,则采用Fisher确切概率法(计数资料检验水准α=0.05);并采用多因素Logistic(检验水准α=0.05)回归分析西黄胶囊对骨髓抑制的影响的比值比(odds ratio,OR)及其95%可信区间(confidence interval, CI),以P<检验水准α为差异有统计学意义。
2 结果
2.1 两组患者一般资料
本研究入组122例。对照组43例,使用常规治疗,但不使用西黄胶囊;观察组79例,在对照组基础上使用西黄胶囊。两组患者一般临床资料包括年龄、性别、ECOG 评分、吸烟情况、肿瘤类别、分期等均未显示统计学差异(P>0.05),两组数据一般临床资料见表1。
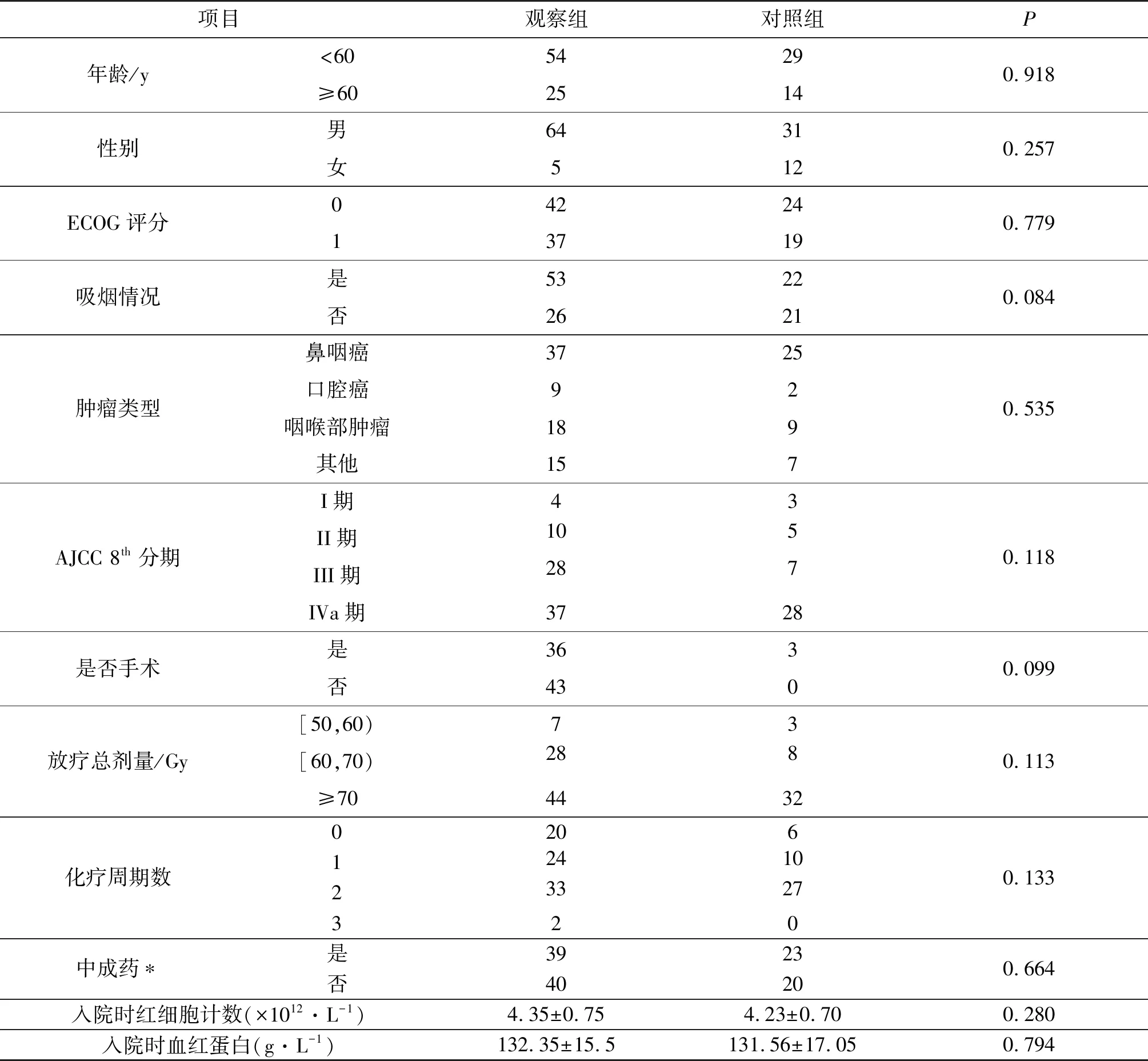
表1 两组患者一般临床资料的比较Tab. 1 Comparison of general clinical data between two groups of patients
2.2 西黄胶囊与骨髓抑制的关系
观察组中性粒细胞减少发生率(45.57%)小于对照组(62.12%),P=0.039,见图1(A);观察组血小板降低发生率(22.78%)小于对照组(41.86%),P=0.024,见图1(B);观察组贫血发生率(55.70%)小于对照组(74.42%),P=0.042,见图1(C)。纳入Logistics回归分析的因素包括是否使用西黄胶囊、放疗总剂量、是否化疗、是否发生低蛋白。结果显示,西黄胶囊是2~4级中性粒细胞减少、2~4级血小板减少的独立影响因素,见表2。
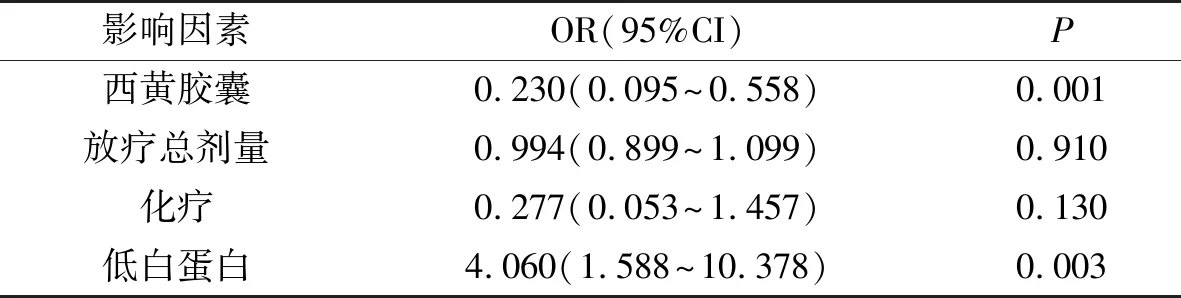
表2 Logistic回归分析骨髓抑制的影响因素Tab. 2 Logistic regression analysis of the effect of Xihuang capsule on bone marrow suppression

图1 两组患者骨髓抑制发生率比较Fig. 1 Comparison of the incidence of myelosuppression between the two groups of patients
2.3 西黄胶囊与雾化、静脉激素、强阿片类药物、肠外营养使用率的关系
观察组雾化使用率(62.03%)小于对照组(81.40%),P=0.027,见图2;观察组雾化平均天数(21.63±9.17)小于对照组(26.03±10.41),P=0.044,见表3;观察组静脉激素使用平均天数小于对照组,P=0.006,见表4;观察组强阿片类药物使用率(21.52%)小于对照组(39.53%),P=0.034,见图4(A),观察组肠外营养使用率(13.92%)小于对照组肠外营养使用率(41.86%),P=0.001,见图4(B)。

表3 两组患者雾化使用天数比较Tab. 3 Comparison of days of nebulization inhalation between two groups of patients

图2 两组患者雾化使用率比较Fig. 2 Comparison of nebulization inhalation usage between two groups of patients

图3 两组患者静脉激素使用率比较Fig. 3 Comparison of rate of intravenous hormone use between the two groups of patients

图4 两组患者强阿片类药物(A)、肠外营养(B)使用率Fig. 4 Usage rate of strong opioid (A) and parenteral nutrition (B) in two groups of patients

表4 两组静脉激素使用患者使用静脉激素天数比较Tab. 4 Comparison of days of intravenous hormone use between the two groups of patients
3 讨论
头颈部肿瘤包括耳鼻喉、口腔颌面部、颈部肿瘤。根据中国临床肿瘤学会(CSCO)头颈部肿瘤诊疗指南(2019)[16],对于不适宜手术的局部晚期非鼻咽癌头颈部肿瘤患者,首选同期放化疗;对于不适宜手术的早期头颈部肿瘤患者,单纯放疗则成为替代手术治疗的局部治疗手段。放疗是头颈部肿瘤极其重要的治疗手段,但头颈部肿瘤引起的副反应常导致放化疗治疗中断、影响患者治疗依从性。同期放化疗引起的最常见副反应是骨髓抑制和放射性口腔黏膜炎。放射性口腔黏膜炎是剂量限制性毒性副反应[17]。
本研究中,观察组中性粒细胞减少发生率(45.57%)低于对照组(65.12%),P<0.05;观察组血小板降低发生率(22.78%)小于对照组(41.86%),P<0.05;观察组贫血发生率(55.70%)低于对照组(74.42%),P<0.05。Logistic分析头颈部肿瘤同期放化疗发生骨髓抑制的独立影响因素,结果显示西黄胶囊是患者头颈部肿瘤放化疗期间中性粒细胞减少、血小板减少发生的独立影响因素。观察组雾化使用率(62.03%)小于对照组(81.40%),P<0.05。使用雾化的患者中,观察组雾化平均天数(21.63±9.17)小于对照组(26.03±10.41),P<0.05;使用静脉激素的患者中,观察组静脉激素使用平均天数小于对照组,P<0.01。观察组强阿片类药物使用率(21.52%)小于对照组(39.53%),P<0.05;观察组肠外营养使用率(13.92%)小于对照组肠外营养使用率(41.86%),P<0.05。观察组发生2~4级中性粒细胞减少(OR 0.230,95%CI 0.095~0.558,P=0.001)及2~4级血小板降低(OR 0.341,95%CI 0.137~0.847,P=0.02)较对照组减少,说明西黄胶囊可减少头颈部肿瘤强阿片类药物及肠外营养的使用。
西黄胶囊可以减少具有抗炎效果的糖皮质激素的使用,其抗炎机制也已有研究,其具有类似糖皮质激素的抗炎效果[18]。西黄胶囊主要成份为体外培育牛黄。体外培育牛黄主要成分为胆色素、胆酸等,主要抗炎成份为胆红素及各种胆酸同系物[18]。刘春光等[19]对胆红素和各种胆酸同系物的抗炎作用进行了研究,利用二甲苯致小鼠耳廓炎症肿胀模型,以耳廓的含水量为指标,观察口服胆红素和去氧胆酸的剂量-效应关系,发现去氧胆酸与胆红素均可对抗二甲苯致小鼠耳廓炎症肿胀,各种胆酸同系物的作用强弱顺序和表面活性强度顺序一致。胆红素和各种胆酸同系物是牛黄的有效成分,去氧胆酸的活性最强,其抗炎机制可能与表面活性强度有关。李霞等[20]也进行了体外培育牛黄的动物研究,发现体外培育牛黄能够显著抑制大鼠足部炎症渗出物中丙二醛的含量,认为体外培育牛黄具有抗自由基、抗氧化的作用。杜佐华等[21]进行动物实验发现体外培育牛黄可明显抑制小鼠巴豆油性耳廓水肿、大鼠角叉菜胶性足肿胀、大鼠巴豆油肉芽囊肿的渗出和组织增生,抑制白细胞游走反应、对抗前列腺素E2(PGE2)致毛细血管通透性增加,抗炎作用效果和牛黄相似。基于本研究结果,西黄胶囊能减少骨髓抑制的发生及减轻发生的严重程度,减少头颈部肿瘤放化疗期间静脉糖皮质激素、强阿片类药物、肠外营养的使用,提高患者放化疗的依从性,减少医疗资源浪费。此研究为回顾性对照研究,仍需前瞻性研究进一步验证,西黄胶囊减少骨髓抑制发生可作为其机制研究的基础。

