气体信号分子硫化氢下调CTGF途径在改善小鼠酒精性肾间质纤维化中的应用
张爱民,刘佳丽,向长铁,刘茂军,吴 倩,陈 坚,聂连桂,张晶晶,杨 军
(南华大学附属第一医院心内科,湖南 衡阳 421001)
在酒文化历史悠久的中国,随着社会发展、经济水平的提高,新型行业的崛起,饮酒已成为聚会、应酬不可或缺的一部分。过量饮酒会导致多脏器功能损害,现已成为当今世界范围内的重要公共卫生问题之一[1]。肝脏作为乙醇代谢及易受损伤的主要器官之一,其相关机制已有较深入探索[2-4],而随着对酒精性相关疾病研究的深入,肾脏作为仅次于肝脏的乙醇排泄器官,发现乙醇对肾脏也有明显损伤作用,但相关研究尚少见报道。肾间质纤维化是指各种原发性、继发性肾损害发展至终末期的共同通路[5-7],抑制肾纤维化的发展有助于延缓肾功能减退。酒精性肾损伤作为肾间质纤维化原因之一,探讨酒精性肾损伤所致肾间质纤维化相关作用机制对延缓肾间质纤维化的进展和指导治疗具有重要意义。MMPs/TIMPs失调是引起肾间质纤维化细胞外基质集聚的重要调控机制[8]。结缔组织生长因子(connective tissue growth factor,CTGF)也被认为是导致胶原重构的一个重要介质,其异常表达在肾间质纤维化进程中也起着至关重要作用[9]。目前已有研究表明,H2S能延缓慢性肾脏病发展,参与肝、肾、心等多器官纤维化,但对酒精性肾间质纤维化的作用机制尚缺乏足够的研究[10-11]。因此,本实验拟通过饮用乙醇水溶液建立慢性酒精性肾损害小鼠模型,观察H2S对小鼠酒精性肾间质纤维化及MMP-8、TIMP-1与CTGF蛋白表达水平的影响以及在酒精性肾间质纤维化的潜在治疗及机制。
1 资料与方法
1.1实验材料:40只成年体健雄性昆明小鼠,购自南华大学动物实验中心;实验小鼠分别单笼饲养于室内,温度约为(24±3)℃,按时消毒;小鼠可以自由获得水和食物。硫氢化钠(H2S)供体、内源性H2S生成酶抑制剂炔丙基甘氨酸(PAG)购于美国 Sigma 公司;兔一抗MMP-8、TIMP-1、CTGF、GAPDH购于中国博士德公司;兔二抗购于美国Proteintech公司;BCA蛋白定量试剂盒购于中国博士德公司;细胞裂解液购于碧云天公司。
1.2实验方法:酒精性肾损伤小鼠模型制备及分组:将40只成年体健雄性昆明小鼠在上述环境中适应性喂养1周,已排除外界干扰因素对实验结果的影响。之后将小鼠随机分为对照组(Control组)、酒精性肾损伤组(ARD组)、硫化氢干预组(H2S组)、内源性H2S生成酶抑制剂炔丙基甘氨酸组(PAG组),每组各10只。除Control组外,其他各组小鼠在标准饲料喂养的基础上,每日饮用4%的乙醇水溶液12周以构建酒精性肾损伤模型(4%的乙醇水溶液是ARD组、H2S组及PAG组小鼠的唯一饮用水源),每天早晨更换4%乙醇一次;Control组小鼠则每天饮用清水。另外,H2S组小鼠每天腹腔注射NaSH(50μmol/kg),PAG组小鼠每天腹腔注射PAG(40 mg/kg),Control组和ARD组小鼠则每天腹腔注射等剂量生理盐水。根据组织病理形态学结果评价造模是否成功。
1.3观察指标
1.3.1PAS染色观察肾脏组织形态学改变:取肾脏组织, 投入固定液内固定脱水、透明、浸蜡、包埋。常规切片,脱蜡至水,蒸馏水冲洗,70%乙醇冲洗。浸入高碘酸酒精溶液10 min,70%乙醇冲洗后入还原液中1 min,70%乙醇冲洗后入无色盐基性品红溶液1 h,流水冲洗10 min,用哈瑞苏木精复染细胞核3 min后,再用1%的盐酸酒精分化,流水冲洗5 min,常规脱水、透明、封固。200倍光镜下观察小鼠肾脏组织形态学改变。
1.3.2Masson染色观察肾脏组织间质纤维化程度:取小鼠肾脏组织,以100 g/L多聚甲醛固定后,取甲醛固定的肾脏组织;石蜡包埋,切片5 μm;切片脱蜡,入5%铁明矾水溶液24 h;蒸馏水洗,用Regaud铁木素染24 h;蒸馏水洗,入2.5%铁明矾水溶液,至细胞核清晰显出;自来水洗10 min;入1%冰醋酸配制的1%酸性复红5 min;蒸馏水洗,加入磷钼酸水溶液脱色;加入含2.5%冰醋酸苯胺蓝饱和水溶液染5 min;蒸馏水洗,入1%冰醋酸水脱去过多的苯胺蓝及磷钼酸;入0.1%冰醋酸的无水酒精;用无水酒精脱水,二甲苯透明,封固。200倍光镜下观察小鼠肾脏组织间质纤维化程度。
1.3.3Western Blot检测MMP-8、TIMP-1和CTGF蛋白的表达水平:取各组小鼠新鲜肾脏组织研磨提取蛋白,采用BCA比色法进行蛋白定量;配置10% SDS-PAGE分离胶电泳分离蛋白,蛋白样品在100℃煮沸5 min,每孔20 μl蛋白样品上样,将胶置于电泳缓冲液中电泳用以分离目的蛋白,后将目的条带切下,以10 V半干式电转膜30 min将蛋白质转移至PVDF膜上。用TBST配制的5% BSA封闭2 h,封闭后以MMP-8、TIMP-1和CTGF为一抗(稀释度为 1∶500)、GAPDH为内参37 ℃孵育1 h 后 4 ℃冰箱过夜;经TBST洗膜后,用HRP标记的羊抗兔二抗(稀释度为1∶8 000)在37 ℃温度下孵育1 h,用TBST洗膜,ECL显色,曝光后扫描,用 Image J 图像分析软件进行光密度分析。
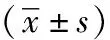
2 结果
2.1大鼠存活情况:12周后,共存活35只大鼠,其中ARD组、H2S组、PAG组分别有2 只、1 只、2 只大鼠死亡。
2.2各组小鼠肾脏免疫组化结果的比较
2.2.1PAS染色:光镜下可见ARD组与Control组相比,肾脏纤维排列明显紊乱,肾小球、肾小管、肾间质肿胀,肾小管退行性改变及系膜基质增多;而H2S组与ARD组相比,肾脏纤维排列明显改善,间质有少量疏松结缔组织,系膜基质减少。PAG组小鼠肾脏组织结构和纤维排列与ARD组类似。见图1。

A:Control组;B:ARD组;C:H2S组;D:PAG组
2.2.2Masson染色:与Control组相比,ARD组可见明显肾小管间质纤维化;与ARD组相比,H2S组肾小管间质纤维化明显改善;PAG组小鼠肾小管间质纤维化程度与ARD组无明显差异。见图2。

A:Control组;B:ARD组;C:H2S组;D:PAG组
2.3硫化氢降低酒精性肾损伤大鼠肾脏组织中MMP-8、TIMP-1和CTGF蛋白的表达:取Control组、ARD组、H2S组和PAG组的肾脏组织,用Western blot法检测各组蛋白MMP-8、TIMP-1和CTGF表达水平。结果:与Control组相比,ARD组小鼠肾脏组织中MMP-8、TIMP-1和CTGF蛋白表达明显升高,差异有统计学意义(P<0.05);与ARD组相比,H2S组小鼠肾脏MMP-8、TIMP-1和CTGF蛋白表达减少,差异有统计学意义(P<0.05);PAG组与ARD组比较,MMP-8、TIMP-1和CTGF蛋白表达差异无统计学意义(P>0.05)。提示硫化氢干预可抑制酒精性肾损害小鼠肾脏组织中MMP-8、TIMP-1和CTGF蛋白表达的上调。见图3。

图3 各组小鼠肾脏组织中MMP-8、TIMP-1和CTGF的蛋白表达水平(*:P<0.05,与control组比较;#:P<0.05,与ARD组比较)
3 讨论
机体长期摄入大量酒精后可导致多脏器功能损害,目前也有众多酒精性肝损伤及其防治方面的研究报道,但对酒精引起的肾损伤尚未引起足够重视。有研究提示酒精性肾损伤机制可能与乙醇在体内代谢过程中氧化应激、炎性反应损伤、毒性代谢产物蓄积、诱导多种细胞生长因子产生等直接或间接损害肾小球及肾间质最终引起肾间质纤维化有关[12],其中以机体在各种生长因子共同作用下不断刺激成纤维细胞过度增殖活化,持续分泌不易降解的胶原蛋白,引起合成和降解失衡,造成细胞外基质(Extracellularma-trix, ECM)异常沉积,损伤肾小管,引起肾间质纤维化为主要特征,但具体调控机制尚不明确。
肾间质纤维化严重程度与肾功能不全具有明确相关性,是引起酒精性肾功能衰竭的重要病理机制,间质成纤维细胞增殖、细胞外基质沉积、白细胞渗入、肾小管细胞凋亡和坏死等为其重要病理特征。MMPs是一类高度保守的依赖性内肽酶,是降解细胞外基质成分的主要酶系,可选择性地分解ECM的各种成分[13]。MMP-8主要由嗜中性粒细胞合成,亦称嗜中性粒细胞胶原酶,是一种专门降解细胞外基质成分的酶,既参与炎性反应刺激,还可通过增加I型胶原蛋白水解酶活性从而降解细胞外基质参与组织重塑[14]。TIMPs 是 MMPs 的内源性特异性抑制剂,TIMP-1参与心、肾重塑调节并作为心肾功能衰竭的标志物。当 MMPs/TIMPs调节异常时,细胞外基质合成增加、降解减少引起的基质沉积在肾间质纤维化的发生、发展中具有重要作用[8]。CTGF是一类新发现的细胞生长因子,广泛存在于人类组织中,尤以肾组织含量最多,被认为是导致胶原纤维重构的重要介质,参与肾脏、肝脏、肺等多脏器的纤维化过程,其机制可能与CTGF通过自身促进成纤维细胞有丝分裂、增殖、趋化性和黏附或者联合其他细胞因子调控肾系膜细胞的分化、细胞外间质合成与降解参与肾间质纤维化的发病过程[15-16]。CTGF还能直接诱导TIMP-1参与组织修复和重塑[17]。本研究发现,酒精性肾损伤小鼠出现明显肾小管间质纤维化,且CTGF、MMP-8表达水平明显上调,其抑制剂TIMP-1表达水平也代偿性上调,提示肾间质纤维化可能与CTGF信号通路及其调控的MMP-8/TIMP-1失调有关。
H2S是一种具有广泛生理功能的新型气体信号分子,由半胱氨酸通过光硫醚γ-裂解酶(GCL)和胱硫醚β-合酶(CBS)合成。目前多研究表明,H2S可通过抗氧化应激、抗炎、抑制细胞凋亡等对心血管系统起保护作用[18]。也有研究表明H2S具有增加肾血流量、肾小球滤过率和抑制蛋白尿等作用,还能防止足细胞损伤,保持肾小球结构的完整性等,从而对肾脏发挥保护作用[19]。本试验成功构建酒精性肾损伤小鼠模型,表明H2S干预可明显改善酒精性肾损害小鼠肾间质纤维化,同时肾脏组织中MMP-8、TIMP-1和CTGF蛋白的表达也显著下调,提示H2S可能通过下调CTGF信号通路及其调控的MMP-8/TIMP-1失调而抑制肾间质成纤维细胞的激活、增殖,减少细胞生长因子生成发挥抗纤维化作用,因此,抑制CTGF、MMP-8、TIMP-1表达对延缓酒精性肾损害所致肾间质纤维化有重要作用。

