窒息法致大鼠心脏骤停-心肺复苏模型造模成功率与生存率影响因素的探讨
曾瑞峰,钟悦嘉,赖成志,赖 芳,刘相圻,段云彪,李尊江,吴炎华,李 俊,丁邦晗*
(1.广州中医药大学第二附属医院,广东省中医院,广东省中医急症研究重点实验室,广州 510120;2.广州中医药大学,广州 510006;3.广州中医药大学深圳医院,广东 深圳 518034;4.江门市五邑中医院,广东 江门 529000)
心脏骤停(cardiac arrest, CA)是威胁人类生命的重要病因。 目前我国每年约有54.4 万人发生CA[1],院外心脏骤停(out-of-hospital cardiac arrest,OHCA) 自主循环恢复( return of spontaneous circulation, ROSC)的成功率约为5%,ROSC 后神经功能完好出院的成功率不足1%[2]。 因此深入开展CA 的相关研究,提高CA 患者复苏成功率有其长远意义。 但是由于CA 患者基线难以统一,大部分没有目击者, 因此心肺复苏( cardiopulmonary resuscitation, CPR)的临床研究难以开展[3]。 故通过建立标准化的动物模型来研究CPR 过程中的病理生理变化则显得尤为重要。 目前,关于优化CPR及了解CA 病理生理的研究多是通过建立动物模型实现[4-5],其中比较经典的是室颤法和窒息法[6]。
窒息法诱导的CA 由于实验操作相对简单,更符合心脏骤停后综合征(post cardiac arrest syndrome, PCAS)的脑损伤机制[7],为国内外研究机构广泛采用于PCAS 的研究[8-9]。 但是,由于动物来源、实验条件、研究方案等不同,从而影响了实验结果的可比性[10]。 此外,建立稳定的窒息法心脏骤停- 心肺复苏(cardiac arrest-cardiopulmonary resuscitation, CA-CPR)动物模型,需要考虑体重,生理状况和其他特征的影响[11]。 本研究通过对窒息法大鼠CA-CPR 模型的观察,探讨影响大鼠CACPR 模型ROSC 及存活的可能相关因素,为建立一种稳定的窒息法CA-CPR 大鼠模型提供实验依据。
1 材料和方法
1.1 实验动物
实验用动物由广州中医药大学动物实验中心提供[SCXK(粤)2018-0034],50 只清洁级Sprague-Dawley(SD)成年雄性大鼠,周龄6~10 周,体重(330±50) g。 本实验在中山大学心肺脑复苏研究所进行[SYXK(粤)2013-0094],方案经中山大学实验动物管理与使用委员会、中山大学动物实验伦理审查委员会表决批准通过(DB-15-1207),动物处置方法符合动物伦理学标准,并遵循实验动物的3R 原则,给予人道的关怀。
1.2 主要试剂与仪器
戊巴比妥钠(美国Sigma 公司);氯化琥珀胆碱(西安力邦制药); 0.9%氯化钠注射液(四川科伦药业);肝素钠注射液(江苏万邦生化医药);盐酸肾上腺素注射液(武汉远大制药);大鼠机械复苏联合有创呼吸机装置(中山大学心肺脑复苏研究所自主研发);除颤监护仪(M 系列 卓尔);多参数生理参数监护仪(雅培)。
1.3 实验方法
1.3.1 实验分组
本实验采用前瞻性观察性研究的分析方法,50只SD 大鼠进入实验,根据体重与周龄的关系[12],分为Ⅰ(250~300 g)、Ⅱ(300 ~350 g)、Ⅲ组(350 ~400 g);再根据是否ROSC、是否存活6 h、24 h、72 h 进行亚组分析。 三组放于同一房间以相同饮食饲养,室温控制在(24±2)℃,湿度(50±5)%,昼夜交替(12 h:12 h)。
1.3.2 造模步骤
(1)动物术前准备及麻醉
大鼠在实验前一天禁食,不禁水,可自由活动。称量大鼠重量,用戊巴比妥钠(45 mg/kg)腹腔注射麻醉,必要时追加剂量。 大鼠常规编号,备皮,仰卧位固定于手术板上。 造模阶段,采用电热毯保暖。经口直视插入14 号气管鞘管。 左股动脉置入23 号Pe-50 聚乙烯管,近端三通管、压力传感器连接多参数生理参数监护仪,以实时监测平均动脉血压(mean arterial pressure, MAP)。 将相应电极针插入大鼠肢体的皮肤下,持续心率(heartheart rate,HR)、心电监护。
(2)大鼠窒息性CA 的诱导
手术完成后,待大鼠苏醒记录基线HR、MAP 和肛温。 注射氯化琥珀胆碱0.2 mL 诱导大鼠肌松,封堵气管导管诱导大鼠窒息。 将开始窒息至MAP 降至20 mmHg 以下的时间定义为窒息致心脏停搏(asphyxia -cardiac arrest, ACA)时间。 间歇6 min 后开始心肺复苏。
(3)复苏模型制备
利用CPR 装置进行频率为250 beat/min 的胸外按压和50 beat/min 的同步机械通气。 按压深度胸廓前后径的1/3,吸入氧浓度为100%,潮气量0.6 mL/100 g。 推注肾上腺素0.01 mg,2 min 注射1次。 直至ROSC 或复苏失败(CPR 10 min 后仍未ROSC)。 出现室颤,进行2 J 双向波除颤。
(4)ROSC
MAP≥60 mmHg 后暂停胸外按压,维持呼吸机通气;MAP≥60 mmHg 且持续5 min 的室上节律,被认定为ROSC,造模成功。
(5)脱机、拔管及创口缝合
复苏后继续机械通气及持续监测血压和心率1 h,如果生命体征平稳则可停止机械通气和拔除各种导管,结扎血管,放入鼠笼内,自由饮食饮水,室温控制在26℃。
1.3.3 观察指标
(1)基线资料:记录手术后诱导窒息前大鼠的MAP、HR 及肛温,ACA 时间,CA 持续时间,CA 后初始心律(心室停搏、心室颤动、无脉性电活动);
(2)复苏资料:大鼠ROSC 成功率、CPR 时间(指心肺复苏开始计时至ROSC 的时间);ROSC 后的血流动力学:以ROSC 即刻记为0 min,记录0 min、15 min、30 min、45 min、60 min 的MAP 和HR。
(3)生存率及神经功能缺损评分(NDS 评分):记录72 h 内大鼠生存率及6、24、72 h NDS 评分。NDS 评分(0~80 分,0 分脑死亡,80 分完全正常)从大鼠一般行为缺失、脑干功能、运动、感觉、行为、癫痫发作等不同方面评价大鼠脑神经功能[13]。
1.4 统计学方法
实验数据采用SPSS 17.0 统计软件包建立数据库并完成统计。 计量资料符合正态分布的数据以平均数±标准差()表示,不符合正态分布的数据以中位数(四分位数)表示。 两组间比较,符合正态分布、方差齐的数据采用t 检验;不符合正态分布及方差齐性的数据采用Wilcoxon-Mann-Whitney 检验。 多组间比较,方差齐采用单因素方差分析或Kruskal-Wallis H 检验。 计数资料比较采用χ2检验。采用Kaplan-Meier 进行生存分析。 采用二分类Logistic 回归评估相关指标与分类结果的关系。 检验水平α=0.05。
2 结果
2.1 三组大鼠诱导窒息前一般情况
50 只大鼠全部纳入窒息造模,大鼠按体重分为Ⅰ组(250~300 g,10 只)、Ⅱ组(300~350 g,30 只)、Ⅲ组(350~400 g,10 只),手术前三组大鼠反应敏捷,体毛光泽,饮食正常。 手术后诱导窒息前三组大鼠的肛温、MAP、HR、ACA 时间、CA 持续时间、CA初始心律等基线资料比较,差异均无统计学意义(均P >0.05),见表1。
2.2 三组大鼠复苏数据的比较
2.2.1 ROSC 成功率、CPR 时间、除颤次数
Ⅰ组、Ⅱ组、Ⅲ组CA-CPR 造模成功例数(ROSC例 数) 分 别 为 9 (90.00%)、 18 (60.00%)、 6(60.00%),其中Ⅱ组有1 只大鼠ROSC 维持小于15 min,三组的ROSC 成功率、除颤次数对比无统计学差异(均P >0.05)。 Ⅰ组表现出更短的CPR 时间,与Ⅱ组、Ⅲ组比较,均存在统计学差异(P <0.05,详见表2)。
2.2.2 ROSC 后血流动力学
ROSC 后1 h 的血流动力学比较,Ⅰ组大鼠在ROSC 后第30 min 的HR 对比上,与Ⅱ组大鼠存在统计学差异(P <0.05),与Ⅲ组大鼠不存在统计学差异(P >0.05);余时间段HR、MAP 比较,三组大鼠均未表现出统计学差异(均P >0.05,详见表3)。
2.3 生存分析
运用Kaplan-Meier 生存分析比较三组的累积生存时间,Ⅰ组、Ⅱ组、Ⅲ组的72 h 的生存率分别是55.6%、16.7%和16.7%。 用Log rank法对三组累积生存分布的差异进行检验,差异不具有统计学意义,χ2=3.696,P=0.158(参见图1)。
2.4 NDS 评分
三组大鼠6 h、24 h、72 h 的NDS 评分的分布无统计学差异。 48 h 的NDS 分布不全相同,差异具有统计学意义(H= 6.247, P= 0.044);采用Bonferroni 法校正显著性水平的事后两两比较发现,48 h NDS 评分的分布在Ⅰ组和Ⅱ组(调整后P=0.051)、Ⅰ组和Ⅲ组(调整后P=0.185)、Ⅰ组和Ⅲ组(调整后P=1.0)的差异无统计学意义(详见表4)。
2.5 一般情况与模型结局的相关性分析
2.5.1 一般情况与ROSC、存活6 h、24 h、72 h 的单因素分析
经统计发现,ROSC 与存活24 h 的大鼠,具有更长的ACA 时间更长(226.00(195.50,251.50)s 及236.00(195.50,251.50)s)。 存活6 h 与存活72 h的大 鼠 体 重 较 低(分 别(315.64 ± 25.78) g 和(329.41±22.60 g));存活24 h 与存活72 h 的大鼠,基础HR 更低(分别(419.93±23.76) 次/分、(417.44±22.88)次/分,(均P <0.05)。 基线的肛温、MAP、CA 持续时间与大鼠的结局无统计学相关性(均P >0.05)。
表1 三组大鼠的诱导窒息前一般情况比较()Table 1 Baseline data for the three groups

表1 三组大鼠的诱导窒息前一般情况比较()Table 1 Baseline data for the three groups
注:三组间比较,#P<0.05, 与Ⅰ组比较,☆P<0.05。 计量资料组间比较采用单因素方差分析,计数资料比较采用Fisher 确切检验法。Note.Comparison between three groups, #P<0.05.Compared with Group Ⅰ, ☆P<0.05.One-way ANOVA analysis was used for measurement data comparisons between groups, and Fisher’s exact test was used for enumeration data comparison.
组别GroupsⅠ组(n=10)Group ⅠⅡ组(n=30)Group ⅡⅢ组(n=10)Group Ⅲ检验值Test value P 值P value体量(g)Weight 289.60±7.56☆ 325.3±10.79☆ 360.20±2.66☆ F=455.532# <0.001肛温(℃)Temperature 35.79±0.58 35.47±0.97 35.77±0.95 F=0.702 0.501心率(次/分)HR 427.00±27.53 439.33±26.53 442.30±15.96 F=1.141 0.328平均动脉压(mmHg)MAP 121.30±11.74 127.30±12.95 128.90±6.30 F=1.262 0.292窒息致心脏停搏时间(s)Asphyxia to cardiac arrest time 220.60±34.94 207.87±30.11 212.60±31.14 F=0.631 0.537心脏骤停持续时间(s)Cardiac arrest duration 363.60±6.64 362.77±5.98 363.20±6.63 F=0.072 0.931心室停搏Asystole 0 2 2心室颤动Ventricular fibrillation 0 0 0 χ2=2.378# 0.214无脉性电活动Pulseless electrical activity 10 28 8

表2 三组大鼠的复苏数据比较Table 2 Comparison of resuscitation data of three groups of rats
表3 三组大鼠的ROSC 后的血流动力学比较( ,M (QL, QU))Table 3 Hemodynamic comparison of three groups of rats after ROSC

表3 三组大鼠的ROSC 后的血流动力学比较( ,M (QL, QU))Table 3 Hemodynamic comparison of three groups of rats after ROSC
注:三组间比较,★P<0.05,与Ⅰ组比较,☆P<0.05。 组间比较采用单因素方差分析;#,采用Kruskal-Wallis H 检验;*,n=17。Note.Comparison between three groups,★P<0.05.Compared with Group Ⅰ, ☆P<0.05.Comparisons between groups were used by One-way ANOVA analysis.#, Compared by Kruskal-Wallis H test.*, n=17.
?

图1 三组大鼠的ROSC 后Kaplan-Meier 生存曲线Figure 1 Kaplan-Meier survival curve after ROSC in three groups of rats
2.5.2 一般情况与结局的二分类Logistic 回归分析
将体重、肛温、HR、MAP、ACA 时间、CA 持续时间,共6 项为自变量,分别纳入是否ROSC(χ2=25.115,P <0.001)、存活6 h(χ2= 11.760,P =0.003)、存活24 h(χ2=10.300,P=0.001)、存活72 h(χ2=14.191,P=0.001)的多因素二分类Logistic回归分析,获得的回归方程具有统计学意义。 其中ROSC 与ACA 时间呈正相关;存活6 h 与体重呈负相关,ACA 时间呈正相关;存活24 h 与HR 呈负相关;存活72 h 与体重、HR 呈负相关(均P <0.05,详见表5)。
3 讨论
CA 患者ROSC 后会出现类似脓毒症样改变,导致多器官功能障碍综合征的症状而导致预后差[14],可能与机体经过缺血、缺氧、再灌注损伤等一些列打击后,血管活性物质、炎症因子、神经内分泌调节、血流动力学等处于混乱状态,导致全身组织器官血流灌注不足,使脏器功能逐渐受损,这一系列反应被称为PCAS。 基于伦理的要求,目前关于PCAS 的干预研究,大部分都从动物实验开始论证[15]。 但由于各个实验室的动物来源、实验室条件、总体研究方案的不同,而影响了结果的可比性[16]。 本研究希望窒息法致大鼠CA-CPR 模型,并从ROSC 成功率、复苏后器官血流动力学情况、神经功能评分、生存结局等方面来分析和探讨影响造模成功率的因素。
3.1 CA-CPR 模型造模成功的影响因素
3.1.1 CA-CPR 模型造模与一般情况的关系
研究发现,体重较轻的大鼠在ROSC 成功率以及生存率方面显示出更好的趋势,而且这种趋势在神经功能(NDS 评分)以及复苏后的血流动力学方面均存在;ACA 时间、基线的心率、体重与结局相关。
学者通过内分泌、骨龄等评估,证实大鼠的周龄与体重呈正相关[12],老年鼠与成年鼠对比,耐受缺氧的能力更差,表现为心排量、心率的下降[17]。 病理状态下心率、平均动脉压与心排量均为正相关[18],但是也有文献证明心排量在某个区间,三者的关系非线性而是呈压力-容积曲线环的关系[19]。 全身麻醉后行动脉置管的大鼠,基础心率都会上升并维持一段较长的时间,这可能与麻醉、手术的应激有关[20]。 不同的麻醉药物对循环系统影响虽有一定差别,但总体是负性影响[21-22]。
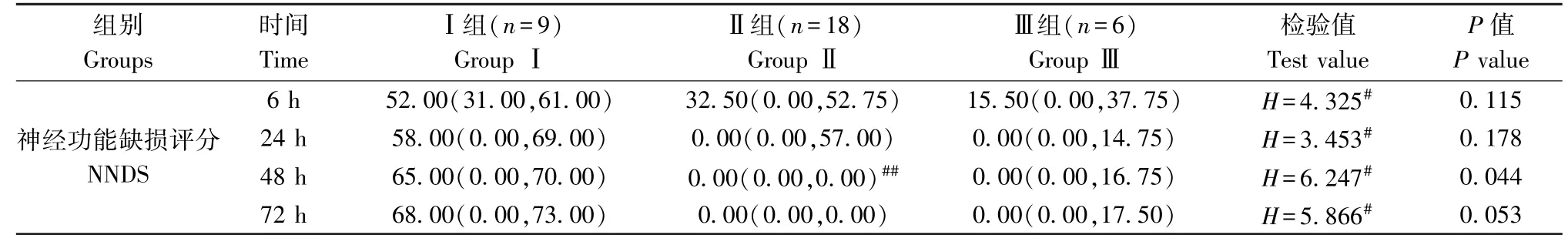
表4 三组大鼠的ROSC 后的NDS 评分比较(M (QL, QU))Table 4 NDS Comparison between three groups of rats after ROSC
表5 一般情况与模型结局的Logistic 分析(,M (QL, QU))Table 5 Logistic analysis between baseline data and model outcome
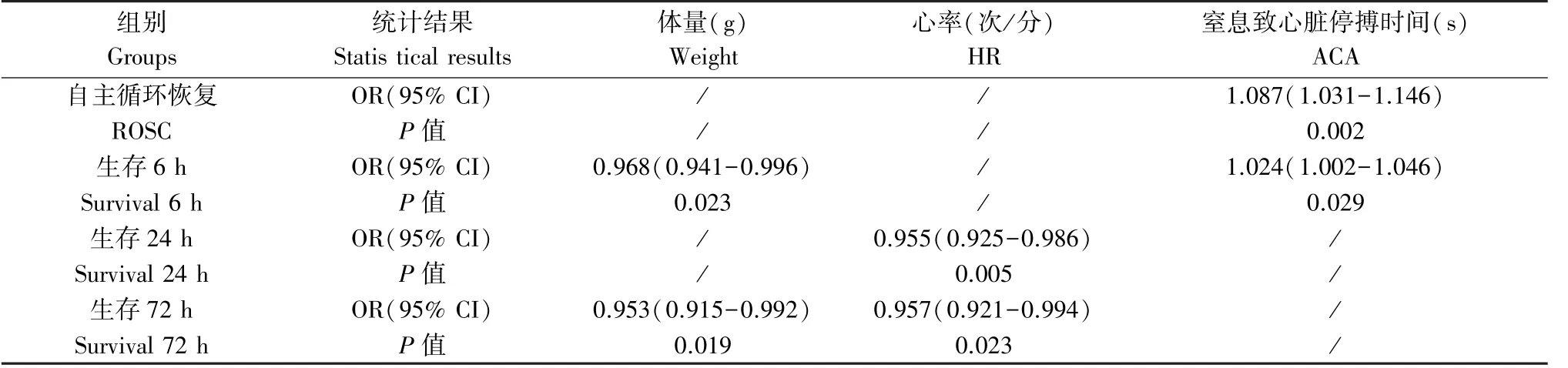
表5 一般情况与模型结局的Logistic 分析(,M (QL, QU))Table 5 Logistic analysis between baseline data and model outcome
组别Groups统计结果Statis tical results体量(g)Weight心率(次/分)HR窒息致心脏停搏时间(s)ACA自主循环恢复 OR(95% CI) / / 1.087(1.031-1.146)ROSC P 值 / / 0.002生存6 h OR(95% CI) 0.968(0.941-0.996) / 1.024(1.002-1.046)Survival 6 h P 值 0.023 / 0.029生存24 h OR(95% CI) / 0.955(0.925-0.986) /Survival 24 h P 值 / 0.005 /生存72 h OR(95% CI) 0.953(0.915-0.992) 0.957(0.921-0.994) /Survival 72 h P 值 0.019 0.023 /
本研究各组大鼠手术后平均动脉压无统计学差异,经回归分析发现大鼠的心率越慢,24 h 及72 h的生存率越高;ACA 时间越长ROSC 成功率与6 h的生存率越高。 这与麻醉及手术的损伤、心脏储备、耐受缺氧能力有关。 因此,基线的心率低、ACA时间长、体重轻的大鼠,总体预后较好。
3.1.2 CA-CPR 模型造模与实验技术的关系
若实验者气管插管、动脉置管的技术不娴熟,则出现手术时间过长,甚至需要追加麻醉药,导致手术的损伤大、麻醉相关不良反应多,最终影响心脏的储备功能,降低造模成功率。 因此,提高相关手术的熟练程度,减少手术的损伤,缩短手术时间,减少麻醉用量,可能是提高CA-CPR 模型的造模成功率的重要手段。
3.2 CA-CPR 模型的动物模型选择与生产率转化之间的探讨
动物实验中,由于老年鼠的器官机能较成年鼠低下,同时可能存在各种合并疾病,所以一般选择6-8 周的大鼠进行实验[23]。 但如果研究对象是老年特有的状态,如认知功能[24]、老年心肌功能[25]或衰老机能[26],则仍会选择老年鼠。
临床上,大多数CA 的患者均为高龄且合并多种慢性疾病[27],这些合并症可能会影响CA 的病理生理并改变治疗方法[28],目前选择的动物模型无法真正模拟临床CA 的严重程度[29-31],这会限制将研究结果从动物模型转化为临床环境的能力[6]。 因此国内外的CA-CPR 模型往往会选择周龄较大的成年鼠作为研究对象[8]。 但是本研究表明,体重轻(周龄小)的大鼠更容易实现ROSC,如何在这两方面取得平衡,需要开展后续的CA-CPR 模型研究。
此外,窒息是导致儿童CA 的主要原因[32],院内心脏骤停多数源于呼吸衰竭[33],所以窒息法造模对应的此类CA。 同时临床抢救CA,更多的是实施基础生命支持,而非已经行高级气道的高级生命支持[34]。 虽然大多数动物实验都是实施标准化的CPR,但在CPR 期间的移位或其他干预对冠状动脉灌注压、心肌血流的潜在影响使胸外按压质量的评估成为在CPR 期间需要测量的重要参数。 尤其在无盲法的研究中,评价胸外按压质量更加重要。 这些因素均需要在CPR 动物研究中有所考虑。
4 结论
本研究探讨窒息法致大鼠CA-CPR 模型的造模成功率、生存结局分析的影响因素。 研究发现,在标准造模条件下,体重较轻的成年鼠,具有较高的建模成功率;大鼠的基线心率、体重与大鼠的生存结局成负相关,ACA 时间与良好的结局呈正相关。

