慢病毒介导Fg12 基因沉默技术对自身免疫性心肌炎大鼠Th1/Th2 漂移及Th17/Treg 平衡的影响
张晶晶,刘 婕,杨占峰,孙 岩,岳丽晓,何群力
(郑州工业应用技术学院 医学院,河南 新郑 451100)
自身免疫性心肌炎是一种由T 细胞介导的自身免疫性疾病,多项研究均显示,Th1/Th2 细胞漂移和Th17/Treg 细胞平衡与疾病进展密切相关[1-3]。Th1 细胞和Th17 细胞主要分泌促炎细胞因子IFN-γ和IL-17,而Th2 细胞和Treg 细胞主要分泌抑炎细胞因子IL-4 和TGF-β[4]。 当T 细胞亚群从Th1 向Th2 漂移或Th17 细胞减少而Treg 细胞增加时,则表明机体炎症反应被抑制,反之能表明炎症反应加剧。 Fg12 凝血酶原酶是一种II 型跨膜糖蛋白,其在免疫调节和凝血过程中发挥重要作用。 目前,Fg12基因的研究主要集中在肝病方面,多项研究均报道Fg12 蛋白具有促炎作用,由于自身免疫性心肌炎的病理过程与炎症反应和纤维化密切相关,因此,本研究推测Fg12 基因可能参与疾病的发生发展[5-6]。本研究通过建立自身免疫性心肌炎大鼠模型,应用慢病毒介导Fg12 基因沉默技术敲低大鼠Fg12 基因,旨在探讨Fg12 基因表达与Th1/Th2 漂移及Th17/Treg 平衡之间的关联,以期为自身免疫性心肌炎的治疗提高理论依据。
1 材料和方法
1.1 实验动物
6 周龄Sprague Dawley(SD)雄性SPF 大鼠购自凯学生物科技(上海)有限公司[SCXK(沪)2018-0006],体重为200~220 g,共40 只。 动物购回后在郑州工业应用技术学院医学系动物饲养室内饲养[SYXK(豫)2019-0011]。 大鼠在25℃、55%相对湿度、12 h 光暗循环的环境中,给予大鼠标准饲料和自来水饲养。 本研究已获得我院伦理审查委员会批准(ZZGYXY-20190314)。
1.2 主要试剂与仪器
慢病毒Fgl2 载体以及携带绿色荧光蛋白慢病毒空载体由上海吉凯基因化学公司进行合成;MAC 1200ST 心电分析仪和GE logic E9 心脏超声诊断仪均由美国GE Marquette 医疗系统公司生产;完全弗氏佐剂和猪心肌球蛋白购自美国Sigma 公司;TRIzol试剂购自美国 Invitrogen 公司; PrimeScript RT reagent 试剂盒和SYBR Premix Ex Taq 购自日本TaKaRa 公司;快速7500 型荧光定量PCR 仪和TaqMan MicroRNA 测定试剂盒购自美国Applied Biosystems 公司;组织细胞总蛋白抽提试剂盒P1250购自北京普利莱基因技术有限公司;BCA 蛋白定量试剂盒购自上海碧云天生物技术公司;IFN-γ、IL-17和TGF-β 一抗购自美国Cell Signaling Technology 公司;IL-4、TGF-β 和β-actin 一抗购自美国Sigma Aldrich 公司。
1.3 实验方法
1.3.1 实验动物分组
将大鼠随机分为4 组,即对照组(NC 组)、模型组(Model 组)、空载组(Vehicle 组)、Fgl2-RNAi 慢病毒组(RNAi 组),每组10 只。
1.3.2 自身免疫性心肌炎大鼠模型的建立
参考文献[7]所述方法进行自身免疫性心肌炎大鼠模型的建立。 将猪心肌球蛋白加入0.15 mol/L的PBS 溶液中进行溶解,终浓度调整为2 mg/mL。猪心肌球蛋白溶液与完全弗氏佐剂进行等体积混合,得到乳浊液。 在模型组、空载组和Fgl2-RNAi 慢病毒组SD 大鼠双侧腹股沟处注射猪心肌球蛋白乳浊液1 mL,即2 mg。 此外,将等体积的PBS 与完全弗氏佐剂混合,在对照组大鼠相同部位进行注射。所有大鼠共注射7 d 进行免疫。
1.3.3 Fgl2-RNAi 慢病毒处理
慢病毒Fgl2 载体以及携带绿色荧光蛋白慢病毒空载体由上海吉凯基因化学公司进行合成。 将包装好的Fgl2-RNAi 慢病毒1 mL 加入到生理盐水中溶解混匀,制备终体积为200 μL/mL 的慢病毒混合液。 将携带绿色荧光蛋白的空载体慢病毒1 mL加入到生理盐水中进行溶解混匀,制备终体积为200 μL/mL 的慢病毒空载体混合液。 然后对Fgl2-RNAi 慢病毒组大鼠尾静脉注射0.5 mL 的混合液,其中含有100 μL 的Fgl2-RNAi 慢病毒。 空载组大鼠注射等体积的慢病毒空载体混合液。
1.3.4 心脏功能监测
MAC 1200ST 心电分析仪和GE logic E9 心脏超声诊断仪均由美国GE Marquette 医疗系统公司生产。 分别于免疫第0 天和第28 天检测各组大鼠的心脏功能,大鼠腹腔注射戊巴比妥钠进行麻醉,然后将大鼠仰卧固定在桌面上进行胸部脱毛,然后通过心脏彩超心动图检测,并获取左室收缩末期的横径(LVEDs)、左室舒张末期的横径(LVEDd)、射血分数(LVEF%)和左室短轴的缩短分数(FS%)等指标。
1.3.5 大鼠心肌病理学检查
在初次免疫第28 天时处死大鼠,开胸取出心脏,然后沿冠状面纵切心脏分为两份。 一份应用4%多聚甲醛进行固定,另一份冻存于-80℃冰箱。将4%多聚甲醛固定的心肌组织进行梯度乙醇脱水及二甲苯透明,然后石蜡包埋,制作厚度4 μm 的切片。 然后将贴片进行常规HE 染色,主要步骤包括二甲苯脱蜡,每次10 min,然后无水乙醇洗脱二甲苯5 min,梯度乙醇进行脱水,然后蒸馏水洗片5 min,苏木素染色5 min,在用蒸馏水洗片,依次在1%的盐酸和碳酸锂中浸泡3 s,之后用蒸馏水洗涤10 min。 然后用伊红染色5 min,梯度乙醇脱水,然后二甲苯浸润2 次,室温干燥并封片。 在光学显微镜先观察切片,随机选取5 个视野并计算炎性细胞浸润及坏死面积占整个视野的百分比,然后对心肌炎症进行评分。 评分如下:<25%为1 分,25 ~50%为2分,51~75%为3 分,>75%为4 分。
1.3.6 qRT-PCR
使用TRIzol 试剂提取大鼠组织的总RNA。 使用PrimeScript RT reagent 试剂盒逆转录提取的RNA为cDNA,并使用TaqMan MicroRNA 测定试剂盒进行实时PCR 定量,总反应体积为20 μL。 使用SYBR Premix Ex Taq 在ABI Prism 快速7500 型荧光定量PCR 仪上进行qRT-PCR 分析,甘油醛3-磷酸脱氢酶(GAPDH)作为内参基因。 引物序列如下:Fg12,正向:5’-GATGGCTGGACGCGGTTAAAGGG-3’; 反 向:5’-TAATGTGGTGGTTAGGGGTGGT-3’;IFN-γ,正向:5’-GACTTTGGCAAAAGGTGGG-3’;反向:5’-TGGGGAATGTTGGTAGGT-3’;IL-17,正向:5’-CAGTTTGGTGGAAGGAGGCGA-3’; 反 向: 5’-TGCGGGAGTGGGCGGATGAGGT-3’;IL-4,正向:5’-CAGGGTTGAGGAGTTAAGGCGA-3’; 反 向: 5 ’-TGTGGGAGTACGGATGGGT-3’;TGF-β,正 向:5’-AGGTAAGTTAATGGTGGTGCGAC-3’; 反 向: 5’-TGTGGGAATGGGCGTGGAGTAGGT-3’;GAPDH,正向:5’-CCAGGTCAAGCTGCGAGAAC-3’;反向5’-TAAGACGCCAGTCGGGTGTGGA-3’。 PCR 反 应 条件如下,95℃3 min 预变性,95℃30 s 变性,60℃30 s退火,72℃30 s 延伸,30 个循环, 72℃5 min 延伸。 使用2-ΔΔCt方法计算相对表达量。
1.3.7 Western blot
使用组织细胞总蛋白抽提试剂盒P1250 提取大鼠心肌组织总蛋白。 应用BCA 蛋白定量试剂盒对蛋白进行定量,然后将蛋白质提取物进行10%SDS-PAGE 电泳并转移至PVDF 膜,室温下在5%脱脂乳中封闭30 min,然后与抗IFN-γ (1 ∶2000)、IL-17 (1 ∶1500)、IL-4 (1 ∶2000)、TGF-β (1 ∶1000)和βactin (1 ∶1000)的一抗4℃过夜孵育,然后在室温下与辣根过氧化物酶标记的二抗室温孵育2 h,并用增强化学发光法显色,使用Image 软件分析蛋白条带。
1.4 统计学方法
使用SPSS 18.0 软件进行统计学处理,数据表示为平均数±标准差()。 通过单因素方差分析评估组间差异,P<0.05 表示差异具有统计学显著性。
2 结果
2.1 慢病毒介导Fg12 基因沉默技术下调了大鼠心肌组织中Fg12 基因的表达
RT-PCR 结果证实(图1),与对照组(NC)相比,模型组(Model)和空载体组(Vehicle)的Fg12 mRNA 表达水平显著升高,然而Fgl2-RNAi 慢病毒处理组(RNAi)的Fg12 mRNA 表达水平显著低于模型组和空载体组。 表明慢病毒介导Fg12 基因沉默技术下调了大鼠心肌组织中Fg12 基因的表达。
2.2 各组大鼠超声心动图参数比较
表1 显示,各组大鼠的基线超声心动图参数LVEDs、LVEDd、LVEF 和FS 均无显著差异,在建模28 d 后,Model 组、Vehicle 组和RNAi 组的LVEDs 和LVEDd 均显著升高,并且RNAi 组显著低于Model组。 此外,Model 组、Vehicle 组和RNAi 组的LVEF和FS 均显著降低,而RNAi 组显著高于Model 组。
2.3 各组大鼠心肌组织HE 染色结果
建模28 d 后,发现Model 组、Vehicle 组和RNAi组大鼠的心肌组织中均出现不同程度的炎症反应,主要表现为心肌细胞肿胀或坏死、炎症细胞浸润、毛细血管扩张等,而NC 组未见明显炎症细胞浸润。但RNAi 组大鼠心肌组织的炎症细胞浸润程度低于Model 组。 炎症评分显示,Model 组、Vehicle 组和RNAi 组的炎症评分均显著高于NC 组,而RNAi 组的炎症评分明显低于Model 组。 详见图2。
2.4 Fg12 基因沉默对自身免疫性心肌炎大鼠Th1/Th2 漂移的影响
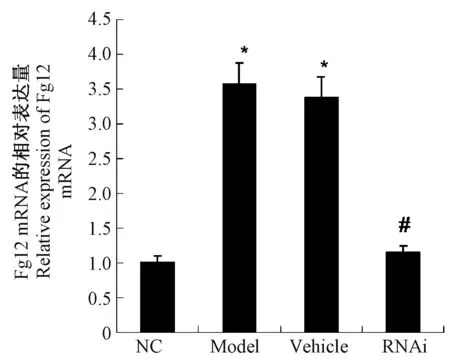
图1 各组大鼠心肌组织Fg12 基因的表达Note.Compared with NC group, *P <0.05.Compared with Model group, #P <0.05.Figure 1 Expression of the Fg12 gene in myocardial tissue of rats in each group
Th1 细胞可分泌促炎细胞因子IFN-γ,Th2 细胞可分泌抑炎细胞因子IL-4。 如图3 所示,建模28 d后, Model 组、Vehicle 组和RNAi 组大鼠心肌组织中的IFN-γ 和IL-4 mRNA 和蛋白表达水平均显示升高,说明三组大鼠心肌组织均出现明显的炎症反应。 然而,值得注意的是,RNAi 组大鼠心肌组织中的IFN-γ mRNA 和蛋白表达水平均显著低于Model组,而IL-4 mRNA 和蛋白表达水平均显著高于Model 组。 说明Fg12 基因沉默导致大鼠心肌组织中的辅助性T 细胞向Th2 细胞漂移,从而降低炎症反应。
2.5 Fg12 基因沉默对自身免疫性心肌炎大鼠Th17/Treg 平衡的影响
促炎细胞因子IL-17 主要由Th17 细胞分泌,而抑炎细胞因子TGF-β 主要由Treg 细胞分泌。 如图4 所示,建模28 d 后,Model 组、Vehicle 组和RNAi组大鼠心肌组织中的IL-17 和TGF-β mRNA 和蛋白表达水平均显示升高。 然而,RNAi 组大鼠心肌组织中的IL-17 mRNA 和蛋白表达水平均显著低于Model 组,而TGF-β mRNA 和蛋白表达水平均显著高于Model 组。 说明Fg12 基因沉默可抑制大鼠心肌组织中的Th17 细胞,而上调Treg 细胞,从而抑制炎症反应。
3 讨论
心肌炎是一种在青少年人群中较为常见的一种心血管疾病,主要致病原因为病毒感染。 心肌炎与其他心血管疾病的症状比较类似,因此临床诊断中也比较困难[8]。 目前,心肌炎的发病机制尚不清楚,许多专家认为心肌炎与病毒感染引起的心肌抗原自身免疫反应有关。 因此,目前的大多数病理研究着重于自身免疫性心肌炎的动物模型实验,该模型主要通过心肌球蛋白诱导动物心肌损伤及多核细胞浸润,其发病机制与病毒性心肌炎和人类巨细胞心肌炎类似[9]。

表1 各组大鼠超声心动图参数Table 1 Echocardiographic parameters of rats in each group
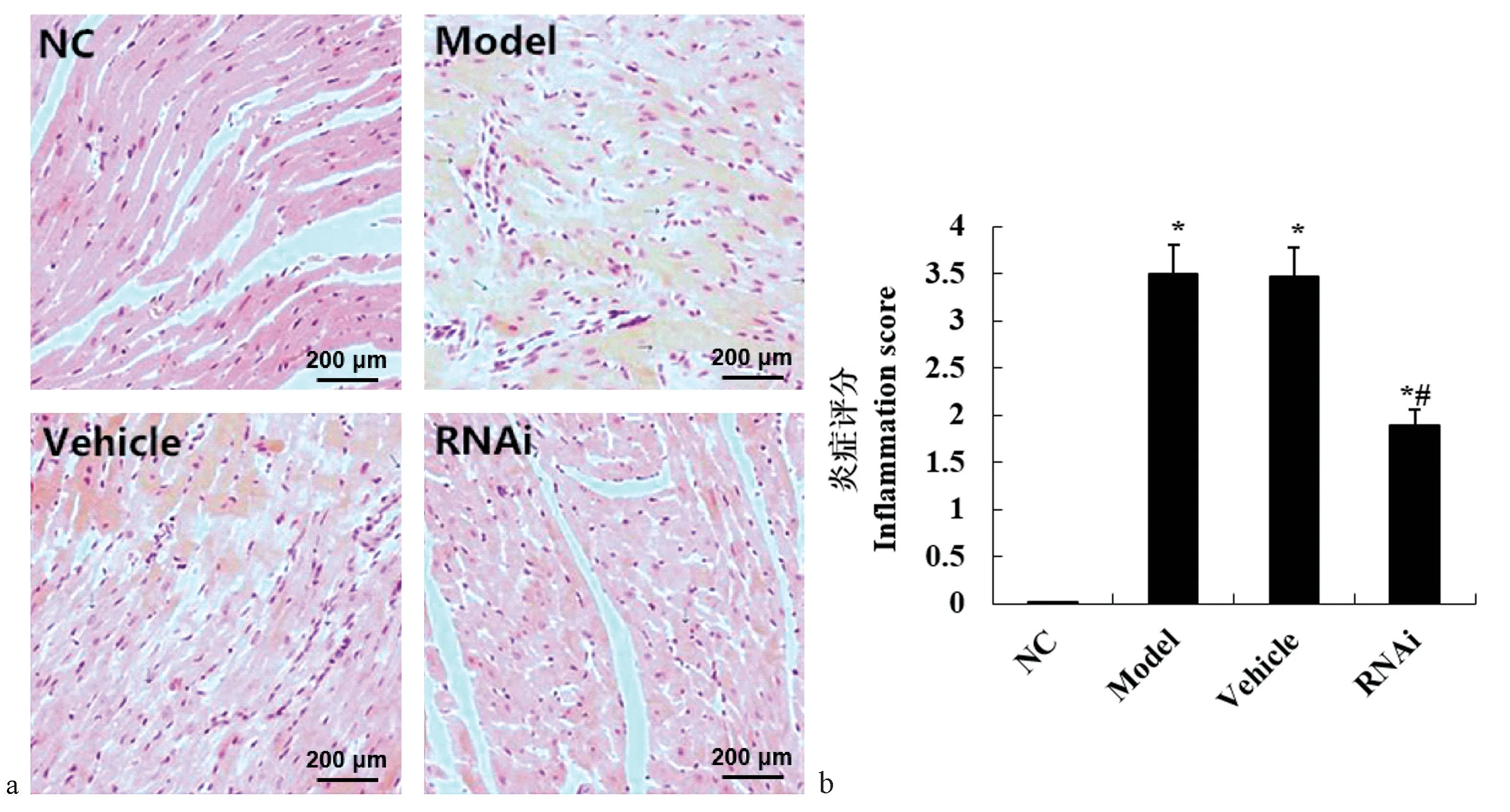
图2 各组大鼠心肌组织HE 染色结果Note.a, HE staining legend.b, HE staining inflammation score.Compared with NC group, *P<0.05.Compared with Model group, #P<0.05.Figure 2 Results of HE staining of myocardial tissue in each group
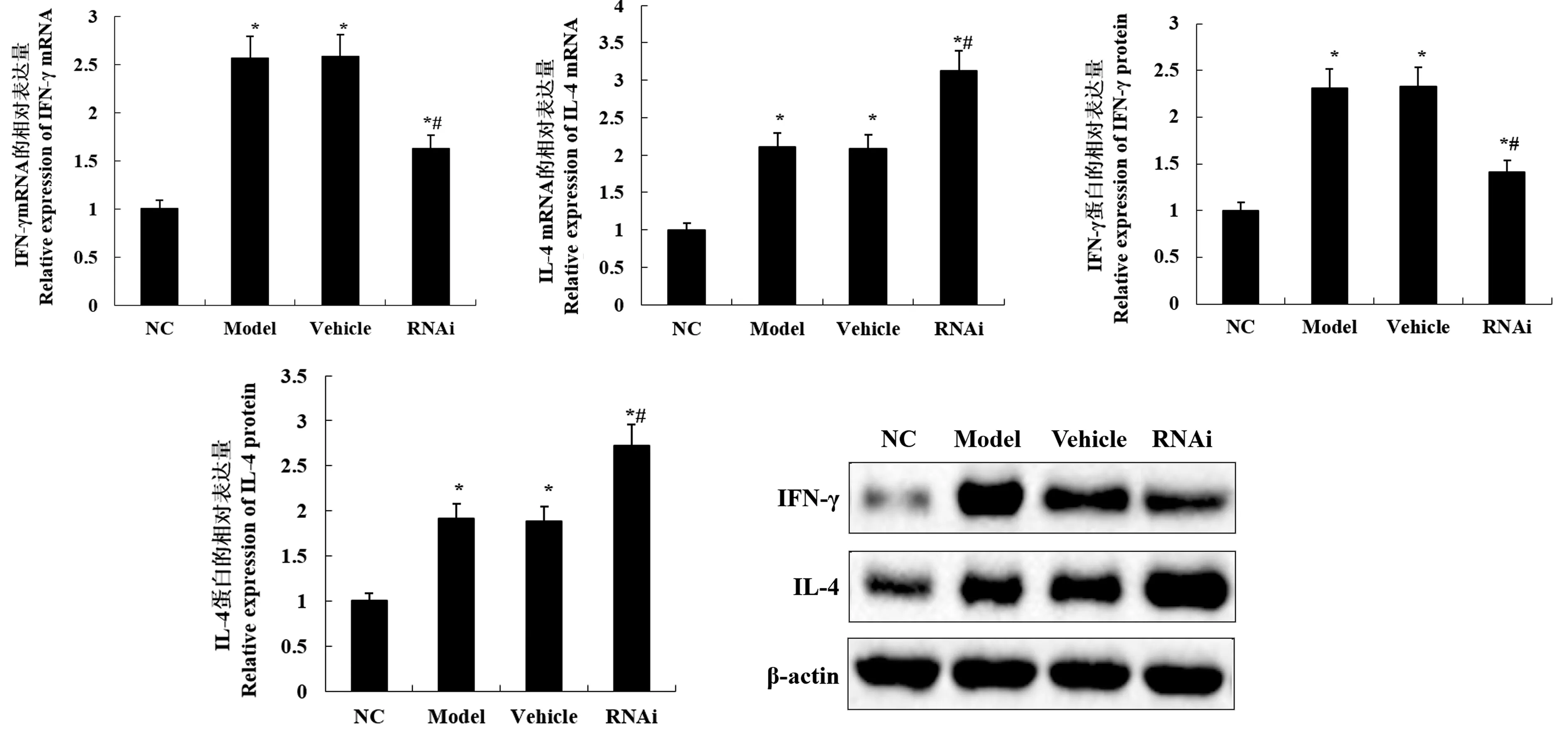
图3 Fg12 基因沉默对Th1/Th2 漂移的影响Note.a and b, Relative expression of IFN-γ and IL-4 mRNA in myocardial tissue of each group.c and d, Relative expression of IFN-γ and IL-4 protein in myocardial tissue of each group.e, IFN-γ and IL-4 protein bands.Compared with NC group, *P<0.05.Compared with Model group, #P<0.05.Figure 3 Effect of Fg12 gene silencing on Th1/Th2 drift

图4 Fg12 基因沉默对Th17/Treg 平衡的影响Note.a and b, Relative expression of IL-17 and TGF-β mRNA in myocardial tissue of each group.c and d, Relative expression of IL-17 and TGF-β protein in myocardial tissue of each group.e, IL-17 and TGF-β protein bands.Compared with NC group, *P<0.05.Compared with Model group, #P<0.05.Figure 4 Effect of Fg12 gene silencing on Th17/Treg balance
Fg12 凝血酶原酶是一种II 型跨膜糖蛋白,属于纤维蛋白家族,Fg12 蛋白可由血管内皮细胞和巨噬细胞表达,在免疫调节和凝血过程中发挥重要作用,Fg12 可将凝血酶原转化为凝血酶并导致形成不溶性纤维蛋白,从而加速纤维蛋白沉积及形成血栓[10]。 目前,Fg12 基因的研究主要集中在肝病方面,多项研究均报道Fg12 蛋白具有促炎作用,然而Fg12 基因与自身免疫性心肌炎发生发展的关系仍不明确[11]。 本研究建立了自身免疫性心肌炎大鼠模型,并应用慢病毒介导Fg12 基因沉默技术敲低大鼠Fg12 基因,研究显示,建模28 d 后,Model 组、Vehicle 组和RNAi 组的LVEDs 和LVEDd 均显著升高,并且RNAi 组显著低于Model 组。 此外,Model组、Vehicle 组和RNAi 组的LVEF 和FS 均显著降低,而RNAi 组显著高于Model 组。 由于LVEDd 是评价左室舒张功能的指标,而FS 是评价收缩功能,LVEDd 升高或FS 下降则说明心脏舒张功能发生障碍[12]。 LVEF 是LVEDs 与LVEDd 的比值,LVEF 下降则说明心脏收缩能力发生障碍[12]。 因此,本研究表明,Fg12 基因沉默可显著改善自身免疫性心肌炎大鼠的心脏功能。 此外,HE 染色结果也显示,Fg12基因沉默可显著降低大鼠心肌组织的炎症细胞浸润,从而抑制炎症反应。
自身免疫性心肌炎是一种由T 细胞介导的自身免疫性疾病,有关学者通常将CD4+T 细胞分泌的细胞因子分为Th1 和Th2 细胞,Th1 细胞因子具有介导细胞免疫和抗肿瘤免疫作用,比如IFN-γ 和IL-2;而Th2 某些细胞因子参与机体免疫逃逸机制,如IL-4 和IL-6。。 疾病发生早期主要分泌Th1 细胞因子,导致Th1/Th2 漂移。 Th1 和Th2 细胞因子的紊乱可诱导自身免疫性疾病的发展。 Th1 和Th2 细胞因子由机体T 淋巴细胞分泌并形成网络,正常情况下两种细胞因子通过互相影响并维持机体免疫功能的正常运作,IFN-γ 是自身免疫中出现较早的细胞因子,主要参与调节单核巨噬细胞的吞噬作用,IL-2 是维持机体正常免疫功能的细胞因子,具有广谱的免疫增强活性,IL-4 可抑制Th1 细胞因子的分泌,IL-6 则具有调节细胞增殖、凋亡和血管生成的作用。
此外,随着淋巴细胞亚群的划分越来越细,多项研究均显示,新的亚群如Th17 细胞和Treg 细胞的平衡性也与自身免疫性心肌炎的发病机制有关。Th17 细胞分泌的IL-17 细胞因子在急性病毒性心肌炎患者中显著升高[13],而且IL-17 也参与调节Th1细胞的分化及Treg 细胞对细胞因子TGF-β 的分泌过程,而包括CD4+CD25+Treg 细胞在内的Treg 细胞在免疫调节中具有重要作用[14]。 现有研究均证实,Th1 和Th17 细胞主要表现为促炎症反应,而Th2 和Treg 细胞主要表现为抑制炎症反应[15]。 Th17 和Treg 细胞之间的平衡影响疾病的进展,如果平衡从Treg 细胞向Th17 细胞移动,即Th17/Treg 细胞比率升高,则疾病的严重程度会显著升高。 Th17 细胞通过分泌IL-6 和IL-17 而发挥促炎作用,而Treg 细胞通过分泌TGF-β 和IL-10 在抑制炎症过程中起关键作用[15]。
因此,Th1/Th2 漂移及Th17/Treg 平衡可反应自身免疫性心肌炎的严重程度。 本研究发现,建模28 d 后, Model 组、Vehicle 组和RNAi 组大鼠心肌组织中的IFN-γ、IL-4、IL-17 和TGF-β mRNA 和蛋白表达水平均显示升高,说明三组大鼠心肌组织均出现明显的炎症反应。 然而,值得注意的是,RNAi 组大鼠心肌组织中的IFN-γ 和IL-17 mRNA 和蛋白表达水平均显著低于Model 组,而IL-4 和TGF-β mRNA和蛋白表达水平均显著高于Model 组。 说明Fg12基因沉默导致大鼠心肌组织中的辅助性T 细胞向Th2 细胞漂移,并且下调Th17 细胞,而上调Treg 细胞,从而纠正Th1/Th2 漂移及Th17/Treg 细胞平衡,并缓解心肌炎症反应。
综上所述,本研究表明Fg12 基因通过调节Th1/Th2 漂移及Th17/Treg 平衡来参与自身免疫性心肌炎的发生发展,Fg12 基因沉默可显著改善自身免疫性心肌炎大鼠的心脏功能,并降低心肌炎症反应。

