神经营养因子-3 基因修饰的骨髓间充质干细胞和水凝胶联合应用对脊髓损伤模型大鼠的治疗作用研究
赵宣淇,张 钰,秦 川,张 玲
(中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,北京 100021)
脊髓损伤(spinal cord injury, SCI)是一种严重的、破坏性的中枢神经系统疾病,对患者的生活质量和预期寿命都有很大的影响[1-2]。 20 年前发病主要集中于青壮年人[3],多由于高能量暴力损伤胸腰段脊髓;近年来,随着人口老龄化,SCI 发病主要集中在65 岁至74 岁之间的男性,脊柱退行性病变、颈椎不稳导致颈部脊髓损伤[4]。 每名脊髓损伤患者社会保障和长期护理经济成本约为110 ~460 万美元[5]。 传统的治疗方法主要包括手术治疗、药物治疗、康复治疗、心理治疗、并发症与合并症的治疗[6],但效果并不明显。 近年来,动物实验中多采用神经生长因子和可降解组织工程学支架治疗[7];临床试验中多采取间充质干细胞治疗,但效果并不稳定[8-10]。
骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSC)来源丰富、分离简单、低免疫原性、没有伦理学争议[11],是骨髓中最丰富的细胞,也是造血和功能支持细胞,一定条件下可跨胚层诱导分化。 在组织修复和重建领域,尤其是在中枢神经损伤修复方面具有广阔的应用前景[12-13]。 神经营养因子-3(neurotrophic factor 3,NT-3)由神经所支配的组织和星形胶质细胞产生的,并为神经元生长与存活所必需的蛋白质分子。 通过可以保护神经元,促进轴突再生,对神经损伤修复有促进作用,但半衰期较短,吸收率低,不能持续作用[14]。 水凝胶(hydrogels)作为可降解组织工程学支架功能性地桥接断脊髓断端,为新生突触网络架起神经传递信号的上下行传递的桥梁[15],为细胞、因子提供三维生长环境并实现缓慢释放。 本研究旨在探索BMSC+hydrogels+NT-3 三者结合的联合治疗方法,希望对脊髓损伤后神经修复与再生提供新思路。
1 材料和方法
1.1 实验动物
8 周龄SPF 级SD 雄性大鼠48 只,体重220 ~250 g,来源于北京华阜康生物科技有限公司[SCXK(京)2019-0008],动物在标准化条件下饲养于中国医学科学院医学实验动物研究所、北京协和医学院比较医学中心南院屏障环境中[SYXK(京)2018-0019]。 实验操作经本单位动物伦理委员会审批(QC19010)。 大鼠自由饮食和饮水,环境温度控制为22℃~28℃,相对湿度为40%~60%,饲养环境每日光照时间为12 h,整个动物实验过程中严格按实验动物使用的3R 原则给予实验动物人道关怀。
1.2 主要试剂与仪器
α-MEM 培养基(Minimum Essential Medium α,α-MEM)、0.25%胰酶+EDTA(Trypsin-EDTA)、胎牛血清(fetal bovine serum, FBS)、5%青-链霉素双抗( Penicillin-Streptomycin, PS )、 磷 酸 缓 冲 盐(phosphate buffered saline, PBS)(Gibco,美国);SD大鼠骨髓间充质干细胞诱导分化试剂盒(赛业生物科技有限公司,中国);含有NT-3 完整编码序列的重组慢病毒(合生基因生物科技有限公司,中国);水凝胶试剂盒(广州大洲医学科技有限公司,中国);HE 和免疫组化染色试剂盒(北京中杉金桥生物技术有限公司,中国)和相关抗体(Cell signaling technology,美国);倒置相差显微镜(Olympus,日本);细胞培养箱(Thermo,美国);离心机、Western blot 仪(Bio-rad,美国);超净工作台、显微镜及成像系统(Leica,德国);场发射透射电子显微镜(JEOL,日本)。
1.3 实验方法
1.3.1 骨髓间充质干细胞的分离培养、基因修饰、鉴定与诱导分化
1 月龄SD 大鼠安乐死后,无菌条件下解剖双侧股骨,剪开股骨近、远端,用10 mL 含10% FBS、1%PS 的α-MEM 反复冲洗髓腔直至变白,过滤至含5 mL PBS 的无菌离心管中,吹打混匀,常温下1500 r/min 离心5 min 后弃上清,将细胞球团吹打混匀后,置于细胞培养瓶中,37℃、5% CO2培养箱中培养,每隔2~3 d 更换培养基。 当细胞生长较满时加入0.25% Trypsin-EDTA 消化离心后传代。
选择生长良好的P2、P3 代细胞进行基因修饰。提前1~2 d 在24 孔板中铺板104个/孔,待细胞铺满孔底面约30% ~40%时加入慢病毒、聚凝胺(polybrene)、培养基的混合溶液约3 mL。 设置转染空载体(GPF)、过表达目的基因(NT-3)、空细胞(BMSC)各三组。 首次应根据细胞形态及生长状况12~36 h 更换培养基,首次后每隔3 d 更换培养基,4~7 d 荧光显微镜下观察。
从细胞培养箱中取出转染良好的BMSC+GFP和BMSC+NT-3 细胞,PBS 冲洗2 次后,消化、离心后弃上清,加入100 μL PBS 吹打混匀,放入2 mL 无菌EP 管中,并分别标记为CD29、CD34、CD44、CD45、CD11b 然后每管分别加入10 μL 对应的荧光标记的抗体,4℃下避光静置30 min,然后加入1.5 mL PBS,吹打混匀,滤纸过滤到流式管中。 并设置一组生长良好的BMSC 细胞作为对照组,重复以上操作,共同上机检测。
选取转染良好的BMSC+GFP 和BMSC+NT-3,PBS 冲洗2 次后,消化、离心后弃上清,重悬吹打混匀后接种于6 孔板中,调整细胞密度为106个/孔。细胞即将长满孔板底面时,成脂诱导细胞加成脂诱导分化液A 2 mL,3 d 后更换成脂诱导分化液B 2 mL,1 d 后再次更换为成脂诱导分化液A 2 mL。4 周后4 mL PBS 冲洗3 遍,4%多聚甲醛固定30 min后4 mL PBS 冲洗3 遍。 2 mL 油红O 溶液染色30 min,置于显微镜下进行观察。 成骨诱导细胞加入成骨诱导分化液2 mL,每隔3 d 更换新诱导分化液。 4周后4 mL PBS 冲洗3 遍,4%多聚甲醛固定30 min后,4 mL PBS 冲洗3 遍。 2 mL 茜红溶液染色30 min,置于显微镜下进行观察。 选取生长良好的BMSC 运用正常培养基培养4 周后,重复以上固定、染色步骤作为对照组,置于显微镜下进行观察。
1.3.2 免疫印迹试验(Western blot)检测基因编辑细胞后相关蛋白的表达
选取生长良好的BMSC、BMSC+GFP、BMSC+NT-3 细胞,倒掉原培养基,PBS 冲洗3 次后再倒入600 μL PBS,用细胞刮刀刮下细胞,放入1.5 mL EP管中,4℃1500 r/min 离心10 min,后弃上清。 分别加入30 μL 裂解液(磷酸酶抑制剂1 片溶于1 mL 水取100 μL、蛋白酶抑制剂1 片溶于10 mL 水取100 μL、细胞RIPA 800 μL、PMSF 10 μL),插在冰上静置30 min。 4℃14000 r/min 离心10 min 后取上清分别放入新的1.5 mL EP 管中。 测蛋白浓度后,加入25%总体积的Buffer、10%总体积的Reducing 和总体积-buffer-Reducing-蛋白体积的水,最后加入蛋白。 制样后放入70℃中30 min。 预制胶每孔上样12 μL,常规加满电泳液,胶后加入1 mL 抗氧化剂。30 min、200 V 跑胶。 150 min、200 mV 冰中转膜。丽春红染色,去离子水清洗三遍,脱脂奶粉3 g+60 mL TBST(Tris-Hcl,NaCl,tween20,TBST)摇匀后封闭1 h。 一抗4℃摇床过夜。 3 mL TBST 清洗6 min,重复三遍,常温摇床孵育2 抗60 min。 吸走膜上的残余液体,并在膜上覆盖液,曝光。
1.3.3 水凝胶的制备
取5 mg 试剂B 加入到1 mL 培养基中,涡旋震荡致完全溶解,放入37℃、5% CO2培养箱中备用。取100 mg 试剂A 放在紫外下照射消毒30 min,用20 μm 滤网过滤5 mg 试剂B 和1 mL 培养基混合液,并加入消毒后的试剂A,涡旋震荡致完全溶解,放入37℃、 5% CO2培养箱中备用。 选取生长良好的BMSC、BMSC+GFP、BMSC+NT-3 细胞,消化离心后弃上清。 用1 mL 培养基、试剂A、试剂B 的混合液,将细胞吹打混匀即可获得细胞-CelGel 混悬液。取适量细胞-CelGel 混悬液滴注到PDMS 模具内。放入紫外线光灯箱光照交联60 s,获得细胞-CelGel凝胶。 将细胞-CelGel 凝胶放入培养基37℃、5%CO2培养。
1.3.4 动物分组及急性不完全性脊髓损伤大鼠模型构建
将SD 大鼠放置于中国医学科学院医学实验动物研究所SPF 级动物房中适应性饲养一周后,将其随机分为6 组,每组8 只。 分别为:假手术对照组(Sham)、脊髓损伤模型组(SCI model)、BMSC+NT-3组、BMSC+hydrogels 组、BMSC+hydrogels+GFP 组、BMSC+hydrogels+NT-3 组。 手术常规2.5%异氟烷吸入麻醉SD 大鼠,背部备皮后俯卧位胶布牢固固定大鼠于手术台上,手术区域1%碘伏消毒三遍,75%酒精消毒一遍。 无菌条件下取后正中切口逐层切开3 cm 左右,钝性分离背部肌肉,咬除T9-T11 棘突及相应椎板,暴露T9 ~T11 节段脊髓,切开硬脊膜,将脊髓自T10 节段向远端切除0.5 cm,清除椎管内残留的神经纤维。 分别将转染后的细胞和搭载细胞的水凝胶植入脊髓缺损处,使其与脊髓损伤断端紧密接触吻合。 明胶海绵充分止血后,5-0 号可吸收缝线依次缝合肌肉和皮下组织,0 号不可吸收线缝合皮肤。 75%医用酒精擦净伤口,肌肉注射抗生素预防感染,皮下注射止痛药。 术后勤换垫料,按摩膀胱促进排尿。
1.3.5 运动行为学检测(BBB)
每组大鼠在术前以及术后1、2、4、6、8 周分别按照Basso Beatlie Bresnahan(BBB)评分标准进行观察。 BBB 评分总分为21 分,0 分表示无明显动作,21 分表示无损伤运动活动。 将测试大鼠置于平坦开阔的50 cm 测试盒中自由活动,由两名实验人员对大鼠后肢运动协调能力进行评分。
1.3.6 组织取材及切片
各组大鼠经模型构建和不同方法治疗8 周后,完成行为学实验。 2%戊巴比妥钠麻醉后经左心室-升主动脉插管。 先快速血管灌注生理盐水200 mL,待血液冲刷干净,肝逐渐变为白色后再灌注4%多聚甲醛溶液约100 mL,待动物抽搐完毕后。 依次取出心脏、肺、肝、肾、脾和脑等脏器,生理盐水冲洗表面后置入福尔马林溶液中,石蜡包埋切片后按苏木素-伊红染色法(hematoxylin-eosin staining, HE)染色。 脊髓置于4%多聚甲醛溶液中4 ℃过夜后固定,固定后将脊髓依次放入20%和30%蔗糖溶液中浸泡,待组织块下沉到瓶底,进行冰冻切片,免疫组化染色。
1.3.7 染色方法
二甲苯脱蜡三次,每次15 min,然后分别在100%、90%、80%、70%酒精中浸泡5 min,PBS 漂洗3 遍,每遍5 min。 苏木素染色后流水冲洗10 min。5%乙酸分化后流水冲洗10 min,伊红染色后流水冲洗10 min。 70%、80%、90%、100%酒精和二甲苯各1 min 脱水透明后封片。
免疫组织化学染色时需提前1 d 将切片放入37℃烤箱中过夜。 二甲苯脱蜡15 min,重复三次。100%酒精浸泡后置于70%酒精中2 min,重复4 次。PBS 漂洗3 遍,每遍5 min。 置于放满0.01 mmol/L柠檬酸缓冲液热修复盒中,微波炉高、中、低火各加热5 min,恢复至室温后PBS 漂洗3 遍,每遍5 min。每张片子加过氧化物酶阻断剂阻断15 min 后PBS漂洗3 遍,每遍5 min。 羊血清覆盖标本封闭30 min后加入一抗(1 ∶200),4℃过夜。 37℃孵育30 min 后PBS 漂洗3 遍,每遍5 min。 加入二抗相应的反应增强剂20 min 后PBS 漂洗3 遍,每遍3 min。 加入酶标二抗孵育30 min 后PBS 漂洗3 遍,每遍2 min。DAB 染色后放入流水中冲洗10 min,苏木素染色后流水冲洗,盐酸酒精浸泡3 次后流水冲洗10 min。脱水透明后封片。
1.4 统计学方法
运用Adobe Photoshop CC 2018 软件对免疫组织化学切片进行计数统计,利用GraphPad Prism 7.0和SPSS 16.0 统计分析软件对实验结果进行统计分析。 使用单因素方差分析(one-way ANOVA)确定组间差异,以P<0.05 表示差异有统计学意义。
2 结果
2.1 骨髓间充质干细胞培养与转染的形态观察
首先,对SD 大鼠骨髓间充质干细胞进行培养,骨髓间充质干细胞2 d 左右贴壁生长,P2~5 代生长能力强。 运用骨髓贴壁法分离、培养、扩充的骨髓间充质干细胞为长梭形,呈团簇状、放射状生长,折光性强,形态均匀。 传代后细胞形态单一,无明显变化、纯度较高,状态良好,增殖能力强。 然后,对细胞进行慢病毒转染,并设置两组,分别为空载体组(GFP)和过表达目的基因组(NT-3)并进行观察。结果显示,90% 以上的细胞具有绿色荧光表达,提示转染效率较高(如图1)。
2.2 基因修饰的骨髓间充质干细胞的蛋白表达验证
为了验证NT-3 蛋白在骨髓间充质干细胞中过表达,以及证明NT-3 来源为外源性,本研究进行了Western blot 分析。 结果显示,NT-3 蛋白表达结果显示慢病毒转染目的基因组显著高于转染空载体组与空细胞组。 Flag-tag 作为一种标记标签,能标记外源性的目的基因。 Flag-tag 表达表明NT-3 组蛋白高表达为外源性基因修饰的结果(如图2)。
2.3 骨髓间充质干细胞的流式细胞学验证
为了验证基因修饰后的骨髓间充质干细胞,本研究运用流式细胞学检测。 经流式细胞学仪检测,结果显示CD29 和CD90 强阳性,CD11b、CD31 和CD45 呈阴性,符合骨髓间充质干细胞的特征(如图3)。
2.4 骨髓间充质干细胞细胞生长曲线活力检测
为了选取生长能力较强的细胞进行动物模型的治疗,本研究首先选取生长状态良好的BMSC、GFP、NT-3 细胞105个,分别种植在24 孔板中。 在不同时间段3 d、6 d、9 d、12 d、15 d,对细胞进行常规消化、离心后进行细胞计数,并制作了细胞生长曲线。 结果显示,未经转染的骨髓间充质干细胞每次细胞计数其数量均多于转染GFP 以及NT-3 的细胞,转染GFP 组和NT-3 组细胞生长形态以及数量没有统计学差异。 骨髓间充质干细胞在3 ~9 d 时的增殖速度明显高于9 ~12 d,而使用慢病毒转染BMSC 后,在4 d 左右开始表达绿色荧光,7 d 时表达更多。 最终,本研究选取转染后7 d 的细胞对实验动物模型进行治疗(如图4)。
2.5 骨髓间充质干细胞成脂、成骨诱导分化后细胞生长情况和形态
为了观察基因修饰后骨髓间充质干细胞的分化能力本研究对其进行了成脂、成骨诱导分化。 4周后,成脂诱导分化细胞油红O 染色后明显可见脂滴形成。 成骨诱导分化细胞茜素红染色后,可见云雾状钙化结节。 对照组无明显改变(如图5)。
2.6 水凝胶支架的形态观察
随后制备水凝胶,为明确水凝胶支架的内部形态结构,进行透射电镜观察。 结果显示,典型水凝胶的三维微米尺度多孔无规则蜂窝状结构,进一步可观察到纳米结构。 多孔无规则蜂窝状结构,具有较大的表面积和体积,一方面,可为BMSC 和NT-3提供营养交换提供渠道和缓释条件;另一方面,为神经组织的再生提供较大的生长空间(如图6)。
2.7 急性不完全性脊髓损伤大鼠模型的建立与治疗
本研究在动物实验前,准备好细胞并进行验证,后将细胞置入水凝胶中,现在计划对它们进行动物实验验证,本研究整体时间进展(如图7)。 为了验证经基因修饰的骨髓间充质干细胞联合水凝胶对于脊髓损伤神经修复治疗的安全性和有效性,本研究运用SD 大鼠进行造模和治疗。 切除大鼠脊柱椎板及附件,完全暴露后行脊髓半切(如图8)。切除后对不同组动物分别植入BMSC+NT-3、BMSC+hydrogels、BMSC+hydrogels+GFP、BMSC+hydrogels+NT-3 进行相应治疗。 1 周内实验大鼠活动、饮食、饮水较少,2~3 周后逐渐恢复(如图9)。
2.8 SD 大鼠运动行为学BBB 评分
为了验证经基因修饰的骨髓间充质干细胞联合水凝胶对大鼠脊髓损伤模型治疗后,后肢运动和协调能力恢复的有效性,本研究在手术前和术后1、2、4、6、8 周对各组大鼠进行运动行为学BBB 评分测定并制图。 移植1 周后,Sham 组大鼠运动评分恢复正常,而各治疗组大鼠BBB 评分均有不同程度增加,后肢运动能力提升,其中BMSC+hydrogels+NT-3组大鼠BBB 评分增加最为明显,BMSC+hydrogels 组其次。 充分说明三者联合治疗的有效性。 所有结果组间比较差异均有统计学意义(P <0.005)(如图10)。
2.9 手术造模治疗8 周后大鼠组织病理学检测
手术造模治疗8 周后,对各组大鼠进行脊髓的病理学检测,分析损伤区域脊髓神经元、神经纤维和星形胶质细胞数目。 SCI model 组和Sham 相比,神经元、神经纤维数量明显减少,星型胶质细胞增多(P<0.05),证明了大鼠脊髓损伤造模成功。 各治疗组与SCI mode 组比较,神经元数量增多,星形胶质细胞数量减少(P<0.05)(如图11)证明了各组治疗均有效。 其中,BMSC+hydrogels+NT-3 组神经元、神经纤维数目增加,星形胶质细胞数目较其他治疗组较少,证明其治疗效果最佳。 BMSC+hydrogels+GFP 组与BMSC+hydrogels 组相比,神经元、星形胶质细胞数目具有统计学差异(P<0.05),神经纤维数目无统计学差异。 BMSC+hydrogels 组和BMSC+NT-3 组在神经元、神经纤维和星形胶质细胞数目均无统计学差异(如图12、图13、图14)。
为了验证BMSC+hydrogels+NT-3 在脊髓损伤治疗中的安全性,本研究对SD 大鼠进行急性不完全性脊髓损伤造模治疗8 周后,对大鼠重要脏器进行组织病理学切片,所有大鼠均未发现肿瘤形成及免疫排斥反应。 各组大鼠心脏、肺、肝、肾功能形态正常,脑部形态正常,提示各组治疗方案安全性良好(如图15)。

图1 细胞形态与慢病毒转染Note.SD rat bone marrow mesenchymal stem cells had the same morphology, and green fluorescence expression was observed after transfection.A, Normal growth of bone marrow mesenchymal stem cells.B, Bone marrow mesenchymal stem cells transfected with GFP.C, Bone marrow mesenchymal stem cells transfected with NT-3.Figure 1 Cell morphology and lentiviral transduction
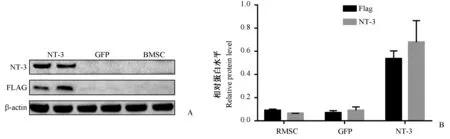
图2 SD 大鼠骨髓间充质干细胞转染后蛋白表达Note.Western blot verified protein expression after lentiviral transduction of the target gene or the empty vector in cultured BMSCs.A, B.Protein expression of the target protein (NT-3), green fluorescent protein (GFP), and internal reference protein (β-actin) after transduction of SD rat bone marrow mesenchymal stem cells.Figure 2 Protein expression of SD rat bone marrow mesenchymal stem cells after transduction
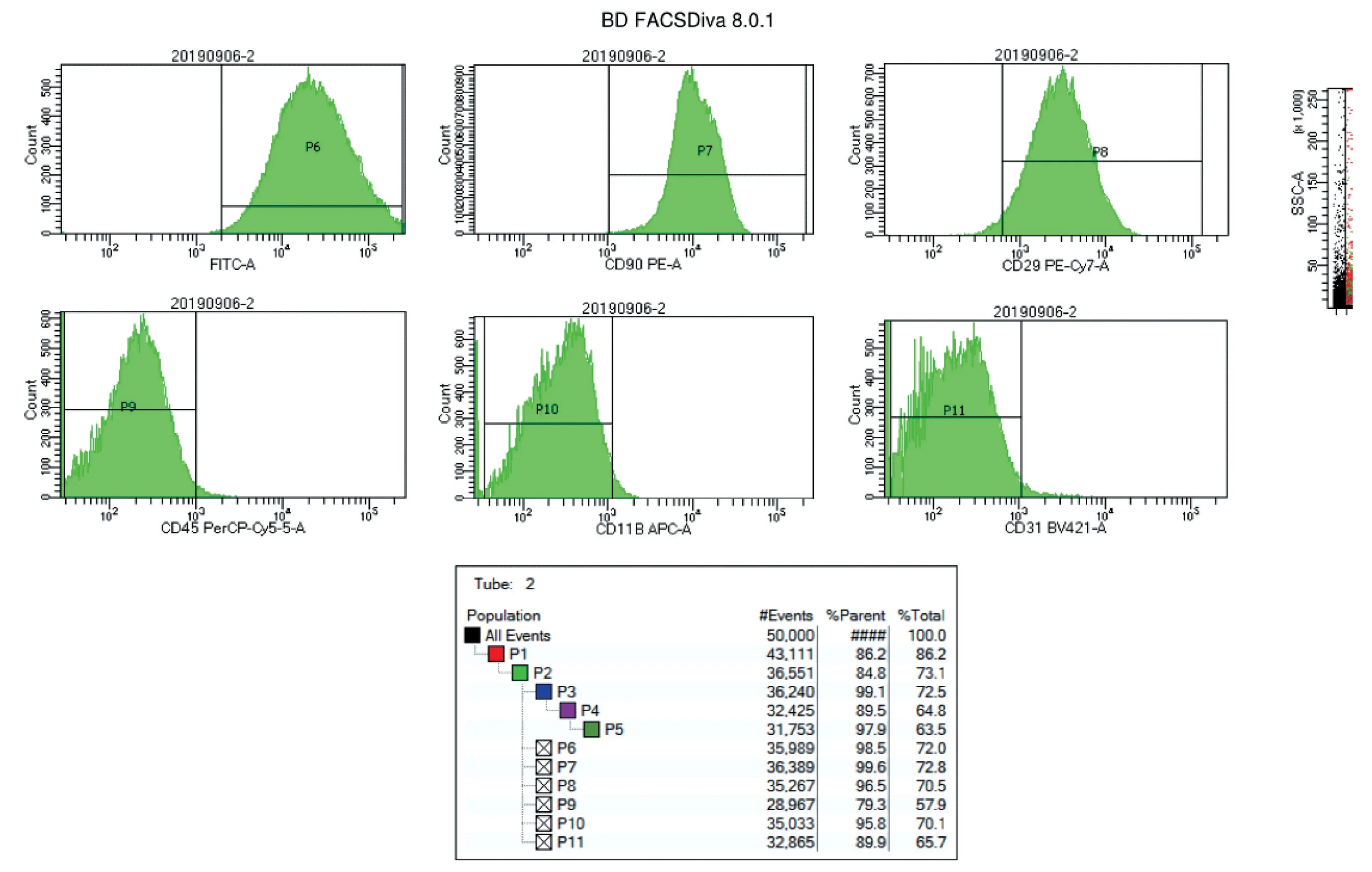
图3 SD 大鼠骨髓间充质干细胞转染慢病毒后的流式细胞学验证Figure 3 Flow cytometric verification of SD rat bone marrow mesenchymal stem cells transduced via a lentivirus
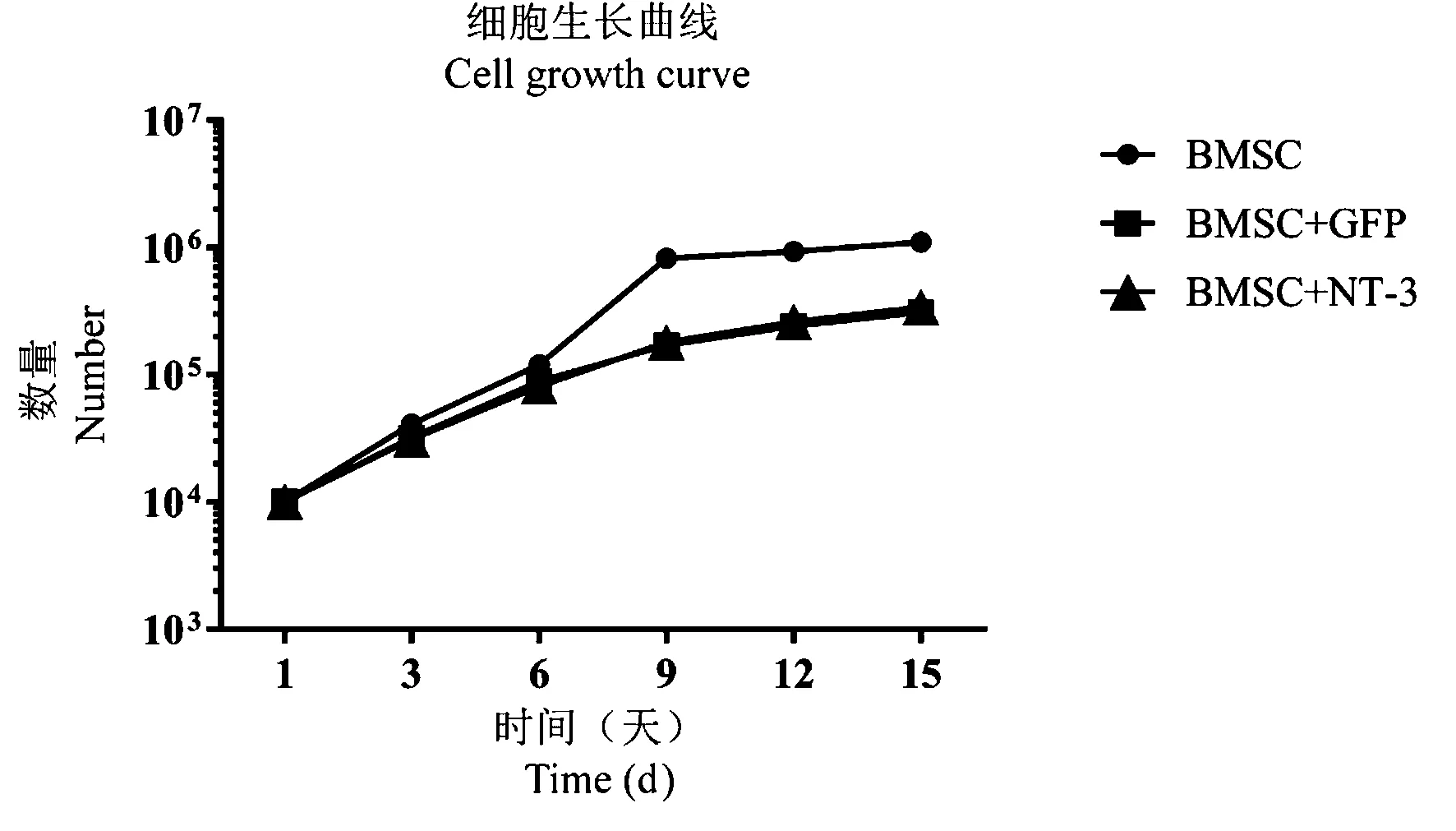
图4 SD 大鼠骨髓间充质干细胞与转染GFP 和NT-3细胞生长曲线Figure 4 Growth curve of SD rat bone marrow mesenchymal stem cells and transduced GFP and NT-3-expressing cells
3 讨论
本研究通过构建大鼠脊髓损伤模型并进行相应治疗,运用行为学、病理学检测,评价了BMSC、NT-3、hydrogels 在脊髓损伤神经修复与再生中的治疗作用。
首先对SD 大鼠进行急性不完全性脊髓损伤造模,脊髓在损伤当时由直接外力导致神经和血管结构的原发性损伤[15-17]。 随后几小时到几天[18],大量激活的炎症产生毒性分子,小胶质细胞、星形胶质细胞等形成瘢痕,诱导神经元死亡。 同时还分泌硫酸软骨素蛋白聚糖等抑制损伤脊髓的再生,继发性损伤进一步产生瀑布式细胞凋亡、胶质瘢痕形成和轴索变性[18-20]。
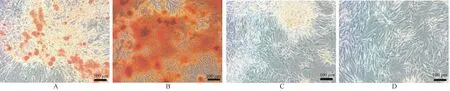
图5 SD 大鼠骨髓间充质干细胞诱导分化Note.Growth of bone marrow mesenchymal stem cells after adipogenic and osteogenic differentiation and control morphology.A, Adipogenic differentiation of rat bone marrow mesenchymal stem cells.B, Osteogenic differentiation of rat bone marrow mesenchymal stem cells.C, Control group of rat bone marrow mesenchymal stem cells induced to undergo adipogenic differentiation.D,Control group of rat bone marrow mesenchymal stem cells induced to undergo osteogenic differentiation.Figure 5 Differentiation of SD rat bone marrow mesenchymal stem cells

图8 SD 大鼠手术切除脊髓造模与相应治疗Note.A, Resection of the lamina.B, Exposed spinal cord.C, Removed part of the spinal cord.D, BMSC + hydrogel + NT-3 rats were implanted with BMSC + hydrogel + NT-3.E, BMSC + NT-3 rats were implanted with BMSC + NT-3.F, Removed part of the spinal cord.Figure 8 Surgical removal of the spinal cord and corresponding treatments

图9 模型大鼠术后状态Note.SD rats in the spinal cord injury model group were paralyzed on the affected hindlimb after the operation, and both forelimbs and healthy hindlimbs dragged the affected hindlimb when walking.Figure 9 Postoperative status of model rat

图10 各组SD 大鼠造模、治疗前后运动行为学BBB 评分Figure 10 BBB scores of SD rats in each group before and after modeling and treatment

图11 各组SD 大鼠脊髓损伤区域NeuN 染色Note.NeuN staining of the rat spinal cord injury area showed the number of neurons in the tissue.A, Sham group.B, SCI model group.C,BMSC + NT-3 group.D, BMSC + hydrogel group.E, BMSC + hydrogel + GFP group.F, BMSC + hydrogel + NT-3 group.Figure 11 NeuN staining of the spinal cord injury area of SD rats in each group

图12 各组SD 大鼠脊髓损伤区域NF-H 染色Note.NF-H staining of the injured area of the spinal cord in rats showed the number of nerve fibers in the tissue.A,Sham group.B, SCI model group.C, BMSC+NT-3 group.D, BMSC + hydrogel group.E, BMSC + hydrogel + GFP group.F, BMSC + hydrogel + NT-3 group.Figure 12 NF-H staining of the spinal cord injury area of SD rats in each group
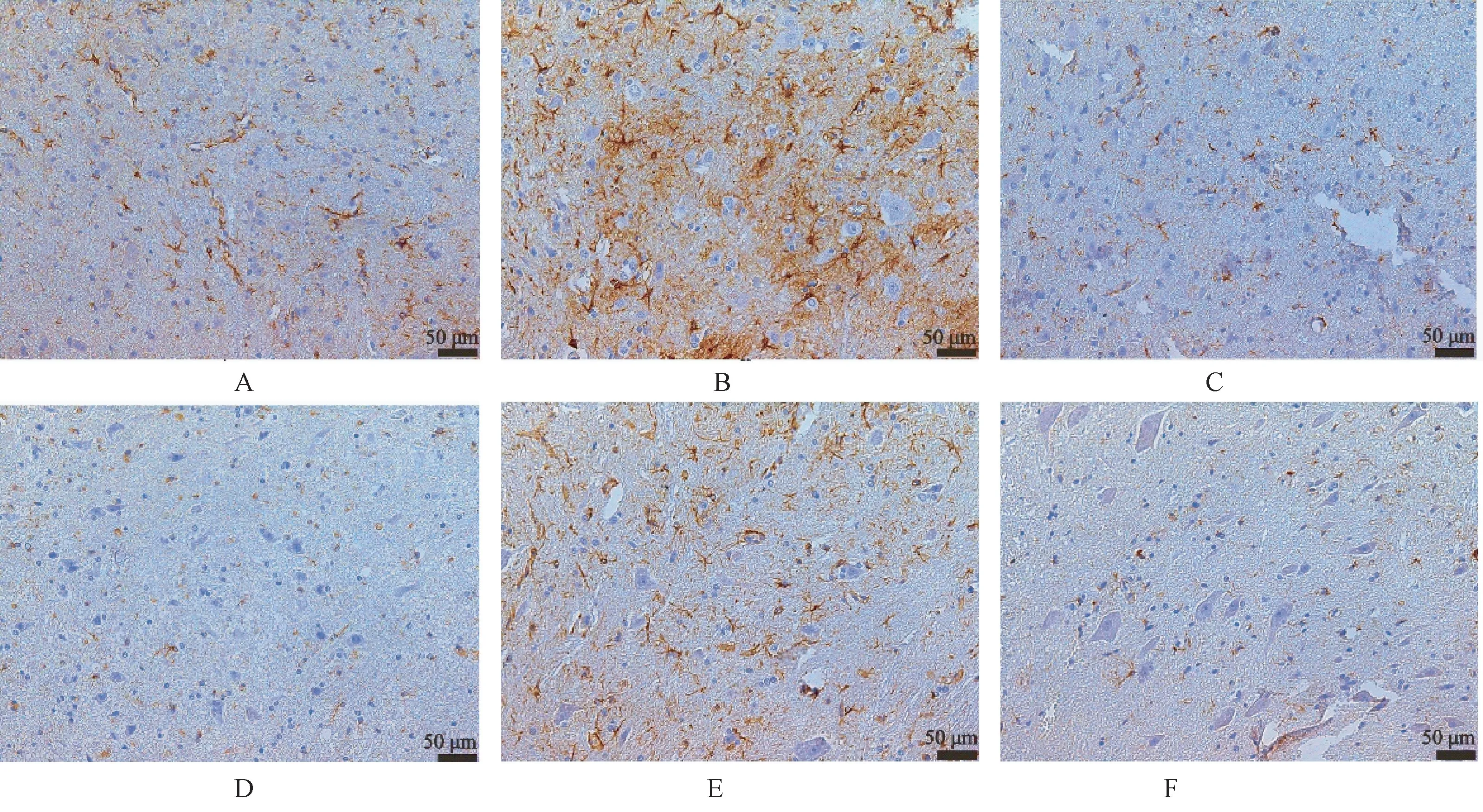
图13 各组SD 大鼠脊髓损伤区域GFAP 染色Note.GFAP staining of the rat spinal cord injury area showed the number of astrocytes in the tissue.A,Sham group.B,SCI model group.C, BMSC + NT-3 group.D,BMSC + hydrogel group.E,BMSC + hydrogel + GFP group.F,BMSC+ hydrogel + NT-3 group.Figure 13 GFAP staining of the spinal cord injury area of SD rats in each group

图14 各组SD 大鼠脊髓损伤区域神经元、神经纤维和星形胶质细胞数目统计Note.The numbers of neurons, nerve fibers, and astrocytes were counted and analyzed.Sham group compared with the SCI model group,****P<0.0001.BMSC + NT-3 group compared with the BMSC + hydrogel + NT-3 group, BMSC + hydrogel + NT-3 group compared with the BMSC + hydrogel + GFP group, #P<0.05, ###P<0.005, ####P<0.0001.A, NeuN.B, NF-H.C, GFAP.Figure 14 Statistics of the number of neurons, nerve fibers and astrocytes in the spinal cord injury area of SD rats in each group
众多证据表明,BMSC 在脊髓损伤的修复过程中通过分泌细胞因子、增加脊髓新生血管、促进轴突再生重建受损脊髓,并且抑制氧自由基产生,可以控制炎症、抑制凋亡、减少瘢痕形成[20-21]。 但只有一小部分骨髓间充质干细胞能穿越血脊髓屏障[22],且存活率较低[22-24]。

图15 各组大鼠主要脏器病理变化Note.The main organs of rat were fixed and sected for HE staining to observe their fine structure and morphology.A, Brain.B, Kidney.C, Spleen.D, Heart.E, Lung.F, Liver.Figure 15 Pathological changes of the major organs of rats in each group
免疫组织化学显示,BMSC+hydrogels+NT-3 组与BMSC+NT-3 组相比神经元、神经纤维数目有显著增多,星形胶质细胞减少,胶质瘢痕减少。 众多证据表明水凝胶作为可降解组织工程学支架,为细胞和因子提供生长三维空间和缓释载体,持续发挥促进神经再生的作用。 并桥接脊髓损伤区域,为神经的长距离生长提供条件。 水凝胶具有良好的生物相容性和可降解性,并且可以根据脊髓损伤的区域制作成适当的结构[25]。 由于脊髓封闭性的结构和损伤后坏死组织的溶解和清除导致空洞形成,创造一种可注射水凝胶并搭载细胞和因子在损伤后持续治疗中具有可观的前景。 BMSC+hydrogels+NT-3 组与BMSC+hydrogels+GFP 组相比神经元、神经纤维数目同样增多,而星形胶质细胞形成的胶质瘢痕增生减少。 文献证据表明,NT-3 通过抑制c-fos 和c-jun 表达减少脊髓神经细胞凋亡;降低TNF-α、IL-1β,减少炎症;并增强Trk C 在皮质脊髓束表达,维持运动神经元和神经胶质细胞的存活,减少胶质瘢痕形成,促进神经-肌突触的成熟,促进内源性神经干细胞激活,从而促进精细运动功能的恢复[26]。 但在轴突再生过程然中,NT-3 吸收率低,亦不能持续作用。 而BMSC+hydrogels+GFP 组相比BMSC+hydrogels 组神经元数目有一定的减少、星形胶质细胞数目增加,神经纤维数目无统计学差异。 且BMSC+hydrogels+GFP 组行为学评分略差于BMSC+hydrogels 组,但细胞生长曲线说明基因修饰前后BMSC 的活性和增殖能力并无统计学差异。 由此可见细胞经过慢病毒转染GFP 后,病毒载体对于BMSC 的神经修复作用可能有一定的影响,但NT-3对神经修复的作用仍然在联合治疗组中显著体现。这提示我们可进一步改善新的病毒载体,例如腺病毒、腺相关病毒和逆转录病毒等,并尝试探索更佳的基因修饰方式对细胞和因子进行结合。
运动行为学检测中,各组大鼠治疗后与SCI model 组相比,运动行为学评分有不同程度的升高,BMSC+hydrogels+NT-3 组最为显著。 可能是因为NT-3 促进了大鼠后肢精细运动能力的恢复,BMSC 增加损伤区域血供并进一步促进NT-3的分泌与表达,hydrogels 填补脊髓缺损区域并持续释放BMSC 和NT-3[27],共同促进大鼠后肢运动协调能力的恢复。 而这一点也在免疫组化染色神经元、神经纤维数和星形胶质细胞的数目中得到了验证。
综上所述,本研究在建立脊髓损伤大鼠模型基础上,通过植入骨髓间充质干细胞、神经营养因子-3和水凝胶支架进行治疗,提升了大鼠后肢运动水平,同时提升了损伤区域神经元、神经纤维数目,减少胶质瘢痕形成,验证了其在神经再生中的作用。这种细胞+因子+支架的综合治疗方式可作为脊髓损伤的一种潜在治疗方案。 希望可以通过进一步研究,加快临床转化,从而提升脊髓损伤患者的生活质量。

