脂肪干细胞及其外泌体减轻肝细胞凋亡改善大鼠肝纤维化
游茂春,刘广益,程 俊,李雅娟,余 鸿,王巧稚*
(1.西南医科大学 基础医学院组胚教研室,四川 泸州 646000; 2.西南医科大学 心血管研究所,四川 泸州 646000)
肝纤维化是各种慢性肝病发展到肝硬化或肝癌的必经阶段,目前临床针对晚期肝硬化患者肝移植供肝来源缺乏,手术风险大,术后排斥反应大等问题一直存在,改善肝纤维化成为亟待攻克的热点[1]。 外泌体(Exosomes)是细胞旁分泌的主要形式之一[2],是目前无细胞疗法的一大关注点,它是一种由细胞分泌的微型细胞外囊泡,其内含细胞内分泌的大量有效成分,如蛋白质、RNA、microRNA等[3]。 近年来已有研究者利用干细胞分泌的外泌体对实验动物肝损伤进行研究,发现其可以通过抑制星状细胞激活和上皮-间质转化(EMT)等方面对肝损伤修复、炎症治愈等方面起到一定的效果[4]。脂肪干细胞(ADSCs)取材方便,细胞产量大,由它分泌的外泌体已被研究者用于实验动物心脏、大脑、肺、肾、皮肤等多方面的研究[5-6],对于肝纤维化的研究目前研究者主要采用基因编辑过的外泌体进行治疗[7-8]。 本实验旨在探究脂肪干细胞直接衍生的外泌体是否具有肝纤维化保护作用并探究其相关机制,为临床治疗肝纤维化提供思路。
1 材料和方法
1.1 实验动物
5 只SPF 级10 日龄体重约20~25 g 雄性SD 乳大鼠购买自西南医科大学实验动物中心[SCXK(川)2018-17]。 另50 只8 周龄、健康雄性SD 大鼠,体重200 ~220 g,无特定病原体(SPF)级,购自成都达硕实验动物有限公司[SCXK(川)2015-030]。 大鼠取材和相关实验于西南医科大学实验动物中心实验室内进行[SYXK(川)2018-065]。 动物实验过程中,严格按照3R 原则给予人道主义关怀,通过西南医科大学动物实验伦理审查(201808-55)。
1.2 主要试剂与仪器
I 型胶原酶(C8140)、链青霉素双抗(P1400)、RIPA 裂解液(R0010)均购自索莱宝公司;胰蛋白酶(C0201)、蛋白BCA 浓度测定试剂盒(P0010S)均购自碧云天生物公司;胎牛血清购自以色列BI 公司(04-001-1 A);无外泌体血清(180625-001)购自美 国 SBI 公 司; DMEM/F12 细 胞 培 养 基(SH30023.01B) 购 自 海 克 龙 公 司; 四 氯 化 碳(C805329-4 L)、橄榄油(O108685)均购自阿拉丁试剂;脂肪干细胞成脂诱导分化试剂盒(RASMD-90031)和成骨诱导分化试剂盒(RASMD-90021)购自赛业生物;α-sma 抗体(ab124964) 购自英国Abcam 公司;actin 抗体(66009-1-Ig)、TGF-β1 抗体(21898-1-AP)、山羊抗兔(SA00001-2)和山羊抗小鼠(SA00001-1)均购自美国Proteintech;Bax 抗体(2772S)、Caspase3(9662S)抗体购自美国CST 公司;BcL-2 抗体(abs115024)购自爱必信生物。 二氧化碳细胞培养箱日本松下电器;倒置相差显微镜日本OLYMPUS;超速离心机美国贝克曼公司;石蜡切片机德国徕卡公司;电泳仪美国BIO-RAD 公司等。
1.3 实验方法
1.3.1 脂肪干细胞原代培养及鉴定
取5 只10 日龄SD 乳大鼠放入-20℃冰箱低温麻醉[9]10 min 后脱颈处死,放入75%乙醇浸泡5 ~10 min,再放入超净工作台。 取腹股沟区脂肪组织,PBS 漂洗3 次,去除多余的筋膜和血管,剪成肉糜状移入无菌离心管。 加入3 倍体积的0.1% I 型胶原酶37℃温浴,每隔5 min 震荡一次,消化约30 ~60 min,1200 r/min 离心4 min,弃上清,用配好的完全培养基重悬沉淀,移入无菌培养瓶放入37℃,5%二氧化碳培养箱中培养并进行传代,取第3 代细胞按照试剂盒说明书进行成脂和成骨分化鉴定。
1.3.2 脂肪干细胞外泌体提取和鉴定
外泌体提取方法参照文献[10]进行:将第3 ~6代脂肪干细胞培养至50%~60%,更换无外泌体血清配制的完全培养基培养24 ~48 h,直到细胞铺满瓶底收集培养上清液。 将培养上清液经1200 r/min离心10 min,留取上清液, 继续以2000 r/min 离心30 min,留取上清液,再以20000 r/min 离心70 min,弃上清,加入PBS 重悬后,继续以20000 r/min 离心70 min,此时收集的沉淀即包含外泌体。 BCA 蛋白浓度测试法测定外泌体蛋白浓度,另将收集的一部分外泌体样本干冰运送至上海欧易生物公司进行透射电镜检测、粒径分析和Western blot 检测标记蛋白CD81 等进行鉴定。
1.3.3 肝纤维化模型的建立及分组
50 只SD 大鼠适应性饲养一周后,除空白组(10只)注射橄榄油外,其余40 只用30%四氯化碳+橄榄油混合溶液,2 mL/kg 腹腔注射,2 次/周,建模共10 周。 随机处死10 只大鼠,验证建模已成功。 剩余30 只大鼠随机分为: ADSCs 组、Exosomes 组和模型组(每组10 只),分别经尾静脉注射脂肪干细胞每毫升约1×106个、脂肪干细胞衍生的外泌体约325 μg/mL,均用无菌生理盐水稀释至1 mL,模型组和空白组注射1 mL 生理盐水,所有大鼠第12 周末采用戊巴比妥钠50 mg/kg 腹腔注射麻醉后,生理盐水灌注取材。 一半肝组织修剪成小块后4%多聚甲醛浸泡48 h,再移入70%室温乙醇长期保存,另一半新鲜肝组织修剪成小块后立即装进RNase-free 的冻存管,放入液氮罐长期保存。
1.3.4 病理组织切片染色
HE 染色:将大鼠麻醉后进行生理盐水心脏灌注,取下一半肝组织4%多聚甲醛固定48 h,梯度乙醇脱水、透明、浸蜡、包埋,制成5 μm 厚度切片。 分别行常规HE 染色:梯度酒精脱蜡复水,放入苏木精染色中浸泡5 min,自来水冲洗5 min,1%盐酸乙醇分化褪色数秒,再放入1%氨水返蓝数秒。 80%、90%乙醇脱水2 min,再放入90%伊红乙醇染色5 min,95%、100%、100%乙醇继续脱水,晾干后放入二甲苯Ⅰ、二甲苯Ⅱ透明10 ~20 min,封片,镜检。天狼星红染色:切片复水后,滴加天狼星红染液染色1 h,自来水冲洗15 min,滴加苏木精复染细胞核,其余步骤同前。
1.3.5 肝纤维化Ishak 评分
根据《Ishak 肝纤维化分期半定量评估系统》[11]对肝组织HE 染色和天狼星红染色切片进行评分。
1.3.6 血清肝功AST、ALT 检测
将采集的血液室温静置4 h 后,4000 r/min 离心5 min 吸取上层清澈血清,自动生化分析仪检测。
1.3.7 Western blot 检 测Bax、BcL-2、Caspase3、TGF-β1 蛋白表达情况
取大鼠新鲜肝组织约20 mg,液氮研磨,加入200 μL 的裂解液(含蛋白酶、磷酸酶抑制剂)锤打混匀,冰上静置20 min,12000 r/min 4℃离心20 min,小心吸取上清液,吸取10 μL 作为BCA 蛋白浓度测定,其余蛋白加入1/4 体积的5×上样缓冲液煮沸5 min,并进行SDS-PAGE 凝胶电泳。 配制10%和15%的分离胶,上样量约20 μg,电泳分离结束后用PVDF 膜湿法转膜,5%脱脂奶粉封闭1 h,孵育一抗Bax(1 ∶1000)、BcL-2(1 ∶1000)、Caspase3(1 ∶1000)、TGF-β1(1 ∶600)4℃冰箱过夜,以β-actin(1 ∶5000)作为内参。 次日回收一抗,TBST 洗膜3×5 min 后室温孵育二抗(1 ∶3000)1 h,TBST 洗膜3×5 min,将膜放入ECL 显影液中浸泡2 min 扫描图像并用Image J 图像分析软件做半定量分析,测定各组肝组织中蛋白质相对表达水平。
1.3.8 免疫组化检测α-sma 的表达
5 μm 厚度石蜡切片,梯度酒精脱蜡复水,PBS漂洗3×5 min,3%双氧水室温静置10 min,PBS 漂洗3×5 min;将切片放入枸橼酸钠缓冲液95℃加热20 min 进行抗原修复,冷却至室温后漂洗3×5 min;滴加10%山羊血清封闭1 h,再滴加一抗α-sma(1 ∶200),4℃湿盒过夜。 次日吸弃一抗PBS 漂洗3×5 min,滴加HRP 标记的二抗,DAB 显色,自来水冲洗10 min,苏木精复染,脱水、透明、封片、镜检。
1.4 统计学方法
数据用SPSS 17.0 统计软件包进行分析,经正态性检验和方差齐性检验,再进行独立样本均数的t检验和单因素方差分析,检验水准α = 0.05。Western blot 蛋白表达情况和α-sma 平均阳性表达面积(APSAP)利用Image J 图像分析软件进行计算。 统计图采用GraphPad Prism 8 软件进行绘制。
2 结果
2.1 脂肪干细胞及脂肪干细胞衍生的外泌体
SD 大鼠原代脂肪干细胞呈长梭形,典型成纤维样细胞,漩涡状或鱼群状生长,见图1A。 细胞培养上清液经超速离心法提取的外泌体粒径约为160 nm,电镜下呈杯托状,见图1B,表面标记物CD81 阳性,与国外许多文献描述一致[12]。
2.2 各组大鼠肝组织病理变化和肝纤维化评分
开腹后可见模型组大鼠腹腔粘连严重,肝明显肿大, 质硬, 肝叶之间粘连 严重; ADSCs 组和Exosomes 组肉眼观区别不大,腹腔粘连程度减轻,肝较正常组稍大,肝叶间仍有粘连,质地较模型组软。 HE 染色,见图2,可见空白组肝细胞排列整齐,肝细胞胞质红染,核大而圆,核仁明显,呈向心性围绕中央静脉,门管区小叶间动脉、小叶间静脉和小叶间胆管形态正常。 模型组肝细胞排列紊乱,出现广泛气球样变,胞质稀疏溶解呈空白,细胞核固缩,肝血窦库普弗细胞增多,门管区结缔组织增多且延伸至小叶间。 天狼星红染色,见图2,空白组仅门管区少量结缔组织着色,模型组可见门管区结缔组织明显增生,染色明显,肝小叶被纤维结缔组织分割,形成大小不等的假小叶。 经对应治疗后,ADSCs 组仅有少量死亡肝细胞成团分布,小叶间纤维结缔组织减少,Exosomes 组基本未发现死亡的肝细胞。 大鼠肝纤维化Ishak 评分,见表1,模型组大鼠肝组织广泛纤维增生,门管区和门管区、门管区和中心静脉基本均伴有桥接,甚至2 例出现明显的假小叶,Ishak 评分均大于3 分以上。 ADSCs 组和Exosomes组大多数门管区有纤维增生,小叶间有纤维隔膜,其中Exosomes 组很少见纤维隔膜,有少量短的纤维隔膜,Ishak 评分均在3 分以内。

图1 SD 大鼠原代脂肪干细胞形态及其衍生的外泌体形态Note.A,Day 7 of culture of primary adipose stem cells from SD rats.B, Transmission electron microscope (TEM) of adipose stem cellderived exosomes (arrows).Figure 1 Morphology of primary adipose stem cells from SD rats and their derived exosomes

图2 各组大鼠肝组织形态学改变Note.Macroscopic and histopathological changes in rat liver tissue after 2 weeks of treatment.Black arrows indicate areas of hepatocyte death.in the Model group these areas are distributed in large patches, and in the ADSC group they are distributed in patches or spots.blue arrows indicate the central vein.Figure 2 Histopathological changes in the liver in each group
2.3 各组大鼠血清转氨酶活性的变化
如图3 所示,治疗后第二周末采血检测血清转氨酶水平发现,空白组谷草转氨酶ALT 和谷丙转氨酶AST 均在正常范围内,模型组ALT 和AST 水平与空白组相比有显著升高(P <0.001),ADSCs 组与Exosomes 组与模型组均显著降低(均P<0.05),其中AST 水平在Exosomes 组(P<0.05)降低更明显,ALT 水平两组差异无统计学意义(P>0.05)。
2.4 免疫组化检测α-sma 表达变化
α-sma 是肝星状细胞活化的标志性蛋白,也是纤维化的标志之一,免疫组织化学检测发现,见图4A,空白组α-sma 仅少量表达于肝门管区,模型组除了门管区表达显著增强外假小叶周边区域也强表达,ADSC 组和Exosomes 组表达明显较模型组减弱。 利用Image J 图像分析软件计算各组α-sma 平均阳性表达面积(APSAP)发现,模型组面积较空白组显著增加,ADSCs 组(P<0.01)和Exosomes 组(P<0.05)表达面积较模型组明显变小,两者之间差异无统计学意义(P>0.05)(见图4B)。
2.5 各组大鼠蛋白表达变化
Western blot 实验发现,见图5,TGF-β1 既可以作为纤维化的标志之一,也可以视作肝细胞死亡的标记蛋白,模型组TGF-β1 表达明显高于空白组、ADSCs 组和Exosomes 组,均(P<0.001),与模型鉴定组没有明显差异(P>0.05),促凋亡蛋白Bax(P<0.001)和凋亡执行蛋白Caspase3 较空白组明显增高(P <0.001),与模型鉴定组无明显差异(P >0.05),抑凋亡因子BcL-2 表达较空白组明显降低(P<0.001),较模型鉴定组明显上调(P<0.05)。 与模型组相比,ADSCs 组和Exosomes 组TGF-β1、Bax和Caspase3 表达均有明显下调,抑凋亡因子BcL-2表达ADSCs 组和Exosomes 组较模型组均有明显升高(均P <0.001),以上指标两组间差异无统计学意义。

表1 各组大鼠肝纤维化Ishak 评分(n=10)Table 1 Ishak score of rats liver fibrosis in each group

图3 血清AST 和ALT 水平比较Note.The automatic biochemical analyzer measures the serum AST and ALT levels in each group.The normal group indicates the olive oil injection group, the model group indicates the saline injection group after the model is established.Compared with the Control group, ***P<0.001.Compared with the Exosomes group and ADSCs group,***P<0.001.The serum level of AST in Model group compared with the Control group, ***P<0.001.Compared with the Exosomes group, *** P<0.001.Compared with the ADSCs group, *P<0.05.The serum level of ALT in Exosome group and ADSCs group were no significance,P>0.05 (n.s).The serum level of AST in Exosomes group compared with ADSCs group, *P<0.05.Figure 3 Comparison of AST and ALT in serum
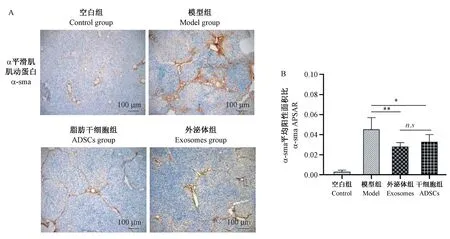
图4 免疫组化检测α-sma 的表达Note.A, immunohistochemical analysis of α-sma expression in liver tissues of each group, and the brown-yellow region in the figure was the region with positive expression of α-sma (Light microscope).B,α-sma positive expression area percentage.Compared with the Exosomes group, **P <0.01.Compared with the ADSCs group, *P<0.05, between the Exosomes group and the ADSCs group, P>0.05 (n.s).Figure 4 Expression of α-sma detected by immunohistochemical staining

图5 各组大鼠凋亡相关蛋白表达水平检测Note.Western blot was used to detect the expression of related proteins.Model identification indicates that the material was taken during model identification.The expression of TGF-β1/Bax/BcL-2 in Model group compared with the Control group, ***P <0.001.Compared with the Exsomes group and ADSCs group, ***P<0.001.The expression of Caspase3 compared with the Control group, ***P<0.001.Compared with the Exsomes group, **P<0.01.Compared with the ADSCs group,*P<0.05.Figure 5 Expression levels of apoptosis-related proteins in rats were measured
3 讨论
肝纤维化是指当肝受到不同类型理化因素的影响,引起肝细胞死亡或者炎症刺激,肝细胞、肝星状细胞(HSC)、枯否细胞、肝血窦内皮细胞等出现异常诱导产生大量细胞外基质,超出肝降解能力形成纤维沉积,肝修复能力超负荷发生纤维化甚至硬化。 前期已有很多实验证明包括脂肪干细胞在内各种类型的干细胞在大鼠急性和慢性肝损伤方面都能起到修复损伤、改善肝功能的疗效[13-15],但干细胞移植有一定的成瘤性、靶向性差、存活率不高等问题尚未完全解决[16-17]。 研究表明外泌体的旁分泌作用主要通过将内含物转运至靶细胞所在位置,通过与靶细胞膜上的受体结合或者直接与靶细胞膜融合释放活性成分,调控靶细胞的功能,相较于干细胞,外泌体具有免疫原性更低、能自由进出细胞、保存方便、方便大规模提取等优点,更不存在无法穿越血管床等缺点,使其在无细胞治疗领域具有非常大的潜力[18]。 本实验采用无外泌体血清配制培养基,从脂肪干细胞上清液中分离出外泌体,推测外泌体也可以改善大鼠肝纤维化。
本实验采用经典的四氯化碳诱导大鼠肝纤维化模型,建模10 周后,通过HE 染色和天狼星红染色发现模型组大鼠肝细胞出现大片状坏死,门管区纤维结缔组织显著增生,常伴纤维桥连,Ishak 肝纤维化评分60%大鼠均在4 分以上,血清生化转氨酶明显增高,表示建模成功。 经脂肪干细胞和它分泌的外泌体治疗后,血清转氨酶下降、病理切片显示纤维结缔组织减少,Ishak 肝纤维化评分大都降至1~2 分,肝细胞坏死相关因子TGF-β1 以及HSC 活化标记物α-sma(同时也可以作为纤维化标记物)的表达经治疗后均得到下调,说明脂肪干细胞及其分泌的外泌体均能够逆转肝细胞死亡并且抑制肝星状细胞活化,从而减轻肝纤维化程度。 模型组相较于模型鉴定时的BcL-2 表达稍微上调,其余指标无显著差异,可以认为四氯化碳诱导的大鼠慢性肝纤维化模型具有一定程度的自愈能力,与以往的研究结果一致[19],在本实验中未对结果造成明显影响。
目前公认HSC 活化是肝纤维化的关键环节,相关研究已经非常多[20-21],而肝细胞死亡才是肝纤维化的始动环节。 肝细胞死亡分为坏死和凋亡,它们在机制和表现上都是不同的,但是在肝病理上坏死和凋亡往往结伴而行。 它们有共同的致病机制,通过不同的途径都能导致肝发生不可逆的损伤[22]。大量研究表明[23-24],肝细胞凋亡与肝纤维化密切相关,凋亡细胞的DNA 片段可以激活HSC 转分化为肌成纤维细胞(MFB),MFB 分泌大量细胞外基质;吞噬了凋亡小体的枯否细胞诱导促炎症因子和促纤因子产生如TNF-α、TGF-β1 等。 同时,一些凋亡小体会自行裂解,释放后加重肝炎症。 随着病情进展肝血窦内皮出现毛细血管化,导致肝细胞缺血缺氧,进一步加重肝细胞死亡。 理论上若能够干预肝细胞凋亡途径就可以改善纤维化。
本实验通过检测肝组织蛋白检测促凋亡因子Bax 和下游凋亡执行蛋白Caspase3 以及抑凋亡因子BcL-2 的表达,发现ADSCs 组和Exosomes 组Bax 和Caspase3 明显低于模型组,而BcL-2 的表达明显高于模型对照组。 可以推断,四氯化碳导致的脂质过氧化导致肝细胞线粒体通透性增高,激活线粒体凋亡途径中BcL-2 家族中促凋亡基因Bax、Bad、Bim、Bad 等,它们在接收到死亡信号后转移到线粒体中,促进细胞色素C 的释放,放大死亡受体信号,激活下游Caspase3 导致细胞凋亡[25]。 然而该家族内BcL-2、Bcl-XL、Bcl-W、McL-1 等可以通过降低线粒体膜的通透性,减少细胞色素C 的释放,抑制内质网膜上钙离子的流动性,减少氧自由基生成和脂质过氧化物的形成,从而达到抗凋亡的作用[26-27]。
综上所述,脂肪干细胞以及外泌体移植都可以逆转细胞凋亡途径,减轻肝细胞受损程度,从而减少肝星状细胞的激活,改善肝纤维化。 然而脂肪干细胞外泌体中到底是什么因子或者其他生物活性成分在本实验中起主要作用,拟下一步通过对外泌体做蛋白质组学检测或microRNA 测序筛查特异性因子,进一步探索和验证。

