COVID-19 动物模型研究进展
苗晋鑫,宋韶鹤,王 峥,苗明三*
(1.河南中医药大学,中医药科学院,郑州 450046; 2.河南中医药大学第一附属医院,药学部 郑州 450000)
COVID-19 是一种新的传染病,由严重急性呼吸系统综合症冠状病毒2(severe acute respiratory syndrome coronavirus 2, SARS-CoV-2)引起的一种呼吸道疾病。 在SARS-CoV-2 跨大洲的快速传播过程中,已经发现多种突变,其中两个突变(D614G 和S943P)的变异病毒株具有较高的传染性[1]。 全球疫情仍在持续蔓延,给人类生命和身心健康带来严重威胁,同时对中国和世界经济带来巨大影响,给全球公共卫生安全带来巨大挑战。 中国科学家、临床医护研究人员和基础科研人员等联合世界科学家快速报道了一系列针对COVID-19 的研究,包括临床特点[2-3]、SARS-CoV-2 的致病原[4]、病毒基因组测序[5-6]、经验性的诊疗方案[7]、抗SARS-CoV-2药物和疫苗的研发[8]等。 然而,COVID-19 的发病机制不完全清楚,仍然没有针对SARS-CoV-2 特异的治疗方法及药物和疫苗。 目前COVID-19 的基础研究集中在致病机制、抗SARS-CoV-2 药物及疫苗的开发。 动物模型的发展有助于深入了解其发病机制,以及加快药物和疫苗的研发,对于阻止COVID-19 流行蔓延至关重要。 本文就近半年来COVID-19 动物模型制备情况及各种动物模型的特征与使用范围进行总结分析,为将来优化及选择COVID-19 动物模型提供理论参考依据。
1 非人灵长类COVID-19 动物模型
非人灵长类(non-human primates, NHP)动物在遗传学上与人亲缘关系极其相近,解剖学、生理学与病理学等与人相似。 NHP 动物模型一直作为实验研究的金标准,是开展药物和疫苗临床前的最后一步。 Yu 等[9]在正式期刊报道第一篇关于恒河猴感染SARS-CoV-2 的文章,106TCID50/mL HB-01 SARS-CoV-2 病毒株通过气管内感染青年与老年恒河猴,发现青年与老年恒河猴体重减轻和虚弱的临床症状;青年与老年动物都在呼吸道感染后3 d 病毒载量最高;与青年恒河猴相比, SARS-CoV-2 在老年恒河猴引起更严重的弥漫性间质性肺炎与人肺病理学相似。 研究提示,动物年龄可能影响病毒感染后肺疾病的严重程度。 Shan 等[10]采用7×106TCID50的IVCAS 6.7512 SARS-CoV-2 病毒株通过气管对恒河猴进行接种实验,在感染后14 d 出现7%~8%体重下降;实时荧光定量PCR(RT-qPCR)检测发现喉咙感染后1 d 和5 d 病毒载量水平高;组织病理学显示弥漫性间质性肺炎。 Bao 等[11]和Deng等[12]采用106TCID50/mL 的SARS-CoV-2/WH-09/human/2020/CHN 病毒株感染恒河猴,得到了与Yu相似的实验结果。 同时,这两项研究分别发现SARS-CoV-2 可以通过结膜感染引起较轻微的COVID-19 症状和被SARS-CoV-2 感染康复后的猴子近期不会再次感染的特征。 另一项研究采用2.6×106TCID50的nCoV-WA1-2020 SARS-CoV-2 病毒株通过气管内、鼻内、眼和口服联合接种恒河猴,发现受感染的恒河猴出现发烧、呼吸不规则、食欲不振、外观苍白和脱水等症状;所有动物的鼻、咽拭子以及支气管灌洗液均能检测到高水平的病毒载量;肺部CT 显示明显的渗透特征;肺组织损伤与COVID-19 患者相似,该动物模型反映了中度COVID-19 的临床症状和呼吸道病理[13]。 以上研究显示不同病毒株和病毒感染途径可能影响肺的疾病。
由于恒河猴具有与人类相近的免疫系统,因此它们对于测试疫苗或药物的反应将很有用。 中国科研团队首先报道SARS-CoV-2 疫苗在临床前动物体内的研究结果,在第0、7 和14 天给恒河猴接种不同剂量(3 μg、6 μg)的PiCoVacc 疫苗,在第22 天时对动物接种SARS-CoV-2,高剂量组(6 μg)在恒河猴感染后7 d,咽喉、肛门和肺都未检测到病毒,也没有观察到抗体依赖的增强( antibody-dependent enhancement,ADE)现象;肺部组织病理变化显著减少;接种疫苗的恒河猴均未发现发烧和体重减轻等现象;接种疫苗的恒河猴淋巴细胞亚群比例(CD3+、CD4+和CD8+)以及关键细胞因子(TNF-α、IFN-γ、IL-2、IL-4、IL-5 和IL-6)与对照组相比均没有显著变化[8]。 此外,第29 天,疫苗没有引起恒河猴的肝、心、脾、肺、肾和脑等显著病理学特征。 研究提示,在恒河猴中PiCoVacc 疫苗不仅有保护作用,还具有安全性。
除了以上研究组开发的NHP 动物模型,其他小组也在努力寻找非人灵长类COVID-19 动物模型。Lu 等[14]采用3 种NHP 动物,包括恒河猴、食蟹猴和狨猴进行感染SARS-CoV-2 的研究。 实验感染12只恒河猴、6 只食蟹猴和6 只狨猴,结果发现100%(12/12)恒河猴、33.3%(2/6)食蟹猴体温升高,但是6 只狨猴体温保持不变。 病毒RNA 在所有猴子的鼻、口咽、肛拭子和血液中均能检测到。 所有恒河猴和食蟹猴显示胸部放射异常。 但是在尸检时,2只狨猴的所有组织中没有检测到病毒。 这项研究提示,恒河猴和食蟹猕猴动物模型可用来感染研究和疗效评价。 Rockx 等[15]通过气管内和鼻内联合接种年轻和成年两组食蟹猴,结果发现所有动物都产生了SARS-CoV-2 特异性抗体,但没有观察到临床症状。 但是通过RT-qPCR 及鼻、咽和直肠拭子病毒培养物检测,这些动物仍被SARS-CoV-2 感染。年轻动物鼻拭子检测到病毒RNA 在感染后2 d 达到峰值,成年动物在感染后4 d 至8 d 时被检测到病毒RNA。 四分之一的动物出现病毒排出现象与无症状人类相似,提示该COVID-19 食蟹猴模型可以模拟无症状者携带病毒特征。 该研究还比较了感染SARS-CoV-2 的动物与感染SARS-CoV、MERSCoV 的动物,比较发现食蟹猴在感染过程中,能较早检测到SARS-CoV-2。
2 啮齿类COVID-19 动物模型
尽管NHP 动物模型在形态学、生理学、病理学和临床疾病与人有较高的相似性等诸多优势,但是由于价格昂贵、不易得到和数量有限等使用并不广泛。 而啮齿类动物由于价格便宜、易获得和使用、数量充足,且可以进行基因修饰等广泛用于动物实验研究。 目前,用于COVID-19 动物模型有人ACE2(hACE2)转基因小鼠和叙利亚仓鼠(表1)。
2.1 小鼠COVID-19 动物模型
Zhou 等[16]对2019-nCoV(现更名SARS-CoV-2)进行了鉴定和表征,揭示其与SARS-CoV 具有79.6%的相同序列。 重要的是,多项研究证明SARS-CoV-2 与SARS-CoV 使用相同的血管紧张素转化酶2(angiotensin converting enzyme 2, ACE2)受体进入细胞[16-19]。 在严重呼吸综合症(SARS)研究中,已经开发了多种hACE2 转基因小鼠动物模型[20-22]。 Bao 等[23]采用野生ICR 小鼠和hACE2 转基因小鼠复制COVID-19 模型,结果显示SARSCoV-2 不感染ICR 小鼠,易感染hACE2 转基因小鼠。 采用105TCID50/50 μL 的HB-01 SARS-CoV-2病毒株通过鼻内接种于hACE2 转基因小鼠。 与SARS 研究不同,临床表现轻微,hACE2 转基因小鼠在感染后5 d 减重8%,并且出现弓背和外部刺激反应减弱等症状。 RT-qPCR 检测肺部病毒在感染后3 d 达到峰值。 感染后21 d,hACE2 转基因小鼠中检测到针对SARS-CoV-2 S 蛋白的特异性IgG 抗体。病理组织学显示间质性肺炎,伴有明显的巨噬细胞和淋巴细胞渗入肺泡间质,巨噬细胞积累肺泡腔中。 Perlman 利用重组hACE2 的腺病毒载体感染小鼠使小鼠肺细胞表达hACE2 基因,然后再用SARSCoV-2 感染该小鼠模型,发现小鼠体重减轻20%,并出现翘毛症状,但没有小鼠死亡[24]。 由于疫情所限,小鼠模型开发不完全,小鼠在遗传水平可操作和完备的免疫学试剂有助于对未来病毒发病机理研究。
2.2 叙利亚仓鼠COVID-19 动物模型
叙利亚仓鼠对病毒、寄生虫等病原微生物极其敏感的特性,使它常用于感染性疾病的研究[25]。Chan 等[26]最先使用叙利亚仓鼠进行模型制备,105PUF 100 μL SARS-CoV-2[27]鼻内接种叙利亚仓鼠,发现仓鼠被感染后1~6 d 体重下降约11%;从感染后2 d 开始,动物出现了嗜睡、翘毛、驼背以及呼吸急促等症状,并在感染后7 d 时开始恢复,但没有动物死亡。 就临床体征持续时间和随后的恢复而言,与人类发现的轻度至中度疾病发展相似。 RT-qPCR检测发现气道组织中的病毒载量从感染后2 ~7 d逐渐降低,肺组织的病毒载量在感染后2 d 和4 d 最高,肠道中在感染后4 d 最高,这些发现与人上下呼吸道感染的表型非常相似。 随后的一项研究,同样显示了相似的研究结果[28]。 此外,该研究还发现实验感染SARS-CoV-2 的叙利亚仓鼠通过直接接触能有效地将病毒传播给未接种病毒的仓鼠,这些被传染的动物也发展出了轻度至中度的疾病,与接种动物相似。 Sia 等[29]研究发现与近期的报告一致,确定仓鼠支持病毒复制,在感染后7 d 时迅速清除病毒并引起肺细胞增生。 值得注意的是,该研究证实SARS-CoV-2 在叙利亚仓鼠之间传播主要通过气溶胶而不是通过污染物进行的。 Boudewijns 等[30]比较了感染BetaCov/Belgium/GHB-03021/2020 (EPI ISL 407976|2020-02-03) SARS-CoV-2 病毒株的C57BL/6 小鼠、Ifnar1-/-小鼠、Il28 r-/-小鼠、BALB/c小鼠、SCID 小鼠、叙利亚仓鼠、STAT2-/-叙利亚仓鼠和IL28R-a-/-叙利亚仓鼠,发现小鼠的肺感染SARSCoV-2 受到早期I 型干扰素的限制;叙利亚仓鼠允许SARS-CoV-2 感染,并确定STAT2 信号传导在病毒感染中起双重作用,一方面可以加重肺损伤,另一方面又限制了SARS-CoV-2 全身性的传播。 这些研究提示,叙利亚仓鼠可作为很好的COVID-19 小动物模型研究SARS-CoV-2 感染及可能的传播途径。
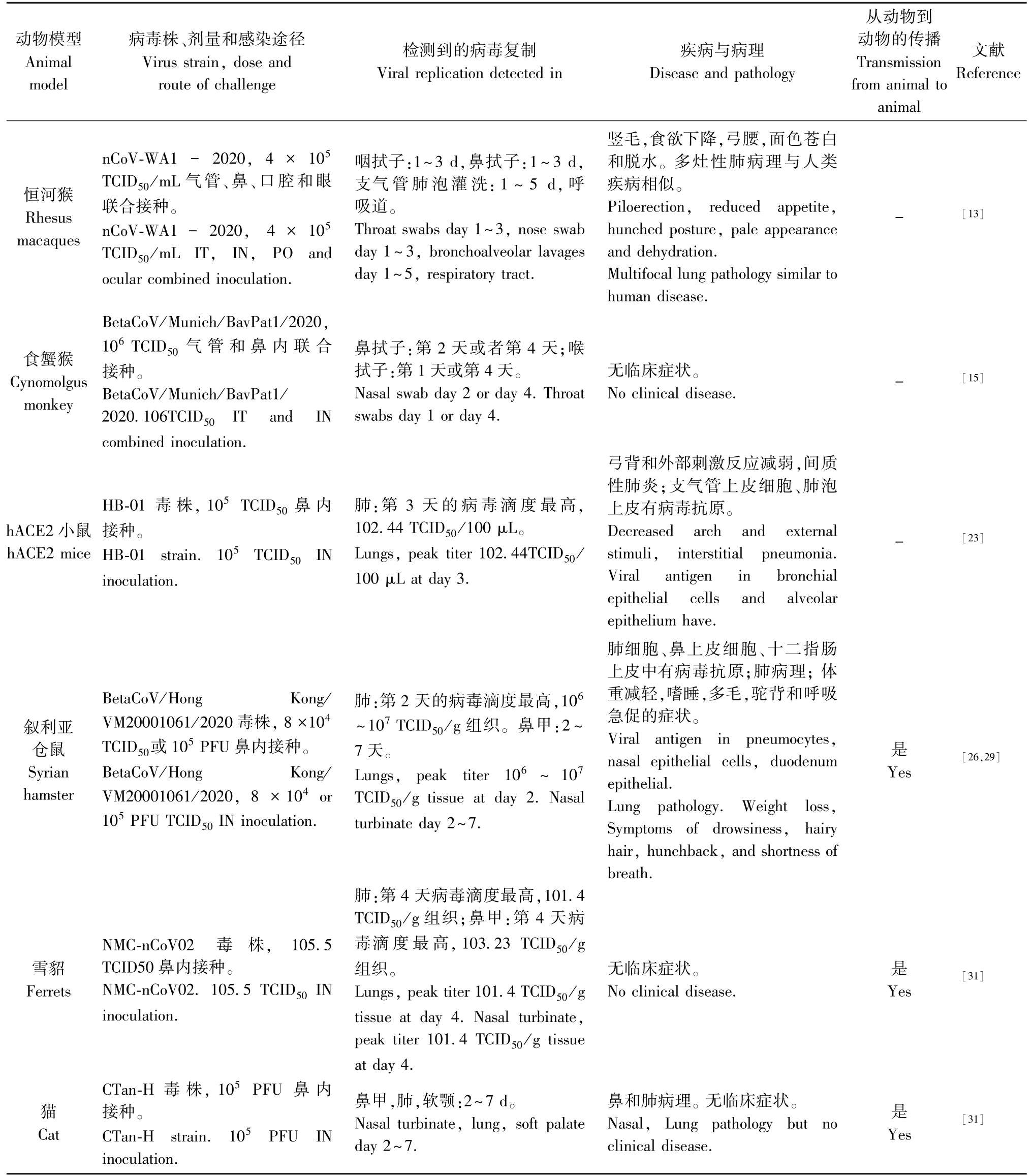
表1 SARS-CoV-2 感染和疾病的动物模型Table 1 Animal models for SARS-CoV-2 infection and disease
3 雪貂COVID-19 动物模型
雪貂的上下呼吸道解剖比例和支气管壁粘膜下腺体的密度与人呼吸道状况非常相似,常用于研究呼吸道病毒的实验动物模型[32-33]。 Shi 等[31]分别采用105PFU SARS-CoV-2/F13/environment/2020/Wuhan(F13-E) 和SARS-CoV-2/CTan/human/2020/Wuhan(CTan-H) 两种SARS-CoV-2 病毒株通过鼻内接种雪貂。 结果显示,感染后的雪貂体温轻微升高,没有出现其他临床症状,不会造成严重疾病或死亡。 两种病毒感染后8 d 鼻洗液依然能够检测到病毒RNA;肺间隔和肺泡腔内II 型肺细胞、巨噬细胞和中性粒细胞的数量增加。 Kim 等[34]采用105.5 TCID50/mL SARSCoV-2 NMC-nCoV02 病毒株经鼻内接种雪貂。 尽管该动物模型未观察到死亡现象,但是利用RT-qPCR 在感染后8 d 的雪貂鼻洗液、唾液、尿液和粪便内可检测到病毒RNA。 重要的是,接触2 d 后,所有直接接触雪貂的动物都检测到SARS-CoV-2,而相邻笼中6个雪貂也有2 个检测到病毒。 这些研究提示,雪貂能模仿COVID-19 的传播动物模型。
4 猫COVID-19 动物模型
Wan 等[35]基于病毒的S 蛋白与ACE2 蛋白复合体的三维分子结构预测模型,发现SARS-CoV-2能有效识别猫等其他动物的ACE2,这些动物的ACE2 蛋白与结合病毒的关键残基相同或相似。 先前SARS 的病毒SARS-CoV 研究表明,家猫能够感染冠状病毒并将其传播给其他猫[36]。 Shi 等[31]为了确定从COVID-19 患者分离冠状病毒(CTan-H)的宿主,经鼻内将105PFU CTan-H SARS-CoV-2 毒株接种家猫。 感染后3 d,两只猫在鼻甲、软颚、扁桃体、肺、小肠中检测到病毒RNA,而感染6 d 在两只动物的鼻甲、软颚、扁桃体,一只动物的气管和另一只动物的小肠中检测到病毒RNA。 对感染后3 d 和6 d 的猫组织病理学显示,鼻、气管黏膜上皮和肺部有大量病变。 同时,与接种猫同笼的未接种猫也感染了SARS-CoV-2,表明猫容易受到空气传播的感染[37]。 需要说明的是,以实验室高剂量病毒感染后的家猫会将SARS-CoV-2 传播给其他猫,暂时没有证据表明自然状态家猫能感染人类。

表2 COVID-19 动物模型应用比较Table 2 Comparison of the applications of COVID-19 animal models
5 结论与展望
中国学者和世界科学家在近半年内的共同努力下,COVID-19 动物模型开发和制备取得了巨大的进展。 研究人员通过非人灵长类、小鼠、叙利亚仓鼠、雪貂、猫和狗[38]感染SARS-CoV-2 复制COVID-19 实验动物模型,其中有些动物显示了不同程度的病理变化及临床症状。 比较分析COVID-19 实验动物模型特征(表2),非人灵长类和hACE2 转基因小鼠可用于研究对COVID-19 治疗方案或药物和疫苗评估。 转基因叙利亚仓鼠有助于研究限制全身性病毒传播的分子途径。 雪貂和家猫拥相对体型较大的优势,有利于重复采样监测病毒载量、免疫反应等研究。 由于缺乏与COVID-19 患者完全一致的临床症状、病理变化和死亡现象的动物模型,研究人员仍在努力探索开发新的动物模型。 随着转基因技术不断发展和对COVID-19 发病机制不断理解,有望制备对SARS-CoV-2 更敏感的实验动物模型。 现有COVID-19 动物模型虽然不够完美,只能显现轻度或中度感染,它们可能无法帮助科研人员了解更严重的病例,但这些轻度感染的动物可能用于发病机制、测试药物和疫苗。 针对现阶段COVID-19 动物模型,作者认为,根据实验目的选择合适动物模型,亦可以多种动物模型互补应用,更好的对COVID-19 了解及疫苗和药物评价与筛选。

