免疫性血小板减少症气不摄血证小鼠外周血小板活化功能的研究
王 攀,蔺亚东,武曲星,侯 敏,高文静,刘建勋,任钧国
(中国中医科学院西苑医院基础医学研究所 中药药理北京市重点实验室, 北京 100091)
免疫性血小板减少症(immune thrombocytopenia,ITP)是一种常见的出血性疾病,主要表现为血小板计数降低、皮肤出血[1]。 目前大多认为血小板在止血过程中发挥着主要的作用,其数量的多少和功能的强弱决定着出血的严重程度。 近年来,临床上发现部分ITP 患者血小板数量降低但没有出血现象或出血程度不严重,相反,部分ITP 患者经治疗后血小板数量回升但仍有出血现象,可见血小板的功能在该出血性疾病中发挥着重要作用。 吕明恩等[2]、Frelinger 等[3]等研究发现ITP 患者的出血程度与血小板活化功能相关。 近年来,ITP 血小板的功能研究越来越受到人们的关注。
气不摄血证是ITP 最常见的一种证型[4-5],蒋群[6]发现ITP 血热妄行证及阴虚血热证患者中主要为轻度、中度出血,而大量及严重出血集中在ITP 气不摄血证患者中。 血小板是血栓形成和止血过程中重要的参与者[7-8],且血小板的黏附、聚集和活化功能在止血过程中发挥着主要作用[9-10]。 目前,关于ITP 气不摄血证血小板功能的研究较少,为此,我们在ITP 气不摄血证小鼠模型的基础上[11],对其外周血小板的活化功能做一探究,明确血小板功能的变化情况,为ITP 气不摄血证的研究提供基础。
1 材料和方法
1.1 实验动物
28 只SPF 级健康雄性BALB/c 小鼠,8 周龄,体重(20±2)g,购自北京维通利华实验动物技术有限公司[SCXK(京)2016-0006];动物饲养于中国中医科学院西苑医院SPF 级实验动物中心[SYXK(京)2015-0011],温度20℃~26℃,湿度40%~70%,昼夜12 h 交替,自由摄食摄水。 本研究获得中国中医科学院西苑医院伦理委员会审批(2018XLC003-2)。 实验严格遵循3R 原则。
1.2 主要试剂与仪器
柠檬酸钠(国药集团化学试剂有限公司,批号:20170605);PBS 缓冲液(北京索莱宝科技有限公司,批号:20180427);大鼠抗小鼠CD41-APC 抗体、(TonboBio,批号:5180518496);小鼠Anti-Ly-6GPE、 CD62P-PE 抗 体( Miltenyi, 批 号 分 别 为:5180924558、5180924576);小鼠β-TG 试剂盒、小鼠PF-4 试剂盒、小鼠ATP 试剂盒、小鼠ADP 试剂盒(Andygene, 批 号 分 别 为: HT21481、 HT20575、HT22026、 HT20827 ); 小 鼠 ROS 试 剂 盒(eBioscience,批号:E118430);小鼠JC-1 试剂盒(BD PMG,批号:7061587);APS(中国中医科学院西苑医院基础医学研究所提供)。 高速冷冻离心机(Thermo,IEC CL31R);超低温保存箱(Haier,DW-86L626);流式细胞仪(BD,FACSARI);酶标仪(芬兰Labsystems Multiskan MS,352 型);扫描电子显微镜(日本HITACHI 公司,S-3400 N)。
1.3 实验方法
1.3.1 动物分组及造模
按照体重与外周血小板计数将BALB/c 小鼠随机分为正常组(13 只)、模型组(15 只)。
参考文献[11]进行造模:模型组小鼠:前7 d 进行睡眠剥夺,后14 d 隔天腹腔注射APS 复合睡眠剥夺,共注射7 次(第8、10、12、14、16、18、20 天注射APS(100 μL/20 g)。 正常组小鼠:前7 d 正常饲养,后14 d 隔天腹腔注射生理盐水7 次(时间与剂量同模型组)。
1.3.2 标本采集
实验结束后,麻醉小鼠,取血,以3.5%柠檬酸钠抗凝,取50 μL 全血当天待测;剩下全血离心,800 r/min,24℃,离心10 min,上清即富血小板血浆(platelet rich plasma,PRP),取出当天待测,下层再3000 r/min,4℃,离心15 min,取上清即血浆,分装后置-80℃冰箱待测。
1.3.3 小鼠血小板形态观察
实验结束后,各组随机取2 只小鼠,制备血小板扫描电镜样本,观察血小板形态变化情况。 样本制备方法如下:小鼠麻醉后,取血,3.5%柠檬酸钠抗凝,800 r/min,24℃,离心10 min,取10 μL 上清平铺在细胞爬片上(长、宽约0.5 cm),10 min 后,加1 mL 戊二醛,使其完全覆没细胞爬片,之后放4℃冰箱保存,待检测。
1.3.4 小鼠血小板α 颗粒、致密颗粒释放的检测
取10 μL 制备好的PRP,按照试剂操作说明书用流式细胞仪检测血小板α 颗粒CD62P 的表达率;将制备好的血浆从-80℃冰箱取出,按照ELISA 试剂盒说明书进行操作,检测血浆中血小板α 颗粒β 血小板球蛋白(β-thromboglobulin,β-TG)、血小板第四因子(platelet facter 4,PF-4),致密颗粒三磷酸腺苷( adenosine triphosphate,ATP)、二磷酸腺苷(adenosine diphosphate,ADP)的释放情况。
1.3.5 小鼠血小板-中性粒细胞黏附(plateletneutrophil aggregation,PNA)的检测
取50 μL 制备好的全血,按照试剂操作说明书用流式细胞仪进行检测。
1.3.6 小鼠血小板线粒体膜电位(mitochondrial membrane potential,MMP)、活性氧平均荧光强度(reactive oxygen species-mean fluorescence intensity,ROS-MFI)的检测
分别取10 μL 制备好的PRP,按照试剂操作说明书用流式细胞仪进行检测。
1.4 统计学方法
2 结果
2.1 血小板形态的变化
扫描电镜显示,正常组小鼠血小板大多呈圆形或圆盘形,形状不规则,部分血小板有少量伪足形成。 模型组小鼠血小板体积增大,呈扁平、片状等不规则形状,有大量伪足形成,部分黏附聚集成团(图1)。

图1 血小板形态的变化(扫描电镜)Note.A, Normal group.B, Model group.C, Normal group.D, Model group.Arrow 1, Platelet pseudopodia.Arrow 2, Platelet aggregation.Figure 1 Changes of platelet morphology (Scanning electron microscopy)
2.2 血小板颗粒释放的变化
与正常组比较,模型组小鼠血小板CD62P、ADP均明显增高(P<0.05),血小板β-TG、PF-4、ATP 均明显增高(P<0.01)(表1、表2,图2)。
2.3 外周血中PNA 的变化
与正常组比较,模型组小鼠PNA 明显增高(P<0.05)(表3,图3)。
2.4 血小板MMP、ROS-MFI 的变化
与正常组比较,模型组小鼠血小板线粒体膜电位(MMP)、活性氧平均荧光强度(ROS-MFI)均显著增高(P<0.01)(表4,图4、图5)。
3 讨论
ITP 是一种常见的出血性疾病,血小板在出血凝血过程中发挥着重要作用[7-8]。 近年来,有关ITP患者血小板功能的报道逐渐多,但结果各异。 王天有等[12]通过检测体内和体外ADP 刺激后血小板表面膜糖蛋白GPIIb/IIIa 和CD62P 的表达,发现ITP患者体内血小板处于低活化状态,可见出血现象与血小板功能降低有关。 但Harker 等研究[13]发现ITP 患者出血时间较其他血小板水平相应的出血时间短,由此推测血小板功能增强。 此外,张娜等[14]研究结果表明瘀血内阻型、阴虚火旺型ITP 患者的血小板膜糖蛋白GPIIb/IIIa 水平高于血热妄行型、气不摄血型,血热妄行型ITP 患者血小板的膜糖蛋白GPIb/IX 水平低于气不摄血型、瘀血内阻型、阴虚火旺型。 因此,本研究认为:①无论血小板功能降低还是增强均属于功能的异常,均能引起出血现象;②血小板功能与中医辨证分型相关,证型不同,血小板功能不同。 本研究主要从血小板的形态、颗粒释放、血小板黏附及凋亡方面来探究ITP 气不摄血证小鼠血小板的活化功能。 血小板在正常状态下呈椭圆形或圆盘形,平均直径约2 ~4 μm,是机体最小的血细胞。 血小板被激活后,其形状发生改变,出现放射状的突起(又称伪足),变成树突型血小板。 在血小板被激活的过程中,大部分颗粒随即释放,血小板之间发生融合,成为粘性变形血小板。本实验扫描电镜结果显示,模型组小鼠血小板体积增大,有大量伪足形成,部分黏附聚集成团,表明模型组小鼠血小板被激活,呈活化状态。
表1 血小板α 颗粒释放的变化()Table 1 Changes of alpha granule release in platelets

表1 血小板α 颗粒释放的变化()Table 1 Changes of alpha granule release in platelets
注:与正常组比较,*P<0.05,**P<0.01。Note.Compared with the normal group, *P<0.05, **P<0.01.
组别Groups CD62P(n)(%)β-TG(n)(μg/L)PF-4(n)(μg/L)正常组Normal group 4.78±1.19(10) 5.17±0.49(10) 5.24±0.22(10)模型组Model group 6.82±3.00(13)* 6.73±0.36(10)** 6.78±0.47(10)**
表2 血小板致密颗粒释放的变化()Table 2 Changes of dense granule release in platelets

表2 血小板致密颗粒释放的变化()Table 2 Changes of dense granule release in platelets
注:与正常组比较,*P<0.05,**P<0.01。Note.Compared with the normal group, *P<0.05, **P<0.01.
组别Groups ATP(n)(nmol/L)ADP(n)(nmol/L)正常组Normal group 441.29±26.11(10) 1546.52±97.83(10)模型组Model group 575.61±31.87(10)** 1627.04±31.38(8)*
血小板被激活后会释放α 颗粒和致密颗粒,其中α 颗粒含有多种活化因子和膜糖蛋白,如纤维蛋白原、组织蛋白酶A、β-TG、PF-4、和CD62P 等,β-TG、PF-4、CD62P 可作为血小板活化的主要指标;致密颗粒含有ATP、ADP 等,ADP 可促进血小板的活化,ATP 为其提供能量,进而促进血小板发挥活化与聚集功能。 本实验结果显示,模型组小鼠血小板CD62P 表达率显著高于正常组,这与文献报道[15]一致,其结果显示ITP 患者血小板的CD62P 表达有不同程度升高的现象,提示模型组小鼠血小板活化程度增高;此外,模型组小鼠β-TG、PF-4 的含量均显著升高,这与俞亚琴等[16]对ITP 患者的临床研究一致,其研究表明ITP 患者血浆中β-TG、PF-4 的含量比对照组高,且ITP 病情越重,β-TG、PF-4 的含量越高,表明血小板活化程度越高,导致其消耗量增加、外周血小板计数降低;模型组小鼠血小板血浆中ATP、ADP 的含量均显著高于正常组,表明模型组小鼠血小板呈活化状态,这与棘启明等[17]研究相反,其研究表明ITP 患者ATP、ADP 的释放减少,这可能与ITP 证型相关,其原因需进一步研究。
表3 外周血中PNA 的变化(,n)Table 3 Changes of PNA in peripheral blood

表3 外周血中PNA 的变化(,n)Table 3 Changes of PNA in peripheral blood
注:与正常组比较,**P<0.05,**P<0.01。Note.Compared with the normal group, *P<0.05, **P<0.01.
组别Groups n PNA(%)正常组Normal group 10 16.23±4.38模型组Model group 12 22.78±7.41*
表4 血小板MMP、ROS-MFI 的变化(,n)Table 4 Changes of MMP and ROS-MFI in platelets

表4 血小板MMP、ROS-MFI 的变化(,n)Table 4 Changes of MMP and ROS-MFI in platelets
注:与正常组比较,*P<0.05,**P<0.01。Note.Compared with the normal group, *P<0.05, **P<0.01.
组别Groups MMP(n)(%) ROS-MFI(n)正常组Normal group 87.44±6.32(10) 539.57±77.39(11)模型组Model group 99.00±0.45(10)** 828.92±161.02(11)**
PNA 可作为血小板活化的敏感指标[18],黏附的强弱代表着血小板活化的强弱。 CD41、LY-6G分别是血小板、中性粒细胞的特异性标志物,本实验通过流式细胞术检测小鼠外周血中CD41 与LY-6G 双阳性表达含量百分比来表示PNA 的百分率。结果显示PNA 增高,提示模型组小鼠血小板与中性粒细胞黏附率增高,活化增强。
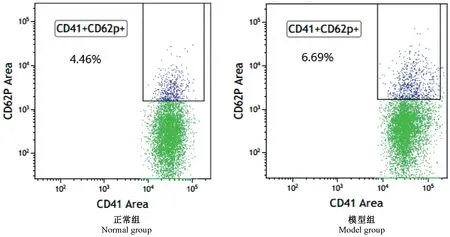
图2 血小板CD62P 表达率的变化Figure 2 Changes of CD62P expression rate in platelets

图3 血小板PNA 的变化Figure 3 Changes of PNA in peripheral blood
研究报道[19-20],血小板虽然没有细胞核,但也存在着凋亡现象,线粒体介导的内始式途径在其凋亡过程中起主要调控作用。 尹俊等[21]发现ITP 患者的血小板凋亡率较高,主要表现在血小板MMP降低、促凋亡蛋白和抗凋亡白的异常表达等。 血小板MMP 的降低表示血小板去极化,研究表明MMP降低是血小板早期凋亡的一种反应;ROS 是一种氧单电子的还原物,主要由线粒体产生,可通过降低血小板内NO 含量、提高血小板内Ca2+浓度促进血小板活化[22-23];此外ROS 还可诱导线粒体通透性转换孔开放,进而使MMP 降低,引起细胞凋亡[24-25]。 本实验结果显示,模型组小鼠去极化血小板百分率明显升高,血小板ROS-MFI 显著高于正常组,提示模型组小鼠血小板凋亡率高于正常组,提示血小板凋亡可能与ITP 的发病机制相关,这与尹俊等[21]、邵泽伟等[26]临床研究一致。
综上,无论是血小板形态、血小板颗粒释放还是血小板黏附及凋亡,均表明了该模型小鼠外周血小板呈高度活化状态,提示该模型小鼠血小板的活化与黏附功能没有丧失,反而增强。 血小板活化后,一方面发挥其黏附和聚集功能,一方面消耗血小板,加速其数量的降低,这与该模型中外周血小板计数显著降低表现一致,提示血小板异常的活化功能可能是其发病机制之一,由此推测血小板的高活化状态也是引起气不摄血证的原因之一,这为ITP 气不摄血证的研究提供了新的思路,同时也为血小板的研究奠定了基础。
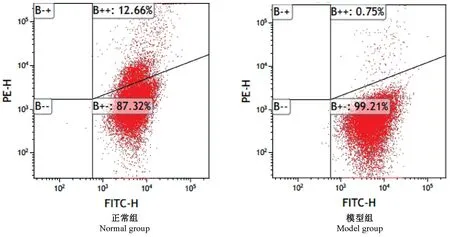
图4 血小板MMP 的变化Figure 4 Changes of MMP in platelets

图5 血小板ROS-MFI 的变化Figure 5 Changes of ROS-MFI in platelets

