安罗替尼联合多西他赛二线治疗驱动基因阴性晚期非小细胞肺癌的临床疗效
冯继,潘娜,胡中舟,方军
信阳市中心医院肿瘤内科,河南 信阳 464000
肺癌是全球范围内常见的恶性肿瘤之一,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)占全部肺癌的85%[1]。超过70%的NSCLC患者确诊时已处于中晚期,晚期NSCLC患者的治疗以化疗为主[2]。一直以来表皮生长因子受体酪氨酸激酶抑制剂或含铂类双药联合化疗是晚期NSCLC患者的一线治疗方案,但有研究发现绝大多数驱动基因阴性的晚期肺癌患者无靶向治疗指征,且含铂类双药联合化疗后存在较高的复发或转移风险[3-4]。多西他赛是晚期肺癌患者的二线化疗药物,研究证实其单一用药的有效率非常低[5]。如何提高驱动基因阴性晚期肺癌患者的二线治疗疗效成为临床研究的热点。安罗替尼是一种新型小分子多靶点酪氨酸激酶抑制剂,药理学研究证实其可有效抑制表皮生长因子受体(epidermal growth factor receptor,EGFR)、成纤维细胞生长因子受体等,具有抗肿瘤血管生成和抑制肿瘤生长的作用,目前在多种恶性肿瘤(如NSCLC、胃癌、结直肠癌等)中被证实具有确切的疗效[6-7]。本文旨在探讨安罗替尼联合多西他赛二线治疗驱动基因阴性晚期NSCLC患者的临床疗效,现报道如下。
1 资料与方法
1.1 一般资料
选择2018年4月至2018年10月信阳市中心医院收治的驱动基因阴性晚期NSCLC患者。纳入标准:①经病理学检查确诊为腺癌或鳞状细胞癌,且EGFR和间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)驱动基因阴性的Ⅲb~Ⅳ期NSCLC;②年龄>18岁;③经一线化疗后病情进展;④体力活动状态(performance status,PS)评分≤2分;⑤生存期>3个月;⑥临床资料和随访资料完整。排除标准:①一线化疗方案中包含多西他赛;②治疗依从性较差;③合并严重的基础性疾病;④有出血倾向或正在接受抗凝药物治疗;⑤合并风湿性心脏病或肝肾功能不全或哮喘等疾病。依据纳入和排除标准,本研究共纳入60例患者。按照治疗方法的不同将患者分为对照组(n=26)和观察组(n=34),对照组患者接受多西他赛单药治疗,观察组患者接受安罗替尼联合多西他赛治疗。两组患者的性别、年龄、吸烟史、饮酒史、TNM分期及PS评分比较,差异均无统计学意义(P>0.05)(表1),具有可比性。
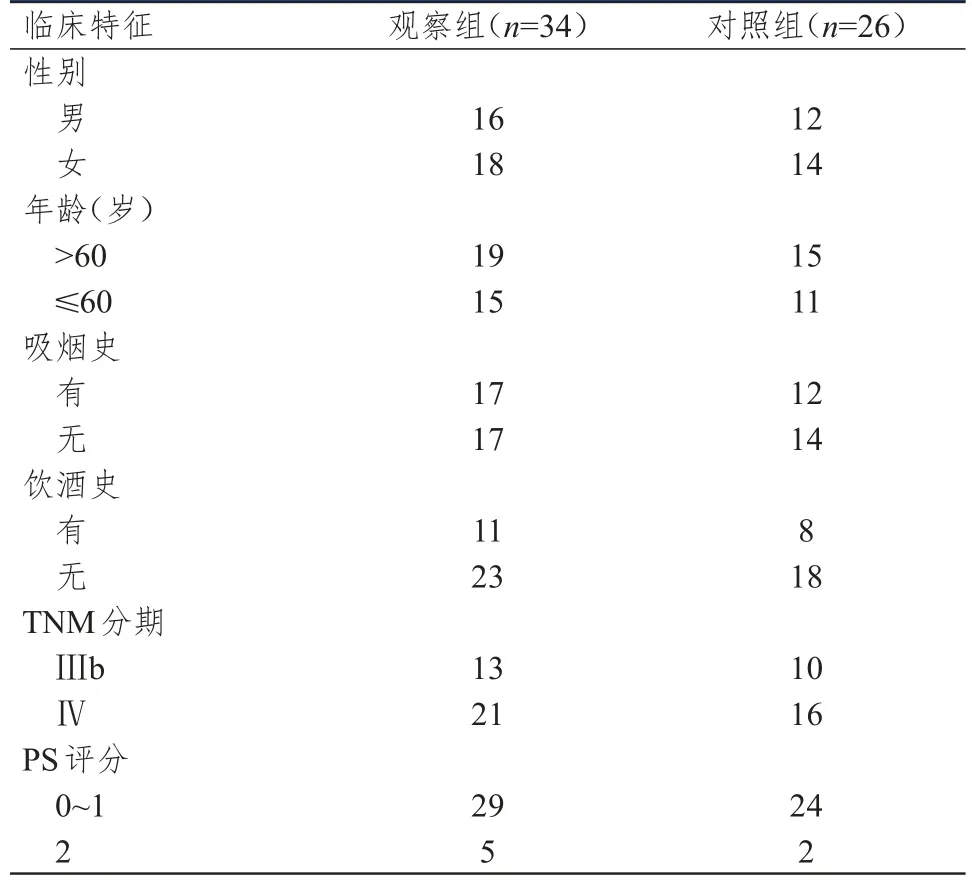
表1 两组患者的临床特征
1.2 治疗方法
对照组患者接受多西他赛单药治疗,根据患者所需补充地塞米松,给予患者多西他赛注射液,60 mg/m2静脉滴注1 h,每3周1次,3周为1个疗程,持续用药至病情进展或无法耐受。观察组患者接受安罗替尼联合多西他赛治疗,给予患者多西他赛注射液,60 mg/m2静脉滴注1 h,每3周1次,同时给予患者盐酸安罗替尼胶囊治疗,12 mg,每日1次,早餐前温水送服,连续用药2周后停药1周,3周为1个疗程,持续用药至病情进展或无法耐受。两组均持续治疗2个疗程。
1.3 观察指标及评价标准
治疗2个疗程后,采用实体瘤疗效评价标准(response evaluation criteria in solid tumor,RECIST)1.1版[8]评估两组患者的临床疗效:完全缓解(complete response,CR),肿瘤病灶完全消失,且至少维持4周;部分缓解(partial response,PR),肿瘤病灶最大径之和减少≥30%,且至少维持4周;疾病稳定(stable disease,SD),肿瘤病灶最大径之和减少<30%或增加<20%,且至少维持4周;疾病进展(progressive disease,PD),肿瘤病灶最大径之和增加≥20%或出现新病灶。总有效率=(CR+PR)例数/总例数×100%,疾病控制率=(CR+PR+SD)例数/总例数×100%。采用电话或门诊方式对患者进行定期随访,随访截止时间为2019年10月,比较两组患者的1年无进展生存情况。采用世界卫生组织(World Health Organization,WHO)抗癌药急性及亚急性毒性反应分级标准[9]评估两组患者3级及以上不良反应的发生情况。
1.4 统计学方法
采用SPSS 20.0软件对数据进行统计分析,计数资料以例数和率(%)表示,组间比较采用χ2检验;采用Kaplan-Meier法绘制生存曲线,组间比较采用Log-rank检验。以P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效的比较
观察组患者的总有效率为47.06%(16/34),高于对照组的19.23%(5/26),差异有统计学意义(χ2=5.015,P=0.025);观察组患者的疾病控制率为67.65%(23/34),明显高于对照组的38.46%(10/26),差异有统计学意义(χ2=5.071,P=0.024)。(表2)

表2 两组患者的临床疗效[n(%)]
2.2 生存情况的比较
两组患者均获得有效随访,随访时间为6~12个月,平均随访时间为(8.26±1.06)个月。观察组和对照组患者的1年无进展生存率分别17.65%和0%,中位无进展生存时间分别为8.1个月和6.1个月。观察组患者的1年无进展生存情况优于对照组,差异有统计学意义(χ2=5.098,P=0.024)。(图1)
2.3 3级及以上不良反应发生情况的比较
观察组患者的3级及以上不良反应发生率为29.41%(10/34),与对照组的15.38%(4/26)比较,差异无统计学意义(P>0.05)。(表3)
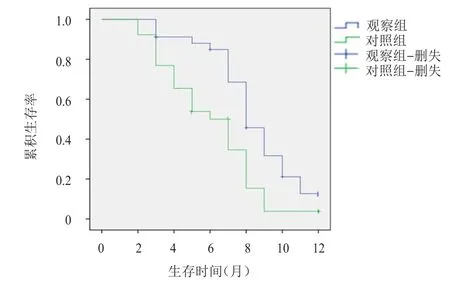
图1 观察组(n=34)和对照组(n=26)患者的无进展生存曲线

表3 两组患者3级及以上不良反应的发生情况[n(%)]
3 讨论
近年来NSCLC患者的治疗已进入分子靶向治疗的个体化阶段,但仅驱动基因阳性NSCLC患者可受益[10]。相关研究证实目前一线化疗治疗驱动基因阴性NSCLC患者的总缓解率较低,并且绝大多数患者在化疗中后期会出现疾病进展,影响患者预后,因此,如何改善驱动基因阴性NSCLC患者的预后及提高二线化疗的有效率是现阶段临床研究的重点[11]。多西他赛为临床中常用的二线化疗药物,其单独使用的有效率<15%,且患者的中位生存时间<9个月[12]。而化疗联合免疫治疗或抗血管生成治疗在提高临床疗效、改善患者预后的同时可扩大适用人群,如化疗联合免疫治疗可提高免疫治疗单药疗效较弱患者的疗效。研究表明,恶性肿瘤患者存在血管内皮生长因子(vascular endothelial growth factor,VEGF)异常表达[13]。安罗替尼属于中国自主研发的新型口服小分子抗血管生成药物,药理学研究发现安罗替尼与VEGF受体具有较高的亲和性,可与之特异性结合,抑制VEGF与其受体的结合,在一定程度上降低肿瘤微血管密度并抑制肿瘤血管生成,并且安罗替尼可降低肿瘤细胞对化疗药物的耐药性[14]。因此考虑安罗替尼联合多西他赛二线治疗驱动基因阴性NSCLC患者具有一定的临床效果。
目前关于多西他赛二线化疗联合抗血管生成治疗的研究不少。刘旭阳和郑静[15]的研究证实阿帕替尼联合多西他赛二线治疗晚期NSCLC患者的近期疗效尚可,并可明显延长患者的无进展生存期,与联合用药可更有效地抑制肿瘤进展有关。田丹等[16]关于阿帕替尼联合多西他赛二线治疗晚期NSCLC患者近期疗效及预后分析的研究指出,联合治疗在提高患者近期疗效的同时,还可改善患者预后,且不良反应可控。本研究结果显示,观察组患者的总有效率和疾病控制率均高于对照组(P<0.05),提示安罗替尼联合多西他赛二线治疗驱动基因阴性晚期NSCLC患者的近期疗效优于单一多西他赛治疗,与上述研究结果相符。本研究中观察组患者的总有效率高达47.06%,高于上述学者报道的30.00%、35.42%,可能与本研究的样本量较小或抗血管药物安罗替尼抑制肿瘤进展的效果更明显有关。研究表明,多西他赛单独治疗驱动基因阴性NSCLC患者的疗效有限[17]。而多西他赛联合安罗替尼治疗驱动基因阴性NSCLC患者,可提高药物与VEGF受体的特异性结合能力,从而有效地降低肿瘤微血管密度并抑制肿瘤血管生成[18-19],此外,安罗替尼可降低肿瘤细胞对化疗药物的耐药性[20]。因此观察组在抑制肿瘤细胞增殖、侵袭中的效果更为明显。本研究结果还显示,观察组患者的1年无进展生存情况优于对照组(P<0.05),且两组患者3级及以上不良反应发生率比较,差异无统计学意义(P>0.05)。表明安罗替尼联合多西他赛二线治疗可有效改善驱动基因阴性晚期NSCLC患者的预后,且安罗替尼联合多西他赛二线治疗驱动基因阴性晚期NSCLC患者的耐药性较好,具有一定的安全性。
综上所述,安罗替尼联合多西他赛或可作为一线化疗失败的驱动基因阴性晚期NSCLC患者的有效治疗方案。

