大棚甜瓜枯萎病病原鉴定及其生物学特性
王先挺, 曾立红, 王 斌, 张晓萌, 俞贤琼
(宁波市鄞州区农业技术推广站, 浙江 宁波 315100)
近10年来,宁波市试验推广哈密瓜型甜瓜种植,取得了良好的经济效益,并已形成一定的产业,全市春季种植总面积为0.1万hm2以上,单季产值1.2亿~1.5亿元。甜瓜的主要病害是蔓枯病,2012年后甜瓜枯萎病的发生日益严重,严重年份发病率达30%~50%,直接影响甜瓜的产量和质量,给生产带来严重损失。甜瓜枯萎病在整个生长周期都可发病,以开花期、坐果期和果实膨大期3个阶段为高发期,发病初期可有1~2枝蔓失水萎蔫,随后根茎腐朽变褐色,引起整株萎蔫枯死。抽样调查显示,宁波地区大棚种植地块甜瓜枯萎病的平均发病率在40%以上,主要发生在开花坐果以后,特别是在持续多日阴雨天转晴,大棚内温湿度骤然升高,不及时降温降湿的情况下更易发生。发病初期,叶片从基部开始逐渐向上萎蔫,中午明显,早晚恢复正常,几天后叶片全部凋萎,根茎部缢缩,维管束变褐,整株枯死。
枯萎病是制约农业产业化发展的一种世界性土传真菌病害,严重危害棉花、甘蔗、香蕉、番茄、瓜类、四季豆及辣椒等[1-2]经济作物。尖孢镰刀菌甜瓜专化型(Fusariumoxysporumf.sp.melonisW.C. Snyder &H.N. Hans)是甜瓜枯萎病主要病原菌,其病原菌菌丝和孢子可在土壤或未腐熟肥料中存活,从根部伤口或根尖组织侵染植物组织,在植株体内定殖[3]。目前,国际上已经鉴定出4种甜瓜专化型枯萎病生理小种,而且不同地区甜瓜专化型生理小种的分布存在差异[4];杨来新等[5]研究表明,甜瓜根腐病与枯萎病病原菌发病症状及病原形态相似。明确病原菌的种类及其生物学特性是进行病害防治的基础,但是目前尚未见有关宁波地区甜瓜枯萎病病原菌的研究报道。因此,以宁波大棚典型甜瓜枯萎病病株为试材,采用组织分离法结合科赫氏法则 (Koch’s postulates)、形态学观察及rDNA-ITS区序列检测等方法,研究甜瓜枯萎病病原及其生物学特性,以期为甜瓜枯萎病的预防与防治奠定基础。
1 材料与方法
1.1 材料
1.1.1 感病植株 新发病的甜瓜枯萎病病株,采自宁波市鄞州区农业科学研究所试验基地甜瓜大棚。
1.1.2 试剂 0.1%升汞,马铃薯葡萄糖琼脂(PDA)培养基,葡萄糖、蔗糖、乳糖、麦芽糖和可溶性淀粉,L-酪氨酸、脯氨酸、甘氨酸、硝酸钠、L-谷氨酰胺、L-丝氨酸、L-白氨酸和L-天冬氨酸、(0.2 mol/L Na2HPO4-0.1 mol/L柠檬酸缓冲液、0.05 mol/L Na2HPO4-0.1 mol/L NaOH缓冲液,SDS购于上海生工生物公司。
1.1.3 仪器设备 恒温培养箱,离心机,Mastercyclerpro 银制梯度 PCR扩增仪。
1.1.4 其他 甜瓜种子,品种为红妃哈密瓜,上海菲托种子有限公司;培养土,购于花圣园艺科技公司。
1.2 方法
1.2.1 病原菌分离 2015年5月12日从宁波市鄞州区农业科学研究所试验基地甜瓜大棚采集试样用于分离枯萎病病菌。田间调查发现,该基地2012年甜瓜枯萎病平均发病率17.9%,2015年为31.6%。参照文献[6]的方法,采集新发病的甜瓜枯萎病病株,取病株茎段病健组织交界处上方5 cm取样,经自来水冲洗,切成5 mm左右长度,用0.1%升汞表面消毒3 min,无菌水冲洗3遍,然后将组织块置于马铃薯葡萄糖琼脂(PDA)培养基上,于28℃恒温培养箱中培养36~48 h,待组织块周围长出菌丝时,挑取边缘单根菌丝转接培养,即获得纯分离菌株。
1.2.2 病原菌致病性检测 采用蘸根法、浸种法、浇根法和菌丝块接茎基部法接种病菌,以空白处理为对照,每个处理接种10株甜瓜,3次重复。操作步骤: 1) 将分离所得的真菌在PDA培养基上培养7 d,用灭菌水洗下分生孢子,显微计数检测孢子浓度,分别制成5×105个/mL的孢子悬浮液备用。2) 空白对照处理,将培养土灭菌后装入预先消毒的直径为15 cm的花盆中浇水备用。将甜瓜种子在清水中浸泡12~14 h,挑选露嘴的种子插入培养土中(大约1/3),每盆5粒,在25~30℃的温室内正常培育管理,观察病情。3) 蘸根法,挖取盆中子叶完全展开的甜瓜幼苗,洗净其根部,采用浸根接种法接菌[7],即将其根系浸入孢子悬浮液中10 min,以无菌水浸根作对照。接菌后的幼苗定植于营养钵内,在温室内正常管理,观察病情。4) 浸种法,将种子浸泡到孢子悬浮液种12~14 h,挑选露嘴的种子插入(大约1/3)到培养土中,其他同空白对照。5) 浇根法,当盆中甜瓜幼苗真叶完全展开时,用5×105个/mL的孢子悬浮液滴浇甜瓜幼苗根部,每株滴浇1 mL,其他同空白对照。6) 菌丝块接茎基部法,当盆中甜瓜幼苗子叶完全展开时,切取3 mm×3 mm的PDA培养基上培养5 d的病原菌菌丝块和分生孢子(培养基一同切取),粘帖在离培养土1 cm左右的甜瓜幼苗茎基部,3 d后去掉菌丝块,其他同空白对照。选取回接试验显示萎焉症状的植株离培养土5~10 cm主茎,菌丝块接茎基部法离病部5~10 cm主茎再作分离,分离到的真菌参照BOOTH[8]的方法和标准进行培养,同时进行形态学和分子生物学鉴定。
1.2.3 病原菌鉴定
1) 形态学鉴定。将供试菌株和经致病性测定后再分离获得的菌株接种到PDA培养基上,28℃、12 h光照/12 h黑暗恒温培养4 d后观察菌落培养性状,测量菌落大小,待产孢后,通过制玻片、显微镜观察病原菌分生孢子形态特征。根据病菌生长速度、菌落形态特征和产孢特征,查阅真菌分类资料确定病原菌种类。
2) 分子生物学鉴定。采用PDA培养基培养待鉴定菌株,收集菌丝体,采用SDS法提取菌体基因组DNA[9]。琼脂糖凝胶电泳检测基因组DNA分子的大小、完整性及电泳条带的清晰度。DNA样品在-20℃冰箱保存备用。然后,扩增检测基因组PCR。采用ITS1 5′-TCCGTAGGTGAACCTGCG
G-3′和ITS4 5′-TCCTCCGCTTAT TGATATGC -3′对提取的真菌基因组全长ITS区序列进行PCR扩增。PCR退火温度58℃。将扩增出来的目的核酸片段送杭州华大基因生物工程有限公司纯化后进行测序。采用MEGA 4构建系统发育树,将核酸片段测序结果提交NCBI的GENBANK数据库进行BLAST比对,选取相似度高的序列和一外族序列作为构建进化树的序列;采用ClusterX进行比对分析,将比对结果导入MEGA 4中,采用Neighbor-Joining方法构建系统发育树。
1.2.4 病原菌生物学特性测定 考察不同碳源、氮源、生长温度和pH对病原菌生长的影响及病原菌的致死条件。将回接分离确定的病原菌代表性菌株在PDA平板上28℃培养3 d,用灭菌的内径5 mm的打孔器切取菌落边缘菌饼,分别移至不同培养基中央,28℃黑暗培养3 d。3次重复,3 d后用直尺测量菌落生长直径。
1) 碳源。设5个处理,以葡萄糖、蔗糖、乳糖、麦芽糖和可溶性淀粉等为碳源,基本培养基为PDA,其他处理则将PDA中的葡萄糖替换成相同浓度的其他碳源。
2) 氮源。设8个处理,以L-酪氨酸、脯氨酸、甘氨酸、硝酸钠、L-谷氨酰胺、L-丝氨酸、L-白氨酸和L-天冬氨酸等为氮源,基本培养基为蔡氏培养基,其他处理则将蔡氏培养基中的硝酸钠转换成相同浓度的其他氮源。
3) pH。设8个处理,用磷酸盐缓冲液(0.2 mol/L Na2HPO4-0.1 mol/L柠檬酸缓冲液和0.05 mol/L Na2HPO4-0.1 mol/L NaOH缓冲液)将灭菌的PDA培养基调节pH分别为3.0、4.0、5.0、6.0、7.0、8.0、9.0和10.0。
4) 生长温度。设8个处理,试验温度为5℃、10℃、15℃、20℃、25℃、28℃、30℃和35℃,培养基为PDA,分别置于不同温度的培养箱内培养。
5) 致死条件。将经致病性测定后再分离获得的菌株接种到PDA培养基上培养5 d,用灭菌水洗下分生孢子制成浓度为4.6×104个/mL的孢子悬浮液,分别装在无菌的10 mL离心管内,在46℃、48℃、50℃和52℃的水浴锅中处理10 min,再用移液枪吸取100 μL分别涂布在PDA培养基上,于28℃黑暗培养3 d,3次重复,3 d后测量生长情况和菌落直径。
1.3 数据统计分析
数据分析采用SPSS 15.0进行方差分析和多重比较(Duncan法)。
2 结果与分析
2.1 甜瓜枯萎病菌的分离及其致病性
从甜瓜病株茎蔓组织中分离获得1株真菌,将分离到的菌株采用蘸根法、浸种法、浇根法和菌丝块接茎基部法回接至健康甜瓜苗上,其发病症状与自然发病症状基本一致(图1)。其中,蘸根法,病菌回接10 d,2株甜瓜出现轻微萎焉症状,15 d时有5株甜瓜出现明显萎焉症状,21 d共有21株甜瓜出现萎焉症状,回接发病率为70.0%。菌丝块接茎基部法,病菌回接5 d后有12株甜瓜茎部出现病斑,15 d时病斑扩大并且明显溢缩,病部长灰白色菌丝体和分生孢子,21 d时共有22株甜瓜出现萎焉症状,回接发病率为73.3%。浸种法,病菌回接10 d时有3株甜瓜在下部叶上出现轻微萎焉症状,上部叶仍然正常,21 d时共有11株甜瓜的下部叶出现明显枯萎症状,回接发病率为36.7%。浇根法,回接发病症状同浸种子法一致,回接发病率为33.3%。从所有回接试验中采集显示枯萎症状的植株,在其离培养土5~10 cm的主茎中均再次分离到相同的真菌菌株。
2.2 病原菌鉴定
2.2.1 形态学观察 分离获得的真菌经25℃培养4 d后,在PDA培养基上形成直径为41.3 mm的菌落,并产生大量的小型分生孢子,未见大型分生孢子;培养10 d后,偶见大型分生孢子。小型分生孢子从单个瓶状小梗上产生,粘附在一起,不链生。单孢,椭圆或略弯,大小为(2.9~3.4)μm×(3.5~7.4)μm;1个分隔的大小为(3.0~3.3)μm×(3.5~8.2)μm(图2)。大型分生孢子着生在单瓶梗上,多数2~3个分隔;2个分隔的大小为(4.3~6.4)μm×(22.6~31.0)μm;3个分隔的大小为(4.8~6.4)μm×(16.0~35.4)μm。参照BOOTH[8]的镰刀菌专著(The Genus Fusarium),初步鉴定宁波甜瓜枯萎病的病原为Fusariumoxysporum。
2.2.2 分子鉴定 使用ITS1和ITS4引物对病原菌基因组进行PCR扩增后测序获得455 bp大小的PCR片段。使用Clustalx和MEGA 4生物信息软件以Neighbor-Joining方法构建的系统发育树表明,该片段DNA序列与镰刀菌Fusariumoxyspor-umstrain A0654 ITS区段相似性高达98%(图3),二者处于同一分支,同源性很高。
2.3 镰刀菌的生物学特性
2.3.1 碳源对病原菌生长的影响 从表1看出,碳源对病原菌生长(菌落直径)的影响差异显著,不同碳源病原菌的菌落直径为葡萄糖>蔗糖>α-乳糖=可溶性淀粉>麦芽糖。其中,葡萄糖为最佳碳源,其菌落直径最大,为38.3 mm,极显著高于其余碳源;蔗糖其次,菌落直径为34.7 mm,与其他碳源差异显著;其余碳源间差异不显著。
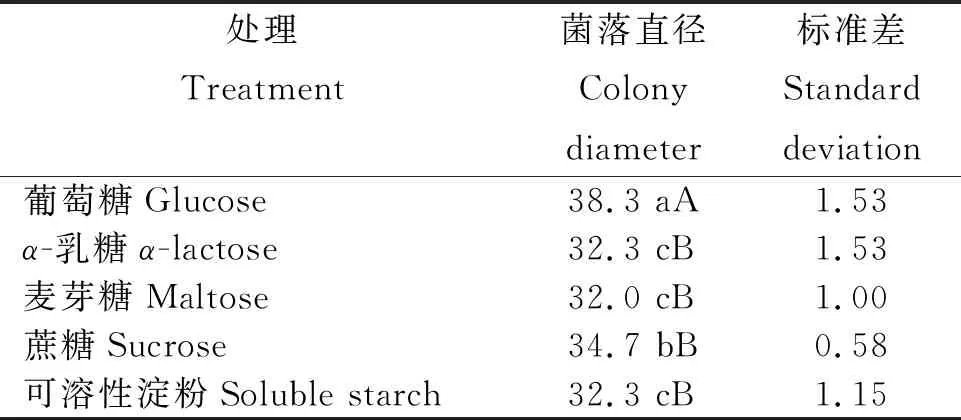
表1 不同碳源处理病原菌的菌落直径
2.3.2 氮源对病原菌生长的影响 从表2看出,氮源对病原菌生长(菌落直径)的影响差异显著,不同氮源病原菌的菌落直径为硝酸钠>甘氨酸>白氨酸=酪氨酸>脯氨酸>谷氨酰胺>丝氨酸>天冬酰胺。其中,硝酸钠为最佳氮源,其菌落直径为40.3 mm,与甘氨酸差异显著,极显著高于其余氮源;甘氨酸其次,其菌落直径为37.3 mm,显著高于脯氨酸,极显著高于谷氨酰胺、丝氨酸和天冬酰胺,与其余氮源差异不显著;白氨酸、酪氨酸、脯氨酸和谷氨酰胺间差异不显著,但均极显著高于丝氨酸和天冬酰胺。
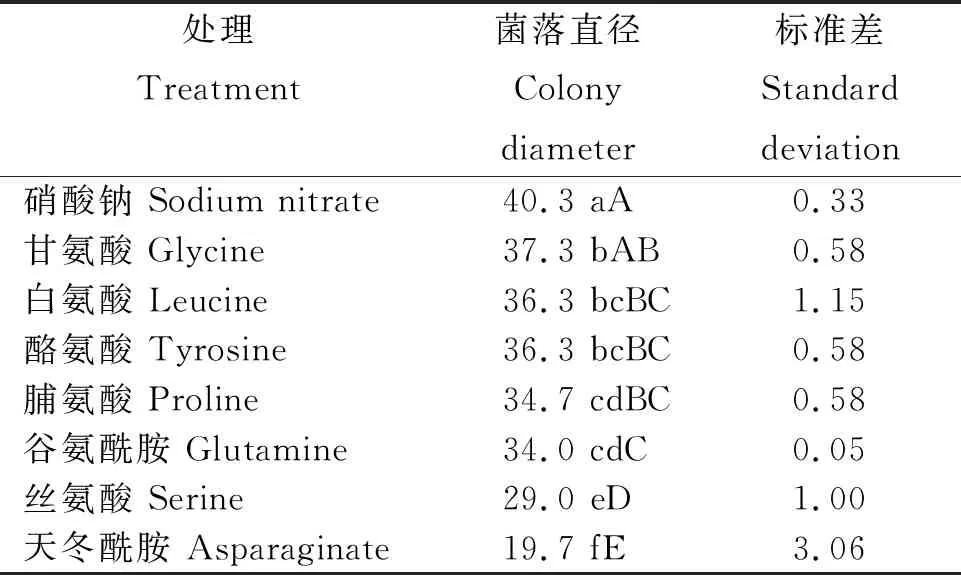
表2 不同氮源处理病原菌的菌落直径
2.3.3 温度与pH对病原菌生长的影响 从图4看出,随着培养温度和pH升高,菌落直径分别呈先增后减和先增后减再增再减趋势,温度和pH对病原菌生长(菌落直径)的影响存在差异。其中,病原菌在15~35℃均能生长,25℃生长最佳,25℃菌落直径最大,为41.7 mm,显著高于其余温度;25~30℃生长较好,菌落直径显著高于其余温度;温度大于30℃生长受到明显抑制。病原菌对pH改变有较强的耐受性,在培养基pH 5.0~10.0均生长较好,且菌落大小无显著差异(pH 8除外);培养基pH为4时,病原菌生长受到显著抑制。
2.4 病原菌的致死条件
试验结果显示,病原菌孢子在46℃和48℃处理10 min后仍存活且在培养基上形成大量菌落;50℃处理后仅观察到少量的小菌落形成;52℃处理后未形成菌落。表明,该病原菌分生孢子的致死条件为52℃ 10 min。
3 结论与讨论
研究结果表明,宁波春季大棚甜瓜枯萎病病原菌为尖孢镰刀菌(Fusariumoxysporum),与邵元健等[10]的研究一致,但与康锋等[11]报道的新疆甜瓜枯萎病病原菌为腐皮镰孢菌〔Fusariumsolani(Mart.) Sacc.〕不同。可见,不同地区甜瓜枯萎病的病原种类、致病机理存在一定差异。已报道的甜瓜枯萎病菌的生理小种有4个,分别为小种0、1、2和1.2[12]。总体上,具有地区针对性的枯萎病病原筛选和鉴定工作对于当地甜瓜枯萎病发生的防治具有重要指导意义。宁波春季大棚甜瓜枯萎病病原菌的生理小种有待进一步探明。
研究表明,葡萄糖和蔗糖、硝酸钠和甘氨酸分别为该菌生长的较好碳源和氮源;病原菌在15~35℃均能生长,25~30℃生长较好,25℃生长最佳;病原菌对pH变化有很强的适应性,在pH 5.0~10.0均生长良好,表明,改变土壤pH并不能有效遏制该病原菌生长。病菌分生孢子的致死温度为52℃ 10 min,与前期在西瓜枯萎病菌上的报道类似[13],同时一定程度上证明南方伏天灌水覆单层白膜提高大棚温度能够有效防治大棚甜瓜枯萎病的发生。
试验结果表明,蘸根法、浸种法、浇根法和菌丝块接茎基部法均能导致发病,蘸根法和菌丝块接茎基部法发病率高,回接发病率分别为70.0%和73.3%;浸种子法和浇根法的回接发病症状不典型,只在下部叶上出现枯萎症状,上部叶仍然正常,但是再次分离发病病株茎仍能得到相同的镰孢菌。表明,种子带菌可以作为病害的初侵染来源,病菌可以通过胚根侵染发芽的种子,与前人的研究结果一致[14]。

