基于MALDI-TOF MS技术子宫内膜癌血清学诊断模型的建立及验证
吴艳花 ,孙克娜 ,刘晓斐 ,王佳
中国人民解放军联勤保障部队第九六〇医院 a.检验科;b.卫勤部;山东 济南 250031
[关键字] 基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS);子宫内膜癌;诊断模型;肿瘤标记物
子宫内膜癌(endometrial carcinoma,EC)是发生于子宫的恶性上皮性肿瘤,是女性生殖系统最常见的恶性肿瘤之一。近年来,国内外EC的发病率不断升高,并有年轻化的趋势[1]。EC早期症状多无特异性,常表现为不规则阴道出血和排液等。EC晚期多存在腹膜后淋巴结转移,治疗效果及预后欠佳,但Ⅰ期低危型EC患者术后5年存活率可高达80%~93%[2],因此早诊断、早治疗对提高EC治愈率降低死亡率有重大意义。临床上EC的早期诊断主要依赖经阴道B超、诊断性刮宫和宫腔镜下组织活检等有创检查,血清学标志物CA125和HE4诊断EC的特异性不高,目前尚缺乏敏感性、特异性的血液学评价指标。
基质辅助激光解吸电离飞行时间质谱(ma⁃trix-assisted laserdesorption/ionization time-offlight mass spectrometry,MALDI-TOF MS)是一种高通量、高灵敏度及高特异性的新型软电离生物质谱分析技术,操作简便方便无创,可广泛应用于基因突变检测、基因多态性研究、微生物鉴定、肿瘤生物学标志物检测等方面。弱阳离子交换磁珠(weak cation-exchange chromatography mag⁃netic beads,MB-WCX)对血清中低丰度蛋白有较好的富集能力,我们拟通过MB-WCX联合MAL⁃DI-TOF MS技术,检测EC患者血清和子宫内膜良性病变患者血清中的蛋白表达、分析差异蛋白,筛选出EC患者和子宫良性病变血清中差异表达的蛋白质/肽,建立EC诊断预测模型,以期为EC的早期筛查及辅助诊断提供新的实验依据。
1 资料与方法
1.1 一般资料
收集2019年6月至2020年6月就诊于解放军第九六〇医院的EC患者血清标本53例,年龄54.96±9.01岁,中位年龄55岁;病理类型腺癌51例,腺癌伴鳞状上皮化生2例;根据子宫内膜癌国际妇产科联盟分期(2009)标准,ⅠA期24例(肌层浸润<1/2),ⅠB期15例(肌层浸润≥1/2),Ⅱ/Ⅲ期8例(浸润宫颈间质)。高/中分化43例,低分化8例。患者均经术后病理初次确诊为子宫内膜癌,未经过放化疗及抗癌药物治疗,无其他肿瘤等恶性病史。收集同期就诊的子宫内膜良性病变患者(非典型增生、单纯增生、息肉)血清标本37例,年龄47.41±10.32岁,中位年龄50岁;其中子宫内膜非典型增生患者19例、子宫内膜单纯增生患者10例、子宫内膜息肉患者8例。所有标本均在患者入院后接受手术、治疗前收集;所有入组者均排除子宫之外其他部位肿瘤、严重出血、急性或慢性感染、自身免疫性疾病病史。
1.2 血清蛋白的提取
采集晨起空腹静脉血4 mL,分离血清,-80℃保存。实验前将冻存的标本逐步复融(-20℃放置8 h,4℃直至标本融化)。采用Bruker公司MBWCX试剂盒提取蛋白质/多肽。为保证结果的一致性,所有标本同时复融,同时进行蛋白提取。
1.3 MALDI-TOF MS检测
取1 μL提取的蛋白样品点样于AnchorChip靶板上,干燥后取1 μL新鲜配置的基质(6 mg HCCA,50% CAN,2% TFA)点于样品点上,室温干燥后上机。应用FlexControl软件检测,检测灵敏度 5,优化范围 m/z为 1000~10 000 Da,激光强度为70%,每个样品点累积轰击100×10次。所有标本均进行复孔点样。
1.4 统计学分析
数据分析采用ClinProTools 3.0和FlexAnalysis软件。经基线去除、平滑、归一化等处理,剔除小于1000 Da的峰,以排除基质峰干扰。对信噪比(S/N)>5的峰做统计分析,计算2组中差异蛋白的平均峰下面积和平均峰值强度。差异蛋白的统计分析采用遗传算法(GA),选择差异最显著的2个峰分别为x、y轴做聚类分析和ROC曲线分析,建立诊断模型。将所有标本按2∶1随机分组,训练组60例(EC患者35例,良性病变25例),验证组30例(EC患者18例,良性病变12例);用训练组建立诊断模型,用验证组验证诊断模型的敏感性、特异性及诊断效率。
2 结果
2.1 2组血清蛋白质图谱比较分析
ClinProTools软件分析发现2组指纹图谱峰值强度存在明显差异,分析范围为1000~10 000 Da,共得到124个差异峰,具有统计学差异的蛋白峰47个(P<0.05),联合ROC曲线分析筛选出AUC>0.80的差异峰14个,差异表达情况见表1。其中EC组表达上调的蛋白有7个,m/z分别为2482.62、2661.8、2863.7、2953.39、3242.22、5906.2、6091.35 Da;EC组表达下调的蛋白有7个,m/z分别为 1692.5、1779.63、1866.76、2211.14、7924.86、8142.99、9433.76 Da。m/z为 1779.63和 1866.76 Da的2个蛋白峰差异性最显著(图1),ROC曲线分析 AUC分别为 0.935和0.969,且EC组m/z 1779.63和1866.76 Da的平均峰下面积明显低于良性病变组(图2)。
2.2 EC诊断模型的建立及验证
ClinProTools软件分析数据,用训练组(60例)指纹图谱建立GA模型。分别以m/z 1779.63和1866.76 Da为x、y轴进行聚类分析,结果显示2组血清标本基本无交叉,可显著区分EC患者和良性疾患者,交叉验证能力为93.77%,识别能力为96.43%。将验证组(30例)指纹图谱导入诊断模型进行验证,结果显示验证组中18例EC患者正确判断16例(图3A),验证组中12例良性病变患者正确判断11例(图3B),则该诊断模型的敏感性88.89%,特异性为91.67%,诊断效率为90%。
3 讨论
目前EC的诊断主要依赖于影像学和组织病理学。经阴道超声检测方便、无创,是EC早期筛查、诊断的首选方法,但诊断的灵敏度和特异性易受子宫内膜厚度的影响。据报道,阴道超声检测EC及其癌前病变的灵敏度/特异度分别为87.5%/80.1%[3]。诊断性刮宫术是诊治子宫内膜异常的经典术式,其诊断EC和非典型增生的灵敏度可达83.75%[4],但该操作为盲视操作,若遗漏病灶则耽误病情;此外其为有创性检查,患者疼痛负荷大,选用时须综合考虑。
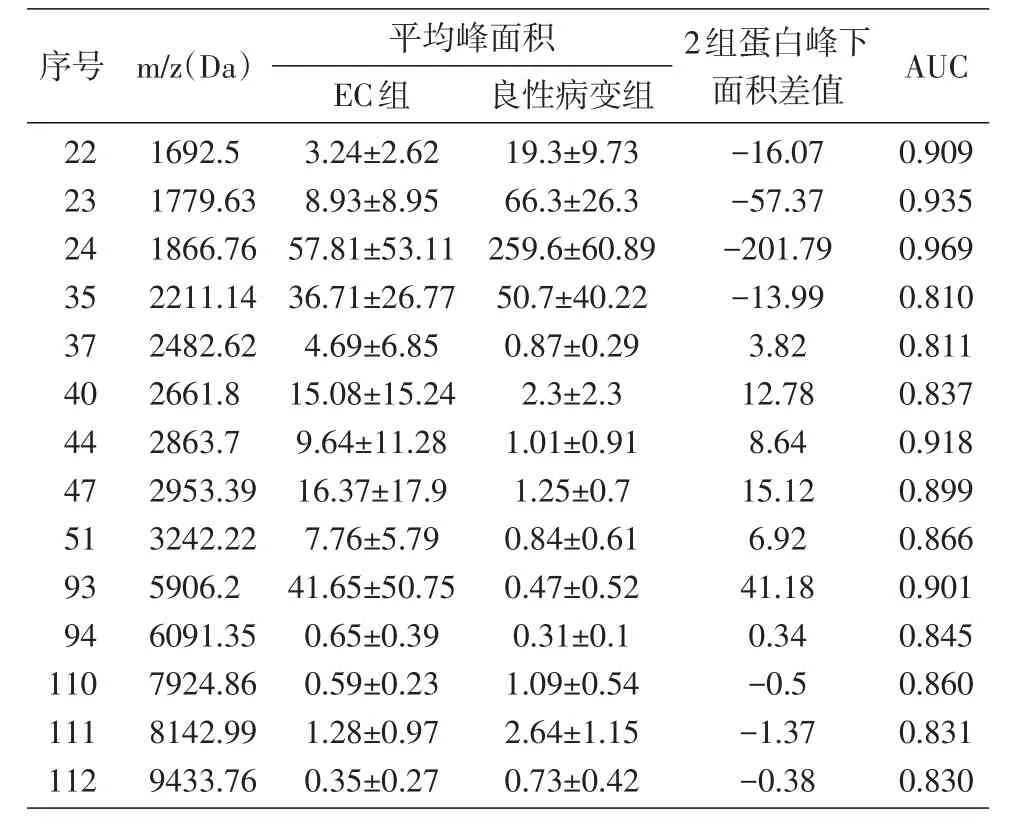
表1 EC组和良性病变组血清蛋白表达情况分析

图1 2组患者血清蛋白指纹图谱(峰值强度)
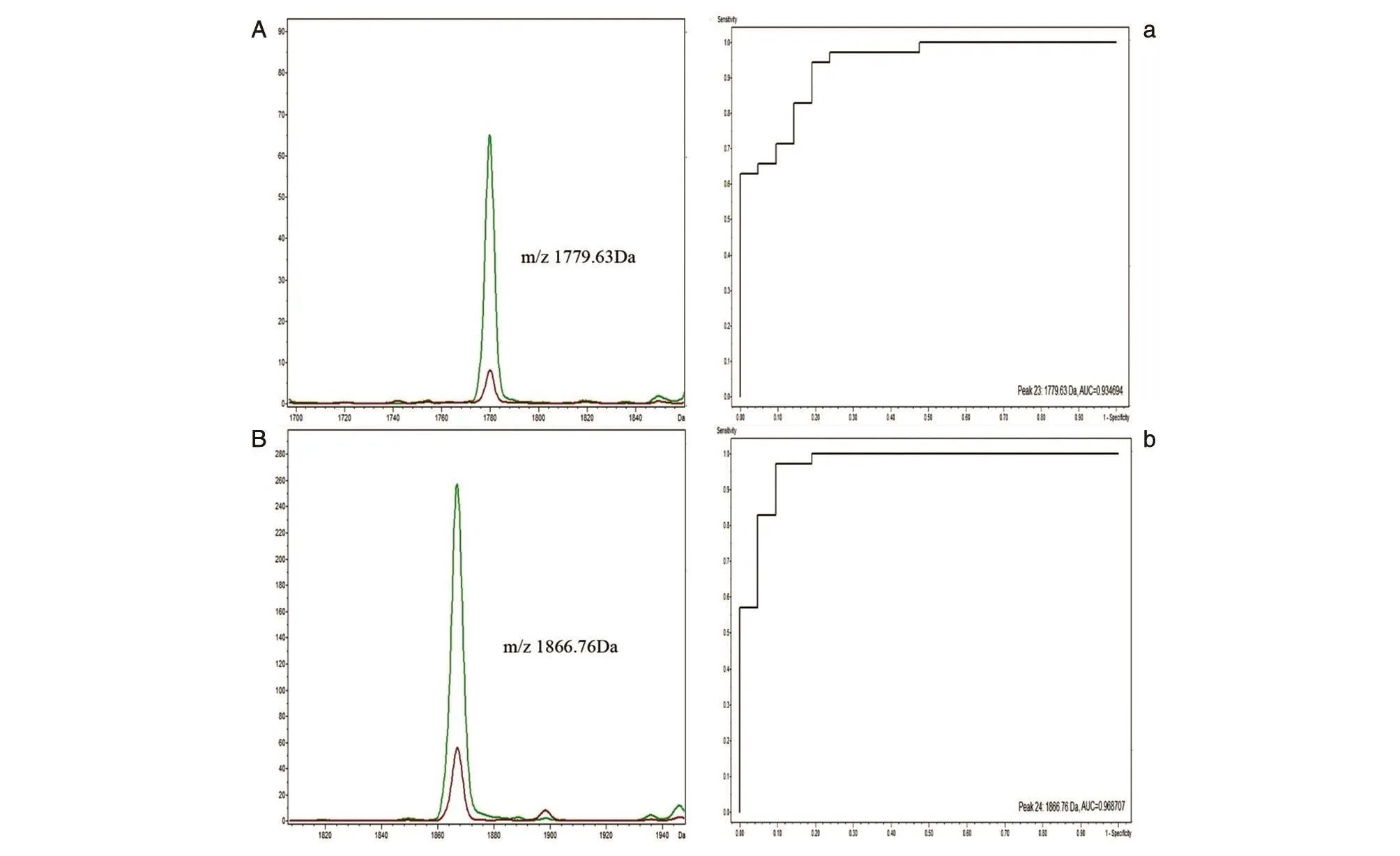
图2 差异蛋白峰下面积及ROC曲线
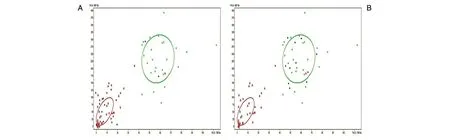
图3 GA诊断模型及验证结果
较为常用的妇科肿瘤标志物如CA125和HE4在诊断子宫内膜疾病方面并不具优势。Jiang等[5]发现CA125虽在EC患者血清中升高,但不能单独用于EC的诊断。可见目前EC的早期筛查、诊断仍然缺乏安全、有效、特异的方法。因此,寻找新的早期筛查诊断的血清学指标尤为迫切。
MALDI-TOF MS作为精准医学发展的先进技术,无须蛋白纯化,少量样本即可直接快速、高通量分析多种生物学信息,进行潜在标志物的筛选、鉴定,已广泛用于卵巢癌[6]、肝癌[7]、肺癌[8]、脑肿瘤[9]等多种肿瘤标志物的筛选和鉴定。MBWCX表面积大,吸附能力强,可以选择性富集、纯化低丰度蛋白和多肽,与MALDI-TOF-MS技术联合应用,为筛选高敏感性、特异性的潜在血清学标志物提供了一个新技术平台。
本研究应用MB-WCX对EC患者和良性病变血清中低丰度蛋白进行富集,然后通过MALDITOF MS技术筛选出m/z为1779.63和1886.76 Da的2种显著差异蛋白,ROC曲线分析发现2种蛋白在诊断EC和子宫内膜良性疾病上价值较高,AUC分别为0.935和0.969。以这2种蛋白建立的诊断模型诊断EC和良性病变的敏感性和特异性分别可达88.89%和91.67%,诊断效率为90%。Dong等[10]在CA125和HE4联合诊断EC研究中指出,2种指标联合检测诊断EC的敏感性为73.2%,ROC曲线分析AUC为0.819。另外,Huang等[11]通过Meta分析发现,CA125和HE4联合应用诊断EC的敏感性和特异性分别为66%和92%,AUC为0.86。与之相比,本研究建立的诊断模型有较高的敏感性和诊断效率,提示该诊断模型可用于辅助诊断、鉴别诊断EC和子宫内膜不典型增生。
有研究表明,50%未经治疗的子宫内膜非典型增生患者将于10年内发展为EC[12]。因此,有学者推荐在具有EC高危因素的无症状人群中进行EC及癌前病变的早期筛查,但目前尚无特异的血清学筛查指标。本实验选取初诊的EC患者和子宫内膜良性病变患者进行研究,共筛选出14个显著差异表达的蛋白峰,与子宫内膜非典型增生患者相比EC患者血清中表达上调和下调的各有7个。其中m/z为1779.63和1886.76 Da的蛋白差异最为显著,有望成为EC及癌前病变早期筛查、鉴别诊断的潜在肿瘤标记物。
综上所述,本研究建立的EC血清学诊断模型有较高的敏感性和特异性,适用于具有EC高危因素的无症状人群及癌前病变的早期筛查和辅助诊断。筛选出的2个差异蛋白有望成为EC早期筛查、诊断的潜在肿瘤标记物。但差异蛋白尚须通过液相串联质谱技术进一步鉴定,以明确其生物学特性及在EC发病中的作用机制。本实验由于样本量有限,结果可能存在偏倚。后续研究中将进一步扩大样本量,细化分组,并结合临床病理特征进行深入分析。

