沉默细胞分裂相关基因NUF2的表达对卵巢癌细胞侵袭及迁移的影响
任梦,赵晓婷,岳文涛
首都医科大学附属北京妇产医院 中心实验室,北京 100026
卵巢癌是女性生殖系统疾病中最致命的恶性肿瘤,在所有女性恶性肿瘤中其死亡率排名第五[1]。当前,卵巢癌的标准治疗方法是手术联合化疗,但仍有70%的卵巢癌患者最终复发并伴有严重的远处转移[2]。因此,深入研究卵巢癌发生、发展和转移的潜在机制极其重要。NUF2基因在细胞有丝分裂过程中通过调节着丝粒与纺锤体微管的结合,参与调控细胞增殖和凋亡[3]。研究表明,NUF2异常表达于乳腺癌、肺癌、胃癌、结肠癌、肝癌、前列腺癌和口腔癌等多种恶性肿瘤中,与肿瘤进展和侵袭转移密切相关[4-10]。但NUF2在卵巢癌中的研究较少,尤其是在卵巢癌侵袭转移方面未见相关研究报道。本研究旨在探讨NUF2对卵巢癌细胞侵袭、迁移的影响及其分子作用机制,以期为卵巢癌的治疗提供新的突破点。
1 材料与方法
1.1 材料
卵巢癌CAOV3、HEY和SKOV3细胞购于国家生物医学实验细胞资源库,人正常卵巢上皮细胞HOSEpiC为复旦大学附属妇产科医院徐从剑教授馈赠;胎牛血清、细胞培养液RPMI-1640、青霉素和链霉素购于Gibco公司;无义siRNA(control siRNA)和NUF2 siRNA购于广州市锐博生物科技有限公司;RNAiMAX转染试剂购于英潍捷基(上海)贸易有限公司;NUF2和GAPDH引物由英潍捷基(上海)贸易有限公司设计;逆转录试剂盒购于北京全式金生物有限公司;NUF2、GAPDH抗体购于Abcam公司;Notch1、Hes1抗体购于Cell Signal⁃ing Technology公司;辣根过氧化物酶标记的山羊抗兔二抗购于北京谊诚盛盈生物科技有限公司;Transwell小室购于Corning公司。
1.2 细胞培养
HOSEpiC、CAOV3、HEY、SKOV3细胞系用添加10%胎牛血清和1%青霉素/链霉素的RPMI-1640培养基,于37℃、含5% CO2的培养箱中培养。
1.3 siRNA转染及分组
广州市锐博生物科技有限公司设计了3种NUF2-靶标特异性siRNA(si-NUF2)用于下调NUF2的表达,分别为siRNA1(5'-GGAGAGACUU GAUUCUGUUTT-3')、siRNA2(5'-GCCUUCAUGU CAGUUGGAATT-3')和 siRNA3(5'-GGACCAAAU UGAGAGUGAUTT-3'),control siRNA(si-control)序列为5'-UUCUCCGAACGUGUCAGGUTTUCCAG GTCUAGTT-3'。在6孔板上以2×105/孔接种HEY、SKOV3细胞,用LipofectAMINE RNAiMAX将si-control和si-NUF2分别转染细胞。将实验分为si-control组和si-NUF2组,未做任何处理细胞为空白对照组(control组)。转染48 h后,通过qRTPCR和Western印迹验证转染效率。
1.4 RNA提取及实时荧光定量PCR
用TRIzol试剂提取细胞RNA,NanoDrop1000分光光度计测定RNA的浓度和纯度。用逆转录试剂盒合成cDNA第一链,采用SYBR Premix EX Taq,ABI7500实时PCR系统进行实时PCR分析,GAPDH为内参,NUF2 mRNA的表达水平通过2-ΔΔCt方法计算。NUF2 上游引物为 5'-ACAAGTC GGTTTTTAAGTGGCA-3',下游引物为5'-GCATT TTGTCCGCAGAGGATTT-3';GAPDH 上游引物为5'-TGACTTCAACAGCGACACCCA-3',下游引物为5'-CACCCTGTTGCTGTAGCCAAA-3'。每组样品设置3个重复。
1.5 蛋白印迹法
收集各组处理后的卵巢癌SKOV3细胞,加入RIPA裂解液,置于冰上裂解30 min,12 000 r/min离心10 min,取上清,BCA蛋白定量法测定蛋白质浓度。取30 μg蛋白进行SDS-PAGE,电泳毕,将蛋白转移到硝酸纤维素膜上,用5%脱脂牛奶室温封闭1 h,将膜与一抗NUF2(1∶500)、Notch1(1∶500)、Hes1(1∶500)和 GAPDH(1∶1000)置于4℃孵育过夜。TBST洗涤膜之后,将膜与辣根过氧化物酶标记的二抗(1∶7500)室温孵育2 h。通过化学发光成像系统检测条带。所有实验至少重复3遍。
1.6 细胞侵袭迁移实验
Transwell小室用于细胞侵袭迁移能力测定。对于细胞侵袭能力测定,用0.2% BSA稀释基质胶(1∶4)后,取 50 μL 铺于 Transwell小室上室,37℃孵育1 h,将1.2×105细胞接种到含100 μL无血清RPMI-1640培养基的Transwell小室上室中,下室加入含20% FBS的RPMI-1640培养基,放入培养箱中培养24 h,用0.1%的结晶紫染液对小室下表面细胞进行染色,光学显微镜下观察并拍摄5个视野的细胞图片,用Image J图像软件计数侵袭细胞数。对于细胞迁移能力测定,将2×104细胞接种到无基质胶的Transwell小室上室,其他步骤与Transwell小室侵袭测定相同。
1.7 细胞划痕实验
将细胞接种于6孔板,用control siRNA或si-NUF2转染细胞,用100 μL枪头在细胞层垂直划痕。加入PBS清除划痕后脱落的细胞,将培养基替换为无血清培养基,用Image J图像软件量化各组细胞划痕间隙距离,之后每24 h拍照,监测细胞迁移情况,测量划痕间的距离,计算细胞划痕愈合率。细胞划痕愈合率=[划痕间隙距离(24、48、72 h)-划痕间隙距离(0 h)]/划痕间隙距离(0 h)×100%。实验重复3次。
2 结果
2.1 NUF2在卵巢癌组织和卵巢癌细胞系中的表达
为了探讨NUF2在卵巢癌中的表达,我们从GEPIA数据库获得426个卵巢癌组织和88个癌旁组织中NUF2的表达数据。结果如图1A,卵巢癌组织中NUF2的表达水平明显高于癌旁组织(P<0.05),差异具有统计学意义。此外,通过qRTPCR检测了NUF2在人卵巢癌细胞系(CAOV3、HEY、SKOV3)和人正常卵巢上皮细胞(HOSEpiC)中的表达,结果如图1B,与HOSEpiC细胞相比,人卵巢癌细胞系CAOV3、SKOV3和HEY中NUF2 mRNA表达水平显著升高(P<0.05),差异具有统计学意义。这些数据表明,NUF2在卵巢癌组织和卵巢癌细胞系中的表达增加。
2.2 转染siRNA后细胞中NUF2的表达
为了探讨NUF2对卵巢癌细胞侵袭、迁移的影响,用siRNA沉默SKOV3、HEY细胞中NUF2的表达,结果见图2,转染48 h后,HEY、SKOV3细胞中NUF2 mRNA相对表达水平明显低于si-con⁃trol组和 control组(P<0.05),差异具有统计学意义,表明si-NUF2能够显著沉默NUF2的表达。
2.3 转染siRNA后对细胞侵袭能力的影响
Transwell小室侵袭迁移实验结果显示,在HEY细胞中(图3A),si-NUF2转染组穿过有基质胶小室的细胞数为50.20±6.31,较si-control组(121.40±9.85)和 control组(131.40±9.85)明显减少,差异有统计学意义(P<0.05);穿过无基质胶小室的细胞数为60.20±5.31,较si-control组(110.40±4.85)和 control组(111.40±6.85)明显减少,差异有统计学意义(P<0.05)。在SKOV3细胞中可得到类似结果(图3B)。这就提示抑制NUF2表达可抑制卵巢癌细胞的侵袭、迁移能力。
2.4 转染siRNA后对细胞迁移能力的影响

图1 NUF2在卵巢癌组织和细胞中的表达水平

图2 qRT-PCR检测si-NUF2对NUF2 mRNA表达水平的影响
HEY细胞划痕实验结果如图4A,与si-control组和control组比较,转染si-NUF2组的细胞迁移能力显著降低,其划痕愈合率为si-control组的0.47±0.04倍,差异有统计学意义(P<0.05)。SKOV3细胞中得到类似结果(图4B)。
2.5 沉默NUF2表达抑制Notch信号通路

图3 Transwell小室实验检测NUF2沉默对细胞侵袭、迁移能力的影响

图4 划痕实验检测NUF2沉默对细胞迁移能力的影响
Notch信号通路与肿瘤侵袭迁移等生物学行为密切相关,为了探究NUF2对卵巢癌细胞侵袭、迁移的影响机制,通过GEPIA对NUF2和Notch信号通路相关分子间的表达相关性进行分析,如图5A所示,NUF2与Notch1、Hes1间表达呈正相关的关系。采用Western印迹实验进一步验证抑制NUF2表达后,Notch信号通路相关分子的表达情况。结果见图5B,沉默NUF2表达后,Notch1和Hes1蛋白表达水平与si-control组和control组相比明显降低,差异具有统计学意义(P<0.05)。以上实验说明NUF2通过异常激活Notch信号通路促进卵巢癌细胞侵袭、迁移。
3 讨论
卵巢癌患者低生存率和不良预后的主要原因是由于卵巢癌细胞发生侵袭和迁移。因此,深入探索卵巢癌侵袭和迁移机制是当前卵巢癌临床研究的热点。
细胞分裂周期相关蛋白家族是维持正常细胞功能所必需的,其异常表达能够促进肿瘤的发生,在调控肿瘤细胞发生发展和侵袭转移等方面发挥重要作用[11]。NUF2作为细胞分裂周期相关蛋白家族中的重要成员,在细胞有丝分裂过程中对于动粒-微管的正确附着和染色体的正常分离起重要作用,而染色体的错误分离会导致基因不稳定性,最终诱发肿瘤[12]。郭云韬等[13]利用siRNA干扰技术抑制人肝癌HCCLM3细胞中NUF2的表达,通过划痕实验和Transwell小室侵袭实验发现细胞的迁移和侵袭能力显著下降。Wong等[14]发现胰腺导管腺癌细胞中circFOKX2、YBX1和hnRNPK相互作用能够增强NUF2和PDXK的表达,敲低circFOXK2引起NUF2表达降低,癌细胞生长、迁移和侵袭能力受到抑制。为了进一步研究NUF2在卵巢癌细胞侵袭、迁移中的作用,本研究首先验证了卵巢癌组织和卵巢癌细胞系中NUF2的表达情况,发现与癌旁组织及正常卵巢上皮细胞相比,NUF2在卵巢癌组织和卵巢癌细胞中的表达均明显升高。通过NUF2 siRNA干扰卵巢癌HEY、SKOV3细胞中NUF2的表达后,Tran⁃swell小室侵袭迁移实验显示si-NUF2组穿过小室的细胞数显著少于si-control组和control组,表明沉默NUF2可抑制卵巢癌细胞侵袭、迁移能力。细胞划痕实验结果显示si-NUF2组细胞划痕愈合率明显低于si-control组和control组。这就表明NUF2在卵巢癌中的高表达与肿瘤细胞侵袭、迁移密切相关。
研究证实Notch信号通路广泛存在于不同物种中,是一个高度保守的信号通路,参与调控细胞增殖、分化等行为。Notch信号通路在卵巢癌、结肠癌、肝癌等多种肿瘤中呈异常激活状态,在肿瘤细胞的侵袭迁移过程中发挥至关重要的作用[15-16]。Notch信号通路的经典激活方式是Notch配体结合Notch受体,使受体水解释放Notch胞内域,Notch胞内域进入细胞核作用于靶基因(如HES1、HES3 和 HES5),诱发相关生物学效应[17]。Notch1是Notch信号通路中的关键分子,Hes1是Notch信号通路的下游基因。Liu等[18]的研究表明,在小细胞食管癌中,NUF2与Notch信号通路密切相关,可能参与肿瘤的进展。本研究通过GEPIA数据库分析发现NUF2与Notch信号通路相关分子间表达呈正相关,Western印迹检测显示沉默NUF2表达后,与control组和si-control组相比,si-NUF2组Notch1、Hes1的表达明显降低,表明抑制NUF2表达后能够抑制卵巢癌细胞Notch通路的激活,从而降低癌细胞的侵袭迁移能力。
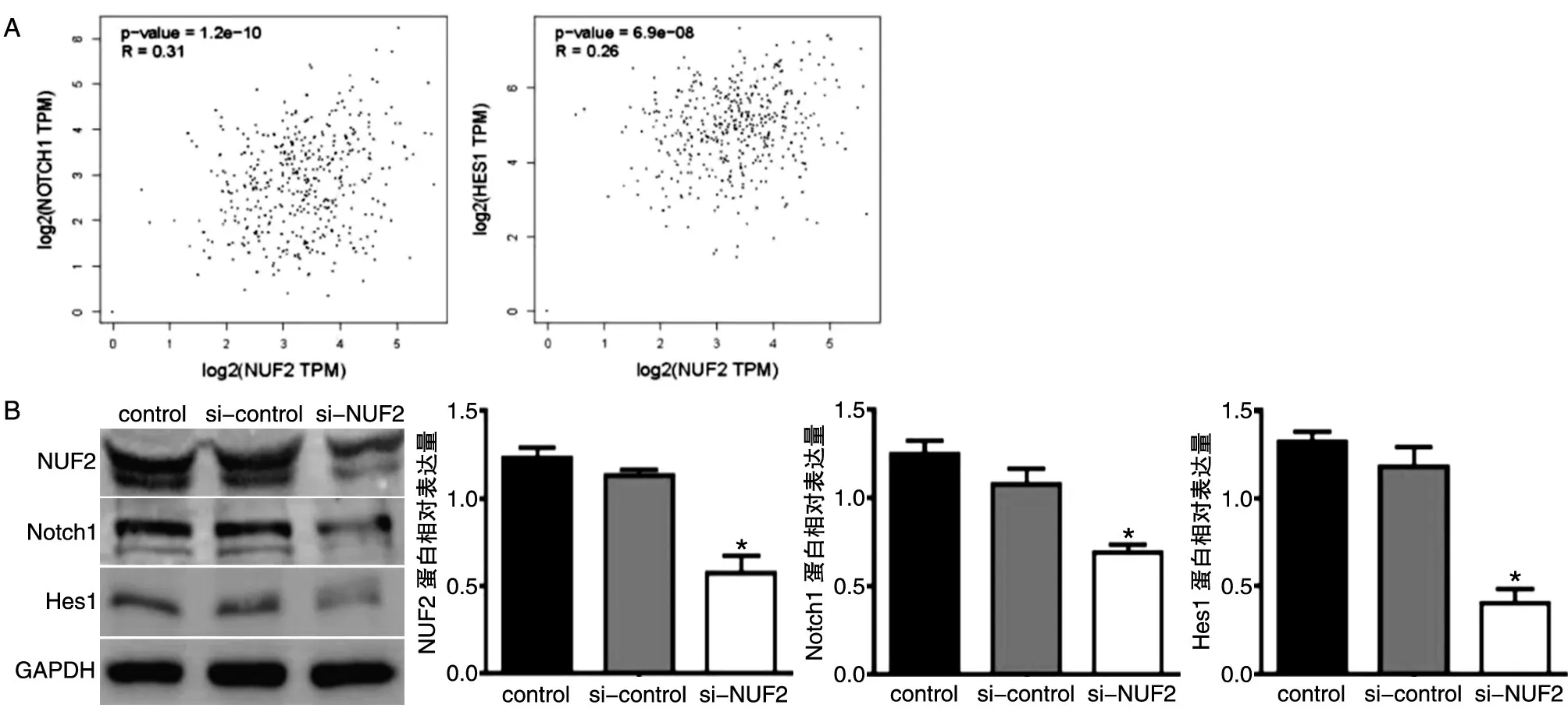
图5 Western印迹检测NUF2沉默对Notch通路相关分子的影响
综上所述,沉默NUF2表达可抑制卵巢癌细胞侵袭和迁移,其机制可能与下调Notch信号通路相关蛋白的表达有关。这就提示NUF2能够参与卵巢癌细胞侵袭、迁移过程,为卵巢癌的治疗提供了新方向。但是NUF2如何与靶蛋白相互作用从而促进肿瘤的发生发展,仍须进一步探索。

