miR-146a调控PI3K/Akt信号通路促进心力衰竭大鼠心肌细胞凋亡
程璐 ,时学昆 ,张超 ,姜少燕 ,蒋琪
青岛大学 附属心血管病医院 a.老年心血管病科;b.介入科;山东 青岛 266000
慢性心力衰竭(chronic heart failure,CHF)简称心衰,是心血管等心脏疾病发展的终末阶段,因心肌梗死、炎症、血流动力学负荷过重等引起心肌损伤,造成心室重构,导致心脏收缩功能异常,使心室泵血及充盈功能下降,无法将静脉回流的血液排出心脏,并造成动脉血液供应不足,进而引发心衰[1-3]。miR-146a是近年发现的一种非编码的微小RNA(miRNA),据Fabiola等[4]报道,miR-146a在心衰患者的血管内皮细胞中呈高表达状态,但miR-146a在心力衰竭中的具体作用机制尚未明确。在此,我们使用miR-146a抑制剂腺病毒转染心力衰竭大鼠,观察对心力衰竭大鼠的影响,并探讨其可能机制。
1 材料和方法
1 材料
8周龄雄性SPF级SD大鼠,体重290~310 g,购自北京维通利华实验动物技术公司[许可证号:SCXK(京)2012-0001]。
miR-146a抑制剂腺病毒及阴性对照(未携带miR-146a抑制剂腺病毒)购自深圳百恩维生物科技有限公司;HE染液、分化液、返蓝液购自Ser⁃vicebio公司;TUNEL试剂盒购自Roche公司;Taq Man Universal PCR Mix、TaqMan microRNA As⁃say、Power SYBR green PCR master mix购自大连宝生物公司;逆转录试剂购自Promega公司;Cleaved caspase-3、Cleaved caspase-9、PI3K、p-PI3K、Akt、p-Akt抗体购自 Santa Cruz公司;GAP⁃DH抗体购自广州瑞博奥生物科技有限公司;BCA试剂盒购自Thermo公司;RIPA裂解液购自碧云天公司;SDS-PAGE电泳液购自上海信裕生物技术有限公司。
植入型动物起搏器购自上海复旦大学电子工程系;多道生理信号采集处理系统购自成都仪器厂;呼吸机购自成都泰盟科技公司;超声诊断仪购自西门子公司;脱水机、包埋机购自武汉俊杰电子有限公司;病理切片机购自上海徕卡仪器有限公司;光学显微镜、成像系统购自尼康公司;离心机购自Heraeus公司;电泳仪、转膜仪/稳压电源购自Bio-rad公司;荧光定量PCR仪购自ABI公司;紫外分光光度计、酶标仪、超低温冰箱等购自Thermo公司。
1.2 心力衰竭大鼠模型制备
参考文献[5]建立心力衰竭大鼠模型。大鼠固定于手术台,腹部及胸腔手术部位剃毛并消毒后进行麻醉,常规无菌操作,腹部正中行3 cm切口,将起搏器固定于腹腔内壁上,并逐层缝合腹部切口。将导线引至胸骨左缘第5肋间处,气管插管并进行机械辅助通气,于胸骨左缘第5肋间处行开胸术,暴露心脏后将心包撕开,将导线固定于右心室心尖部,用庆大霉素注射液冲洗胸腔后分层缝合胸腔,待大鼠恢复呼吸后拔出气管插管并缝合颈部切口。术后应用7 d抗生素防止感染,常规饲养。术后7 d以550/min起搏频率持续起搏4周,其中6只大鼠不进行起搏处理,观察大鼠的行为表现及体征。起搏后期大鼠的心率加快、心腔扩大、心脏体积增大、心室壁变薄、心脏重量增加,且活动量减少、毛色干枯、饮食量减少、睡眠增加,判定心力衰竭大鼠造模成功。
1.3 实验分组
将6只不进行起搏处理的大鼠作为假手术组(A组),将心力衰竭造模成功的大鼠随机分为模型组(B组)、miR-146a抑制剂组(C组)、未携带miR-146a抑制剂腺病毒组(D组),每组6只。向C组大鼠左心腔内注射1×1012μg/mL携带miR-146a抑制剂腺病毒200 μL,夹闭主动脉10 s,使病毒经冠状动脉均匀转染至大鼠的心肌组织,其余操作同1.2,详细步骤参考文献[6]。D组大鼠注射未携带miR-146a抑制剂的腺病毒200 μL。处理7 d后麻醉并处死观察。
1.4 qRT-PCR测定心力衰竭大鼠心肌中miR-146a表达水平
处死大鼠,取出心脏,用0.9%的氯化钠注射液清洗后于-80℃冰箱中保存。取左心室心肌组织,滴加TRIzol溶液后进行研磨,待细胞充分裂解后加入氯仿提取总RNA,逆转录合成cDNA。以GAPDH为内参,特异性扩增cDNA。miR-146a上游引物为5'-TGAGAACTGAATTCCATGGGTT-3',下游引物为5'-ATCTACTCTCTCCAGGTCCTCA-3';GAPDH上游引物为5'-GAGGACCAGGTTGTCTCC TG-3',下游引物为5'-GGATGGAATTGTGAGGGA GA-3'。PCR 反应条件:95℃预变性30 s;95℃ 5 s,60℃ 30 min,40 个循环。用 2-ΔΔCt方法进行数据整理。详细步骤参考文献[6]。
1.5 心脏超声心动图测定大鼠心功能
停止起搏后用小动物超声成像系统测定心力衰竭大鼠的左心室射血分数(left ventricular ejection fraction,LVEF)和左心室短轴缩短率(left ventricular fractional shortening,LVFS),取连续3个心动周期的平均值并记录。
1.6 HE染色观察心力衰竭大鼠心肌的病理学改变
石蜡切片常规脱蜡至水,切片入苏木精染液染3~5 min,分化液分化,冲洗,返蓝液返蓝,冲洗,酒精脱水后伊红染液中染色5 min,无水乙醇脱水,中性树胶封片后进行图像采集。细胞核呈蓝色,细胞质呈红色。
1.7 TUNEL法测定心力衰竭大鼠心肌细胞凋亡
采用荧光TUNEL法测定心力衰竭大鼠左心室游离壁的组织心肌细胞凋亡。进行石蜡包埋,用TUNEL试剂盒进行脱蜡、水合,待细胞通透后加入TdT和dUTP,DAPI复染后加入抗荧光淬灭剂,封片。经荧光染色后凋亡的细胞在荧光显微镜下呈绿色,蓝色为正常细胞,每张切片寻找5个视野,记录其平均值。凋亡率(%)=×凋亡细胞数/(凋亡细胞数+正常细胞数)×100%。
1.8 Western印迹检测心力衰竭大鼠心肌组织PI3K、p-PI3K、Akt、p-Akt、Cleaved caspase-3 和Cleaved caspase-9的表达
用含有蛋白酶抑制剂的裂解液将心肌组织于4℃裂解1 h,提取心肌组织总蛋白并测定其浓度,SDS-PAGE后转至PVDF膜,丽春红染色后温室封闭60 min,加入一抗,温室孵育1 h,回收一抗并用TPBS漂洗,加入二抗,温室孵育1 h,回收二抗后漂洗,加入ECL发光试剂检测,曝光后拍照,用Image J软件分析。详细步骤参考文献[6]。
1.9 统计学检验
应用SPSS19.0软件进行统计分析,数据用x±s表示,2组间比较使用独立t检验,P<0.05为差异有统计学意义。
2 结果
2.1 心力衰竭大鼠心肌组织中miR-146a的表达水平
与A组比较,B组大鼠心肌组织中miR-146a的表达水平明显上调(P<0.05);C组大鼠心肌组织中miR-146a的表达水平明显较B组下调(P<0.05)。说明miR-164a在心力衰竭大鼠心肌中呈高表达状态,且携带miR-164a抑制剂的腺病毒已转染至心力衰竭大鼠的心肌组织(图1)。
2.2 miR-164a对心力衰竭大鼠大鼠心功能的影响

图1 心力衰竭大鼠心肌组织miR-146a的表达水平
与A组比较,B、C组大鼠LVEF、LVFS明显下降(P<0.05);C组大鼠LVEF、LVFS明显较B组上升(P<0.05),说明miR-164a抑制剂可明显改善心力衰竭大鼠的心功能(表1)。
2.3 心力衰竭大鼠心脏病理组织学改变
HE染色结果显示,A组大鼠心室前壁心肌细胞排列正常,轮廓清晰,且心肌细胞形态正常,无明显病理改变;B组大鼠心室前壁心肌细胞排列杂乱,心肌细胞水肿,周围有炎性细胞浸润,甚至出现质间充血、心肌纤维排列紊乱等,细胞核出现固缩或碎裂,坏死心肌出现纤维肉芽增生,纤维化程度明显,与D组相似;C组大鼠心肌纤维排列紊乱程度较轻,细胞形态明显较B组好,仅出现少量炎症细胞浸润,纤维组织也明显较B组少(图2)。
2.4 miR-146a对心力衰竭大鼠心肌细胞凋亡的影响
TUNEL染色结果显示,A、B、C、D组大鼠心肌细胞凋亡率分别为2.33%±0.98%、42.37%±6.10%、11.90%±1.90%、40.80%±6.29%,C组心力衰竭大鼠心肌细胞的凋亡率明显较A组高(P<0.05),较B组低(P<0.05)。说明心力衰竭大鼠心肌细胞出现明显的凋亡,而miR-146a抑制剂可抑制心力衰竭大鼠心肌细胞的凋亡(图3)。
2.5 miR-146a对心力衰竭大鼠心肌细胞凋亡相关蛋白Cleaved caspase-3和Cleaved caspase-9表达的影响
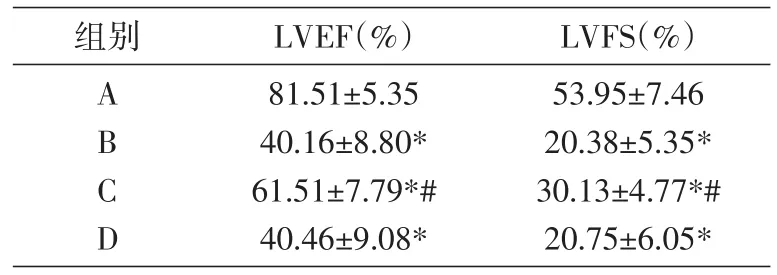
表1 miR-146a对心力衰竭大鼠大鼠心功能的影响

图2 心力衰竭大鼠心脏病理组织学改变(HE染色,×100)
Western印迹结果(图4)显示,C组大鼠心肌细胞Cleaved caspase-3、Cleaved caspase-9蛋白的表达水平明显较B组下调(P<0.05),但仍然较A组上调(P<0.05)。说明心力衰竭大鼠心肌细胞Cleaved caspase-3、Cleaved caspase-9表达明显上调,而miR-146a抑制剂能明显下调心力衰竭大鼠心肌细胞Cleaved caspase-3、Cleaved caspase-9的表达。表明抑制miR-146a可抑制心力衰竭大鼠心肌细胞凋亡。
2.6 miR-146a对心力衰竭大鼠PI3K/Akt信号通路的影响
Western印迹结果(图5)显示,3组大鼠心肌细胞中PI3K、Akt蛋白的表达水平无明显差异(P>0.05),但C组大鼠PI3K、Akt蛋白的磷酸化水平明显较B组高(P<0.05)、较A组低(P<0.05)。说明miR-146a抑制剂可明显激活PI3K/Akt信号通路。
3 讨论

图3 miR-146a对心力衰竭大鼠心肌细胞凋亡的影响

图4 miR-146a对心力衰竭大鼠Cleaved caspase-3和Cleaved caspase-9蛋白表达的影响
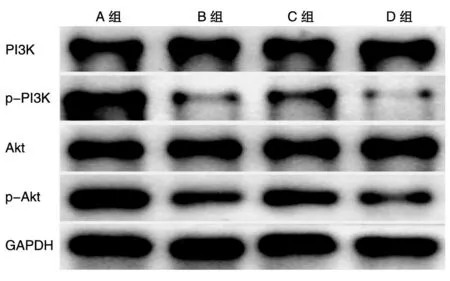
图5 miR-146a对心力衰竭大鼠PI3K、p-PI3K、Akt、p-Akt蛋白表达的影响
心脏收缩及舒张功能异常致使心脏排血无法满足机体需求,进而引发患者心力衰竭,是多数心血管疾病的终末表现,也是心血管疾病致死的主要原因,已逐渐得到医学界的重视[7]。近年来,大量研究发现miRNA在心力衰竭相关疾病的发展中有重要作用[8]。例如,miR-133及miR-30在肥厚心肌中的表达下降,导致调控纤维化过程的结缔组织生长因子(CTCF)表达升高,促进心肌纤维化[9];miR-133通过抑制Caspase的表达,发挥其抑制心肌细胞凋亡的作用[10];miR-21在缺氧心肌细胞中的表达明显上调,与心肌细胞的凋亡及再灌注损伤密切相关[11]。赵思嘉等[12]发现,miR-146a在自身免疫性心肌炎(EAM)大鼠心肌组织中的表达明显上升,而miR-146a agomirs(拮抗剂)可显著降低EAM大鼠心脏炎的症状,大鼠的心功能也得到明显改善。但目前关于miR-146a与心力衰竭的相关报道较少,本研究初步探索了miR-146a在心力衰竭大鼠心肌细胞中的表达及对心肌细胞的影响,并探讨了其可能机制。
冠状动脉结扎、心肌毒药、主动脉瓣撕裂等所致的心衰模型会导致模型动物出现缺血面积过大(或过小)、病死率过高;而右心室快速起搏建立的心力衰竭大鼠模型,病死率较小,且模型动物的血流动力学及病理改变与人类慢性心衰较相似[5],因此本研究使用右心室快速起搏建立心力衰竭大鼠模型。研究中共建立心力衰竭大鼠26只,其中3只死亡,5只用于解剖验证心力衰竭大鼠模型心室结构的改变。结果显示,心力衰竭模型组大鼠心肌组织中miR-146a呈高表达;心功能明显下降;心脏出现明显的病理性改变,心室前壁心肌细胞排列杂乱,有大量炎性细胞浸润,甚至出现质间充血,细胞核固缩或碎裂,纤维化程度明显;心肌细胞凋亡率增加;凋亡相关蛋白Cleaved caspase-3、Cleaved caspase-9的表达明显增加。表明心力衰竭大鼠模型建立成功。
心力衰竭建模成功的大鼠进行miRNA-146a抑制剂转染,转染miRNA-146a抑制剂的大鼠心肌组织中miR-146a显著下调,心功能明显较模型组好转,心肌纤维排列紊乱程度及细胞形态明显较模型组好,仅出现少量炎症细胞浸润,纤维组织也明显较模型组少,心肌细胞凋亡率明显较模型组下降,凋亡相关蛋白Cleaved caspase-3、Cleaved caspase-9的表达亦明显较模型组减少。提示miRNA-146a抑制剂转染成功,且miRNA-146a抑制剂可明显改善心力衰竭大鼠的心功能及心脏的病理结构,并抑制心肌细胞凋亡。
为了进一步研究心力衰竭大鼠中miRNA-146a的发病机制,本研究检测了PI3K、p-PI3K、Akt、p-Akt的表达。Western印迹显示,PI3K、Akt在假手术组、模型组及转染miRNA-146a抑制剂大鼠心肌组织中的表达无明显差异,但是转染miRNA-146a抑制剂大鼠的p-PI3K、p-Akt明显较模型组高。提示miRNA-146a可能通过抑制PI3K/Akt信号通路促进心力衰竭大鼠心肌细胞的凋亡。因为心力衰竭的主要特征之一就是心肌细胞的凋亡,且该过程受多种凋亡因子调控,可通过调控下游多种蛋白,参与细胞的生长、凋亡等过程,而PI3K/Akt是体内一条重要的抗凋亡促增殖的信号转导通路[13]。Zhang[14]等研究显示PI3K/Akt通路在机体受到心肌缺血再灌注损伤时被激活,磷酸化的PI3K、Akt会与下游多个靶点相互作用,抑制心肌细胞凋亡,发挥对心肌的保护作用,而上调该信号可明显减少心肌细胞的凋亡。大量研究[14-16]表明,miRNA可通过调控PI3K/Akt信号通路影响细胞的增殖与凋亡。
综上所述,心力衰竭大鼠心肌组织miR-146a表达明显上调。miR-146a可能通过激活PI3K/Akt信号通路发挥其促进心肌细胞凋亡的作用,促进疾病的发生与进展。

