lncRNA BLACAT1通过抑制miR-374b-5p促进非小细胞肺癌细胞增殖和转移
李明如,林贵湖,聂振凯,张凯华
中国航天科工集团七三一医院 胸外科,北京 100074
长链非编码RNA(long non-coding RNA,lncRNA)是一类长度大于200 nt不编码蛋白质的RNA,研究发现其在生物表观遗传调控过程中扮演重要角色[1]。癌症的许多基因突变存在于不编码蛋白质的区域内,lncRNA的异常表达与不同的癌症类型有关[2-4]。BLACAT1是一种lncRNA,最早发现在膀胱癌中高表达,与肿瘤的发生、发展、增殖及转移密切相关[5]。研究表明BLACAT1在非小细胞肺癌组织和细胞中高表达,并调节周期蛋白D1/CDKN2B轴抑制非小细胞肺癌细胞增殖[6]。BLACAT1也可以作为海绵吸附miRNA,从而影响miRNA的表达量及生物学功能。BLACAT1通过靶向miR-361促进ABCB1蛋白的表达,加速了胃癌对奥沙利铂的耐药,为胃癌的耐药研究提供了新的思路[7]。
在此,我们围绕BLACAT1的生物学功能,通过小干扰BLACAT1(si-BLACAT1)降低BLACAT1的表达量,研究对非小细胞肺癌细胞增殖和转移的影响;并且,通过软件预测BLACAT1相互作用的miRNA为miR-374b-5p;结合BLACAT1与miR-374b-5p探讨其对非小细胞肺癌细胞增殖和转移的影响。
1 材料与方法
1.1 材料
人非小细胞肺癌细胞A549、HCC827、NCIH1299、NCI-H23和正常肺上皮细胞BEAS-2B购自中国医学科学院基础医学研究所细胞资源中心;DMEM培养基、RPMI1640培养基和胎牛血清(FBS)购自Gibco公司;谷氨酰胺和100 mmol/L丙酮酸钠溶液购自Invitrogen公司;CCK-8细胞活力检测试剂盒购自日本东仁化学公司;Transwell购自 Corning Costar公司;si-BLACAT1、si-NC 和miR-374b-5p mimics(模拟物)购自上海吉玛制药技术有限公司;总RNA提取试剂盒、逆转录试剂盒和SYBR Green试剂盒购自北京全式金生物技术有限公司;实时荧光定量PCR(qRT-PCR)引物、LipofectAMINE 2000购自Invitrogen公司;MMP-2抗体、MMP-9抗体、E钙黏蛋白抗体、N钙黏蛋白抗体和二抗均购自Abcam公司。
1.2 肺癌中BLACAT1的组织表达分析
采用starBase泛癌症平台挖掘癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据,分析肺癌组织与癌旁组织中BLACAT1的表达差异。
1.3 细胞培养
人非小细胞肺癌细胞株A549和正常肺上皮细胞株BEAS-2B采用DMEM培养基与FBS体积比为9∶1的完全培养基培养;人非小细胞肺癌细胞 HCC827、NCI-H1299和 NCI-H23采用 RPMI 1640培养基、FBS、谷氨酰胺、100 mmol/L丙酮酸钠溶液的体积比为88∶10∶1∶1的完全培养基培养。所有细胞均在5% CO2、37℃培养箱中生长,选择对数生长期细胞进行后续实验。
1.4 RNA提取和逆转录
用总RNA提取试剂盒提取细胞RNA,Nano⁃Drop检测纯度;用逆转录试剂盒合成cDNA,-20℃保存备用。miR-374b-5p的逆转录引物为5'-GT CGTATCCAGTGCGTGTCGTGGAGTCGGCAATTGCA CTGGATACGACCACTTAG-3'。
1.5 qRT-PCR检测
采用SYBR Green染料法检测各细胞系中BLACAT1和miR-374b-5p的转录水平,qRT-PCR检测仪检测结果。根据NCBI官网公布的序列设计引物。BLACAT1正向引物为5'-ATCCCTGGA GGAAGTCGTCA-3',反向引物为5'-CCCACGAGG AAAACCCTTGA-3';miR-374b-5p正向引物为5'-ATATAATACAACCTG-3',反向引物为5'-TGAGG TGCTGTGCGTGAC-3';GAPDH正向引物为5'-GA AGGTGAAGGTCGGAGT-3',反向引物为5'-GAA GATGGTGATGGGATTTC-3';U6正向引物为5'-C TCGCTTCGGCAGCACA-3',反向引物为5'-AACG CTTCACGAATTTGCGT-3'。
1.6 细胞转染与细胞活力检测
将细胞以1×104/孔接种到6孔板中培养,当细胞覆盖度达50%~60%时,用LipofectAMINE 2000分组转染细胞,培养48 h后进行后续实验。将分组转染后的细胞按5×103/孔接种到96孔培养板中培养,待细胞覆盖率达80%~90%时弃去培养基,PBS洗3次,加入用不含血清培养基稀释的10% CCK-8反应液,将加入反应液的96孔板于37℃恒温培养箱中反应40 min,取出96孔板,放入酶标仪中检测D450nm值。
1.7 细胞迁移和侵袭检测
Transwell检测细胞迁移,LipofectAMINE 2000转染48 h后的细胞按5×104/孔置于上室中,继续培养24 h,4%多聚甲醛固定后DAPI染细胞核,荧光显微镜拍照记录,细胞迁移数目百分比计算细胞迁移率。侵袭实验用含基质胶的Transwell上室接种转染48 h后的细胞1×104/孔,下室加入含10%血清的培养基,继续培养24 h,4%多聚甲醛固定后DAPI染细胞核,荧光显微镜记录细胞侵袭能力,细胞侵袭数目百分比计算细胞侵袭率。
1.8 双萤光素酶报告基因实验
将含miR-374b-5p结合位点的BLACAT1及Mut-BLACAT1插入pmir-GO构建载体,用Lipo⁃fectAMINE 2000与miR-NC、miR-374b-5p mimics共转染细胞,48 h后检测萤火虫萤光素酶和海参萤光素酶活性。相对萤光素酶活性为萤火虫萤光素酶活性值/海参萤光素酶活性值。
1.9 转移相关蛋白表达水平检测
用胰酶消化转染处理的细胞,细胞裂解液裂解细胞,离心分离蛋白和细胞碎片,BCA法检测细胞悬液中的蛋白浓度。样品中加入上样缓冲液,于100℃水浴锅煮10 min,进行电泳实验。电泳结束后,恒流转膜2 h。采用5%脱脂奶粉进行蛋白封闭2 h,再与一抗4℃孵育过夜。一抗孵育完成后,加入二抗孵育1 h,最后加入ECL化学发光液,通过凝胶成像仪观察蛋白条带结果。
1.10 统计分析
采用GraphPad Prism 7.0对实验数据进行统计分析,实验均重复3次及以上,数据平均值用x±s表示,单因素独立样本数据比较用t检验或单因素方差分析,双因素2组及以上采用双因素方差分析,实验数据均服从正态分布,双边分析P<0.05表示有显著性差异,具有统计学意义(*P<0.05,**P<0.01,***P<0.001)。
2 结果
2.1 BLACAT1在肺癌组织及癌旁组织转录水平差异
通过starBase分析BLACAT1在肺腺癌、肺鳞癌与癌旁组织的表达差异,样本中有526例肺腺癌及59例癌旁组织,以及501例肺鳞癌及49例癌旁组织。结果显示,BLACAT1在肺腺癌和肺鳞癌组织中的表达量均高于相应癌旁组织(图1),差异具有统计学意义(P<0.001)。
2.2 BLACAT1在非小细胞肺癌细胞系与正常肺上皮细胞中的转录水平差异
通过qRT-PCR检测BLACAT1在非小细胞肺癌细胞A549、HCC827、NCI-H1299、NCI-H23和正常肺上皮细胞BEAS-2B中的转录水平差异,结果见图2,非小细胞肺癌细胞系中BLACAT1的转录水平均明显高于正常肺上皮细胞BEAS-2B。比较几组非小细胞肺癌细胞转录水平发现,A549细胞的BLACAT1表达量高于另外3组肺癌细胞,差异具有统计学意义(P<0.001)。

图1 BLACAT1在肺癌组织与癌旁组织中的差异表达
2.3 BLACAT1对非小细胞肺癌细胞活力影响
采用CCK-8细胞活力检测试剂盒分析BLACAT1对A549细胞活力的影响,结果见图3,si-BLACAT1组A549细胞活力相比空白对照组明显下调,并存在时间效应,差异具有统计学意义(P<0.001)。结果表明敲低BLACAT1表达能明显抑制A549的细胞活力。
2.4 BLACAT1对非小细胞肺癌细胞迁移和侵袭能力影响
Transwell检测BLACAT1对A549细胞迁移和侵袭能力的影响,结果见图4。相比空白对照组,si-BLACAT1组细胞迁移和侵袭细胞数均明显下调,细胞迁移和侵袭的数量减少,差异具有统计学意义(P<0.001)。结果表明敲低BLACAT1能够明显抑制A549细胞迁移和侵袭能力。
2.5 验证BLACAT1作为海绵吸附miR-374b-5p
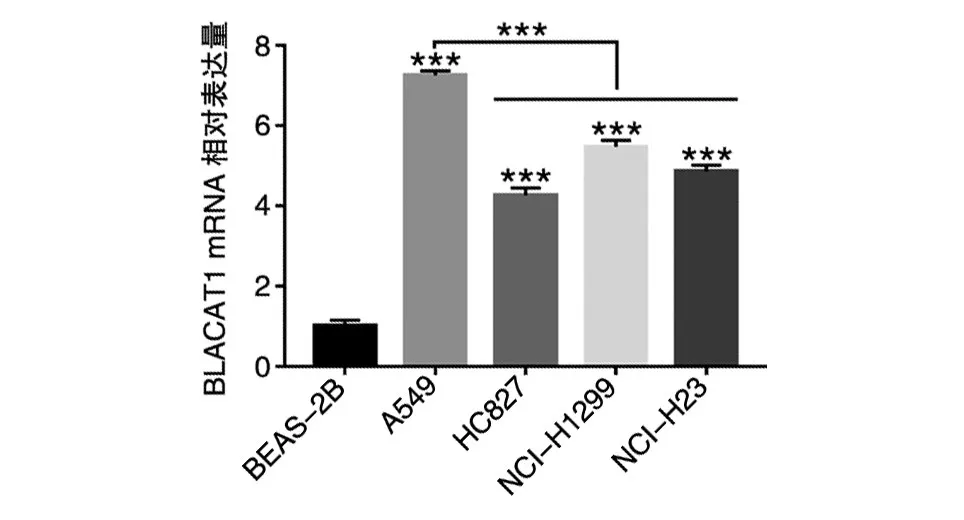
图2 qRT-PCR检测非小细胞肺癌细胞系
starBase软件预测的肺癌中与BLACAT1存在相互作用的miRNA为miR-142-5p、miR-374b-5p、miR-378c和miR-20b-5p。qRT-PCR检测空白对照组、si-NC组和si-BLACAT1组中各miRNA相对mRNA水平(图5A),结果显示,相比si-BLACAT1组各miRNA的mRNA水平,miR-374b-5p的mRNA水平明显上调(P<0.001)。
为了进一步验证miR-374b-5p是否为BLACAT1海绵吸附的miRNA,采用双萤光素酶报告基因实验验证空白对照组、miR-NC组和miR-374b-5p mimics组中相对萤光素酶活性(图5B、C),结果显示WT的miR-374b-5p mimics组相对萤光素酶活性明显下调,说明BLACAT1作为海绵吸附miR-374b-5p,降低其mRNA水平。
2.6 BLACAT1/miR-374b-5p对非小细胞肺癌细胞活力的影响
采用CCK-8细胞活力检测试剂盒评价BLACAT1/miR-374b-5p对A549细胞活力的影响,结果见图6。相比空白对照组,p-BLACAT1组A549细胞活力明显增加(P<0.001),miR-374b-5p mimics组A549细胞活力明显降低(P<0.001),差异具有统计学意义。以上结果表明BLACAT1通过抑制miR-374b-5p能够增加A549细胞活力。
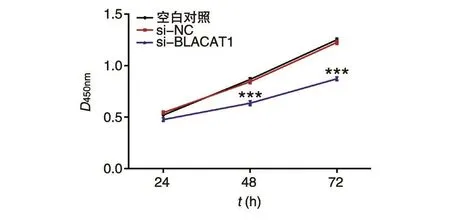
图3 CCK-8检测BLACAT1对A549细胞活力的影响
2.7 BLACAT1/miR-374b-5p对非小细胞肺癌细胞迁移和侵袭能力的影响
采用Transwell培养,荧光显微镜观察BLACAT1/miR-374b-5p对A549细胞迁移和侵袭能力的影响(图7A)。结果表明,相比空白对照组,p-BLACAT1组细胞迁移和侵袭能力均明显上调,表现为荧光显微镜观察到细胞迁移和侵袭的细胞数增加,差异具有统计学意义(P<0.001);miR-374b-5p mimics组细胞迁移和侵袭能力均明显下调,表现为荧光显微镜观察到细胞迁移和侵袭的数量减少,差异具有统计学意义(P<0.001);p-BLACAT1±miR-374b-5p mimics组细胞迁移和侵袭能力没有明显差异。
采用Western印迹检测与肿瘤转移相关蛋白的表达水平,结果显示,与空白对照组相比,p-BLACAT1组细胞MMP-2、MMP-9和N钙黏蛋白明显上调,差异具有统计学意义(P<0.001),E钙黏蛋白的表达没有明显差异(P=0.091);miR-374b-5p mimics组细胞MMP-2、MMP-9和N钙黏蛋白明显下调,E钙黏蛋白的表达明显上调,差异具有统计学意义(P<0.001);p-BLACAT1±miR-374b-5p mimics组细胞MMP-2和E钙黏蛋白没有明显差异(P=0.416;P=0.998),MMP-9蛋白和N钙黏蛋白的表达存在明显差异(P<0.001;P=0.0017),差异具有统计学意义。
以上结果表明BLACAT1通过抑制miR-374b-5p的表达促进A549细胞迁移和侵袭。
3 讨论

图4 Transwell检测BLACAT1对A549细胞迁移和侵袭能力的影响
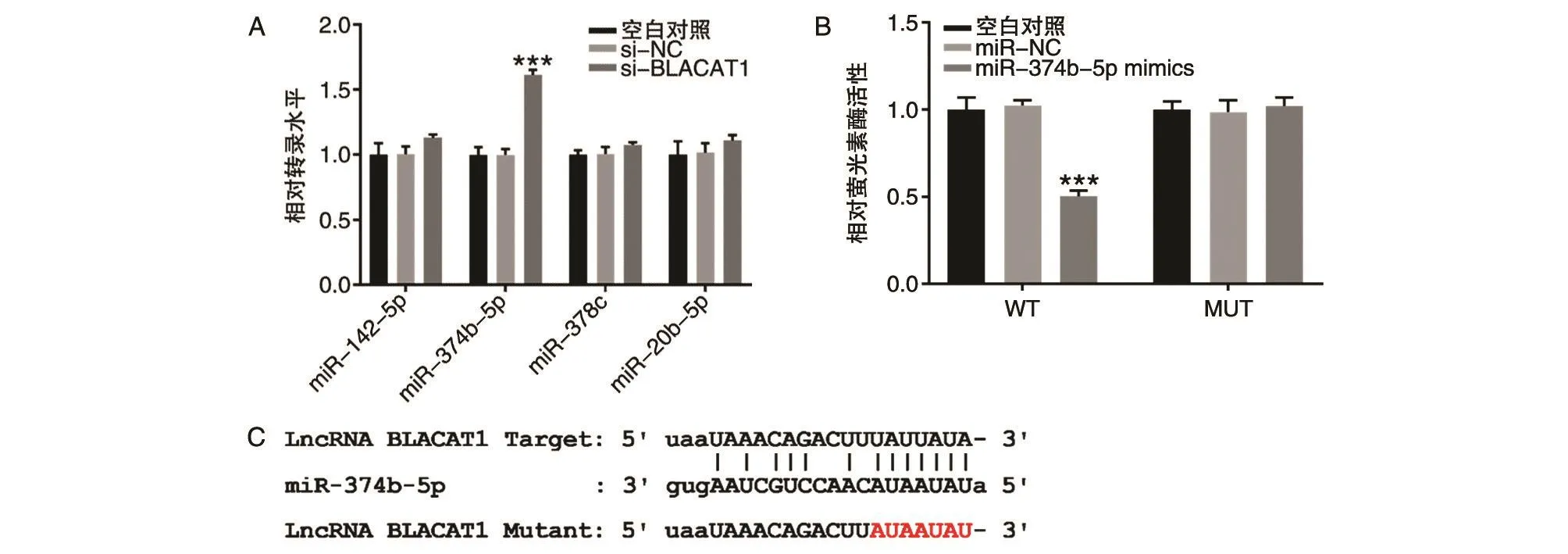
图5 验证BLACAT1作为海绵吸附miR-374b-5p
肺癌是严重威胁人类健康的恶性肿瘤之一,发病率和死亡率居前,确诊的患者往往为癌症晚期,转移性强,预后差[8-9]。传统治疗手段如手术、化疗和放疗治疗效果有限,且化疗和放疗的副作用大,故选择有效的补助治疗手段成为亟待解决的问题[10]。根据细胞来源不同及镜下细胞形态,可将肺癌分为小细胞癌和非小细胞肺癌,其中非小细胞肺癌为肺癌发病的主要类型,占85%[9]。非小细胞肺癌分为腺癌、鳞癌和大细胞癌[8]。BLACAT1作为一种长链非编码RNA,在肺腺癌及肺鳞癌组织中高度表达。研究发现,BLACAT1可以作为miRNA的靶点,与mRNA竞争性结合相应miRNA,从而降低miRNA的转录水平,提高该miRNA靶基因mRNA的转录及蛋白表达水平[7]。
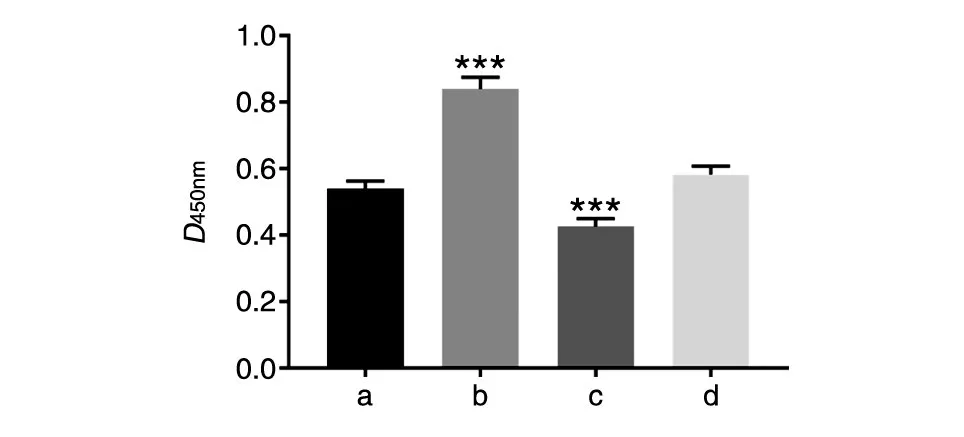
图6 CCK-8检测BLACAT1/miR-374b-5p对A549细胞活力的影响
本研究目的为探究BLACAT1在非小细胞肺癌细胞系中的生物功能。体外培养非小细胞肺癌细胞系,筛选BLACAT1高表达细胞系A549,研究BLACAT1对A549细胞增殖和转移的影响。为了进一步探讨BLACAT1的生物功能机制,利用软件预测BLACAT1作为海绵吸附的miRNA,并验证预测结果,将BLACAT1与相互作用的miR-374b-5p结合,研究BLACAT1/miR-374b-5p对A549细胞增殖和转移的影响。最终证实BLACAT1通过抑制miR-374b-5p促进非小细胞肺癌A549细胞的增殖和转移。miR-374b-5p作为miRNA家族一员,在人类肿瘤中被认为是一种抑癌基因[11-13]。已有研究表明,miR-374b-5p表达下调与癌细胞耐药相关,例如miR-374b-5p在功能上抑制卵巢癌细胞的增殖、迁移和上皮-间充质转化(EMT),并且增强细胞对顺铂的敏感性[11]。miR-374b-5p被发现在胰腺癌组织中的表达与癌旁正常组织相比显著降低,miR-374b-5p上调可改善胰腺癌细胞对吉西他滨的耐药性,并靶向多种抗凋亡蛋白,诱导胰腺癌细胞凋亡的发生[14]。

图7 BLACAT1/miR-374b-5p对A549细胞迁移和侵袭能力的影响
MMP-2、MMP-9、E钙黏蛋白和N钙黏蛋白均被证明与肿瘤细胞的侵袭和转移相关,其中MMP-2、MMP-9和N钙黏蛋白为肿瘤细胞转化为易转移细胞间质表型的标志物,E钙黏蛋白为正常细胞表型的标志物,当肿瘤细胞转变为间质表型时,该蛋白的表达量降低[15-17]。本研究通过Western印迹检测非小细胞肺癌细胞在BLACAT1作用下,MMP-2、MMP-9和N钙黏蛋白表达上调,E钙黏蛋白表达下调;加入miR-374b-5p的回复实验则上调以上蛋白的表达水平。
综上,可以将BLACAT1作为非小细胞肺癌治疗的新靶点,抑制肿瘤增殖和转移。

