戊型肝炎病毒动物模型的研究进展
唐塔娅,佘锐萍,刘天龙,田纪景
(中国农业大学,北京 100193)
戊型肝炎(hepatitis,HE)是由戊型肝炎病毒(Hepatitis E virus,HEV)引起的一种急性自限性疾病。研究发现HEV主要有4种传播途径,分别为粪口传播、食源性传播、血液和垂直传播,其中主要以粪口途径为主。在近几十年里,戊型肝炎在亚洲和非洲一些发展中国家呈大规模暴发性流行,并且在欧洲及美国等发达国家也发现了散发病例[1]。目前戊型肝炎是世界卫生组织认定的一个重要公共卫生疾病。在感染HEV人群中,大部分患者表现为亚临床症状,少部分表现为急性自限性肝炎。据估计,每年可发生2000万例HEV感染,有临床症状的HEV感染者超过330万,其中死亡44 000例[2]。人群感染后死亡率为0.5%~4.0%,孕妇的病死率则高达30%[3]。此外,因器官移植或免疫功能缺陷而感染HEV的人群,还可能转化为慢性肝炎,并形成肝硬化[4]。
戊型肝炎在全球范围内造成了严重的危害,并逐渐引起研究人员的重视,越来越多的动物种类被证实为HEV的宿主[5-6]。此外,国内外多项研究表明,动物粪便和肉制品中可以检出HEV RNA,并且食用被粪便污染的水源和未经充分烹饪的动物肉制品是导致戊型肝炎发生的主要原因。截止到目前,已从家猪、野猪、兔、鼠、鸡、鹿、雪豹等多种动物体内检出HEV核酸。虽然在狗、猫、马、羊等动物体内尚未检出HEV核酸,但这些动物的血清中HEV抗体阳性率较高。下文就戊型肝炎实验感染动物模型的研究进展做一综述。
1 非人灵长类动物
近年来各国研究学者都在致力于建立HEV实验动物感染模型。Balayan等[7]在1983年开创了戊型肝炎非人灵长类动物模型的先例。此后国内外学者又陆续建立了10余种HEV的非人灵长类动物模型。黑猩猩被证实对HEV易感,并已用作动物模型以表征HEV病毒学和免疫学方面的特征[8-10],但是目前已不再适用于侵入性生物医学研究。此外,猕猴被证实可用于模拟急性HEV感染。Li等[11]发现接种了1型HEV的猕猴,其血清和粪便中可检出HEV RNA,并且HEV抗原检测呈阳性。Ji等[12]分别用猪HEV的a亚型和b亚型毒株感染猕猴,组织病理学检查显示猕猴的肝脏病变与人急性肝炎的病理学变化相似。黄芬等[13]在对中国云南猕猴的HEV血清流行病学和分子特征进行分析后,发现猕猴可能不是HEV的天然储库。随后Huang等[14]提出了一种HEV跨物种感染的新途径,他们通过给恒河猴灌喂被4型HEV污染的牛奶,发现恒河猴发生急性戊肝感染,从而证实了牛奶作为感染途径的可能性,并存在将HEV传播给人类的风险。Liu等[15]用来自中国的兔源HEV成功感染了2只食蟹猴,食蟹猴表现出典型的肝炎症状,这一研究提示了人们兔作为戊型肝炎传染源的可能性。Lanford等[10]在最新研究中证实了食蟹猴和恒河猴对1-4型HEV均易感,这两种动物模型可用于评估HEV备选疫苗的临床反应。截止至今,研究人员已证实了黑猩猩、猕猴、恒河猴、食蟹猴以及非洲绿猴等非人灵长类对1-4型HEV的易感性。非人灵长类动物在感染人源HEV后的临床表现和病程转归与人急性肝炎的症状极为相似,是研究HEV致病性较为理想的动物模型,但由于不是HEV的天然宿主,并且来源有限价格较昂贵,因此无法批量应用,这些问题都导致非灵长类动物在科研中的应用受到限制。
2 猪
1990年,Balayan等[16]用人源HEV经口和静脉途径感染猪,结果表明猪对人源HEV具有易感性。Meng等[17]首次从猪体内分离得到了1株猪HEV后,是首次报道的猪感染HEV的实验进行了基因测序,对比结果提示猪源HEV与美国人源HEV有极高的同源性,猪源HEV还可以感染黑猩猩和恒河猴,这一研究结果暗示动物作为戊型肝炎传染源的可能性。Feagins等[18]将人源4型HEV衣壳基因克隆于猪源3型HEV主干中,制成基因嵌合HEV,成功感染了猪动物模型,进一步证实了3型和4型HEV的人畜共患性质。Cossaboom等[19]用来自中、美两国的兔源HEV毒株感染SPF猪,结果显示感染了中、美两国兔源HEV的猪中均出现粪便排毒,感染美国兔源HEV的猪还表现出一过性的病毒血症,该现象表明猪对兔源HEV有一定易感性。Sanford等[20-21]将猪HEV、大鼠HEV和禽HEV的重组衣壳抗原接种到猪体内,诱导HEV IgG的特异性应答,研究发现该免疫应答对3型HEV具有部分交叉保护作用。将猪用作HEV疫苗试验的动物模型,并用于评估重组HEV抗原的交叉保护潜力,这对于开发针对3型和4型HEV的疫苗至关重要。
猪是HEV重要的储存宿主和感染源之一,作为感染模型可用于研究HEV的病原分布,分子学特征、传播及感染机制等,但猪只能感染基因3、4型HEV且无明显的临床表现[22],不能复制人感染HEV的致病机制,还存在饲养处理不便等缺点,因此猪动物模型在HEV研究中应用受限。
3 啮齿动物
Johne等[23]在2009年首次从德国野生大鼠粪便中检出了鼠源HEV。此后,研究人员在欧洲、亚洲和美国几个国家的动物体内也检测到了鼠源HEV[24]。Guan等[25]用含有鼠源HEV的组织匀浆静脉接种大鼠,证实了鼠源HEV具有嗜肝性,但感染后的大鼠不表现明显的临床症状。这表明鼠HEV可以作为感染模型,但不适用于发病机制的研究。Hong等[26]用1型HEV感染蒙古沙鼠,沙鼠的肝脏、脾脏和肾脏内显示出组织病理学变化,在接种后7~42 d在粪便样品中检测到HEV RNA,ALT水平仅适度增加,但未检测到HEV特异性抗体,因此还需要进一步研究蒙古沙鼠是否真的对人类HEV感染敏感。Maneerat等[27]用含感染性HEV分离株TK-037/92的人体粪便悬浮液静脉接种Wistar大鼠,结果证实HEV可以在Wistar大鼠中复制。Debing等[28]用鼠HEV株LA-B350感染无胸腺裸鼠,结果显示无胸腺裸鼠对LA-B350易感,并与免疫功能低下的慢性戊型肝炎患者的情况相似。此外还发现利巴韦林能够有效抑制无胸腺裸鼠中的LA-B350复制,这证实了大鼠模型对抗病毒研究的适用性。
笔者所在团队近年来在HEV长爪沙鼠动物模型方面进行了系统的研究(表1)。毛晶晶等[29]用猪源HEV成功感染长爪沙鼠,观察结果表明HEV可损伤长爪沙鼠的肠道结构,同时能激发肠道的黏膜免疫功能。杨依霏等[30-31]用猪源HEV感染长爪沙鼠,研究结果表明HEV可以诱导肝细胞线粒体凋亡途径激活,这是HEV造成沙鼠肝脏结构功能损伤的重要机制之一。Soomro等[32-33]研究了沙鼠通过腹腔注射感染猪源HEV后肾脏的损伤机制。研究结果表明,线粒体Caspase-3蛋白酶的激活可能诱导蒙古沙鼠HEV感染急性期后肾上皮细胞坏死和细胞死亡。随后他们又检测了猪源HEV对长爪沙鼠睾丸组织结构和分子变化的影响和作用,结果表明,HEV在睾丸组织中病毒蛋白产生结构和分子变化,进而破坏血睾屏障并诱导生殖细胞凋亡。石蕊寒等[34]也采用了已有的猪源HEV感染沙鼠模型,证实了HEV能够在沙鼠脑和脊髓组织中进行复制从而引发病理损伤。此外,刘天龙等[35]也用猪源HEV感染了本实验室建立的长爪沙鼠HEV模型,研究结果表明,HEV感染能引起沙鼠机体抗氧化能力降低,肝脏糖代谢紊乱,并通过激活肝细胞的内质网应激途径引发肝细胞损伤。虽然啮齿类动物具有背景清晰、病死率低、重复性好、选模方法简便和繁殖力强等优点,但鼠作为动物模型感染后无明显的临床表现,且鼠源HEV的人畜共患潜力尚不清楚,因此还需要进一步的深入研究。
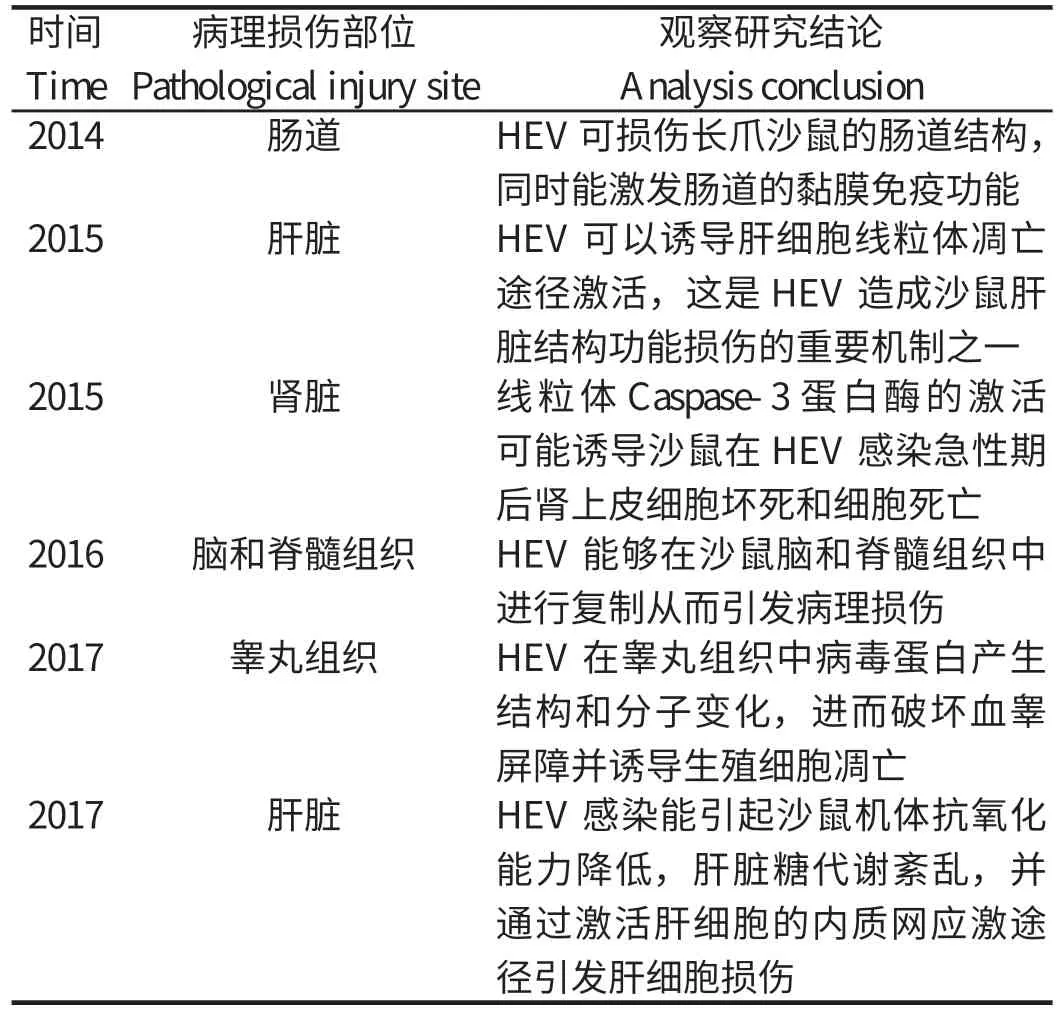
表1 猪源HEV感染的沙鼠模型的系统研究Table 1 Systematic study of gerbil model of pig-derived HEV infection
4 兔
兔源HEV最早在中国兔群中被检测到,基因测序结果显示,兔源HEV与3型HEV最密切相关。随后研究人员在美国、亚洲及欧洲部分国家的兔群中也陆续检测到兔源HEV[36-39]。这些研究表明,兔是HEV的天然宿主之一。在2015至2016年期间,根据法国的一项研究发现,在919名HEV感染患者中,有5名感染了与兔HEV密切相关的病毒,这表明兔HEV毒株可能传染给人类并引起人畜共患感染[40]。兔是最常使用的实验动物之一,兔源HEV的发现,揭示了兔作为感染模型的可能性。
Ma等[41]研究发现,兔在感染HEV毒株后可出现粪便排毒,体内可检测到HEV抗体,并且感染HEV时,血清丙氨酸氨基转移酶(alanine aminotransferase,ALT)活性显示升高,这表明兔发生急性肝损伤。Cheng等[42]在一项研究中发现兔对1型HEV不易感,并且在接种了血清转化的3型HEV后兔也没有表现出病毒血症和粪便排毒。Xia等[43]研究发现用兔HEV感染怀孕母兔,可导致高死亡率和病毒的垂直传播现象,并可见兔肝脏的局部肝细胞明显坏死,相反,当用兔HEV感染非妊娠兔时则病死率较低,甚至没有明显的病理变化。Wang等[44]在一项研究中发现,慢性感染兔HEV的兔还会出现肾脏损伤,并且在其尿液中可检测到HEV RNA,将该尿液样品注射到SPF兔体内可成功诱导兔感染HEV。
笔者所在团队近年来在兔感染HEV模型的建立上取得了良好的进展(表2)。毛晶晶等[45]通过检测实验感染兔肠道内的ORF2抗原信号,证实了兔肠道上皮细胞在HEV复制过程中的重要作用。吴桥兴等[46]采用4型猪HEV成功感染了新西兰兔,感染兔表现出典型的病毒性肝炎变化和多种肝外器官损伤。虽然通过灌胃途径感染能更客观的反应在自然感染状况下病毒的致病机制,但与腹腔注射途径相比感染的阳性率较低。此外他们还发现病毒在感染兔后能通过唾液排出。该研究证实了新西兰兔可以作为猪HEV跨种间感染的动物模型。An等[47]通过腹腔注射4型猪HEV感染兔,研究了HEV在卵巢和子宫内的复制以及HEV引起的组织结构变化,发现卵巢是HEV的复制位点之一,并且HEV在卵巢组织中的复制促进了生殖细胞的凋亡。这是为研究HEV垂直传播的机制提供了新思路。
5 其他动物
2001年,美国研究人员从患有肝脾综合征的鸡中分离出了一种新的HEV毒株,禽源HEV与人源HEV有极高的同源性,但仅局限于在禽类动物中传播,至今尚未发现禽HEV感染人的现象。因此禽作为HEV动物模型的应用价值非常有限[48-49]。2010年,荷兰学者首次从雪貂粪便中检出HEV RNA,该病毒株与基因1-4型HEV、兔源HEV、禽源HEV的基因相似性为54.5%~60.5%,与鼠源HEV的相似性较高,为72.3%[50]。虽然雪貂为HEV新的动物宿主,但尚无因感染HEV而致病的相关报道,其能否作为实验感染HEV的理想动物模型尚待进一步研究。Yu等[51]的一项研究表明,树鼩可以被人源4型HEV感染,在血清、粪便、胆汁、脾脏和肾脏组织中可以检测到HEV RNA,血清ALT升高并有轻度肝损伤。体内可检测到HEV IgG和IgM抗体。该研究表明树鼩具备作为人源HEV感染模型的潜力,值得进一步研究。

表2 猪源HEV感染的兔模型的系统研究Table 2 Systematic study of rabbit models of pig-derived HEV infection in our laboratory
6 展望
本文就上述动物模型对HEV毒株的实验敏感性进行了归纳(表3)。随着研究人员对戊型肝炎的研究日渐深入,越来越多的HEV动物宿主被发现,这对HEV在发达国家的散发流行进行了很好的解释,同时对于戊型肝炎病毒理想动物模型的选择也具有十分重要的借鉴意义。现代医学器官移植技术发展迅猛,这使得人类通过动物器官移植感染上HEV的风险显著增高。建立HEV实验动物模型不仅可以阐明HEV的感染及致病机理,在促进HEV新型疫苗的开发及评估方面也意义重大,并且也为建立新的细胞培养系统提供了更多的可能性。但目前关于HEV实验动物模型的研究仍然存在一些问题,比如实验中所用的动物模型以啮齿类动物与兔居多,对于其他动物模型的研究报道较少,HEV感染方式以静脉和腹腔注射为主,经口及其他途径感染的研究较少,以及机体自身的免疫反应与HEV感染后的发病机制是否相关等问题。综上,已经建立的动物模型对病毒复制、发病机制和保护性免疫应答的研究在某种程度上还是初步的,如果要加深对戊型肝炎病毒的认识并改善对戊型肝炎的控制状况,还需进一步开发戊型肝炎病毒的小动物模型。

表3 不同动物物种对HEV毒株的实验敏感性Table 3 Experimental sensitivity of different animal species to HEV strains

