紫杉醇/姜黄素双载药脂质体的制备工艺及制剂学性质研究
吕佳佳,韦恋祝,付小英,林小青,高 杰
(遵义医科大学 药剂学教研室,贵州 遵义 563099)
紫杉醇(Paclitaxel,PTX)是继阿霉素和顺铂后又一抗癌明星产品,其独特的阻碍微管蛋白解聚的作用机制使其对多种实体瘤具有良好的疗效[1-2],如卵巢癌、乳腺癌、肺癌和黑色素瘤等[3-4]。临床应用的紫杉醇注射液需要以聚氧乙烯蓖麻油和无水乙醇为助溶剂,由此可能诱发患者产生致命的过敏反应,以及紫杉醇对P-糖蛋白等外排蛋白的敏感性,长期使用易产生耐药现象,在一定程度上限制了紫杉醇的临床应用[5]。
在肿瘤的治疗过程中,化疗一直占据着重要地位。化学疗法对肿瘤患者的病情的确有很大缓解,但这种缓解作用往往持续时间短暂,患者很快就会产生多药耐药(Multi-drug resistance,MDR)现象[6-8]。姜黄素(Curcumin,Cur)是从姜黄中提取的一种天然有效成分,近年研究表明,姜黄素具有广泛的药理作用,如抗肿瘤、改善心血管功能、保肝、增强免疫力等[9]。其中另有文献报道,姜黄素可以减少细胞内P-糖蛋白、多药耐药相关蛋白、米托蒽醌耐药蛋白这3个重要的ABC药物转运体成员的表达量,有着逆转多种肿瘤细胞耐药性的作用[10-12]。但由于姜黄素存在疏水性强、稳定性差以及体内生物利用度低等缺点,严重影响其在临床上的使用。
在众多纳米给药体系中,脂质体是近年来研究较多的药物载体,具有良好的生物相容性和靶向性,并且可以改变被包封药物的体内分布,提高药物治疗指数和降低药物毒性[13]。因此,脂质体作为难溶性药物的载体显示了明显的优越性。本文拟将紫杉醇和姜黄素同时装载于脂质体中,构成脂质体双载药体系。利用高渗透和长滞留效应(Enhanced permeability and retention effect,EPR effect)将药物有效地靶向肿瘤部位而发挥作用[14]。同时利用姜黄素抑制肿瘤的多药耐药性,进一步改善紫杉醇的抗肿瘤效果。本文主要对紫杉醇/姜黄素双载药脂质体的处方及制备工艺进行优化,并对其包封率、粒径、多分散系数、Zeta电位、稳定性等制剂学性质进行评价。
1 材料与方法
1.1 药品与试剂 紫杉醇对照品(批号:160504,纯度:≥98%)、姜黄素对照品(批号:160421,纯度:≥98%)均购自成都普菲德生物技术有限公司;胆固醇(CHO,批号:P1276888)购自上海Adamas试剂有限公司;聚乙二醇-二硬脂酰磷脂酰乙醇胺(DSPE-PEG2000-OME,批号:B50845)、大豆卵磷脂(SPC,批号:SY-SI-170103)、氢化大豆磷脂(HSPC,批号:B50541)、蛋黄卵磷脂(EPC-98T,批号:AL17002)均购自上海艾韦特医药科技有限公司;葡聚糖凝胶G-50(批号:S8151)购自北京索莱宝科技有限公司。测定用甲醇、乙腈为色谱纯,水为超纯水,其余试剂均为分析纯。
1.2 仪器 Agilent1260型高效液相色谱系统(包括DAD检测器、四元低压梯度泵、在线真空脱气机、Chemstation工作站,美国Agilent公司);NanoBrook 90 PLAS激光粒度及zeta电位分析仪(美国布鲁克海文仪器公司);UVD-680-1紫外检测仪(上海金达生化仪器有限公司);JY92-IIN超声波细胞粉碎机(宁波新芝生物科技股份有限公司);BT125D分析天平(赛多利斯科学仪器(北京有限公司);ME204E分析天平(梅特勒·托利多仪器[上海]有限公司);RE-2000A旋转蒸发仪(上海亚荣生化仪器厂);BF-2F恒温摇床(常州华冠仪器制造有限公司);XH-T涡旋混合仪(金坛区白塔新宝仪器厂);TGL-16C高速台式离心机(上海安亭科学仪器厂);DL-820D智能超声波清洗器(上海之信仪器有限公司)。
1.3 方法
1.3.1 分析方法的建立
1.3.1.1 溶液的配制 精密称取紫杉醇对照品5.01 mg,置于50 mL棕色容量瓶内,加甲醇充分溶解并定容,得质量浓度为0.100 2 mg/mL的紫杉醇对照品溶液;精密称取姜黄素对照品10.16 mg,置于25 mL棕色容量瓶内,加甲醇充分溶解并定容,得质量浓度为0.406 4 mg/mL的姜黄素对照品溶液;分别精密量取空白脂质体和紫杉醇/姜黄素双载药脂质体400 μL(制备方法见1.3.2),各加600 μL甲醇涡旋破乳,破乳后的溶液离心5 min(10 000 rpm),吸取上清液过0.45 μm微孔滤膜即得空白样品溶液和供试品溶液。
1.3.1.2 色谱条件 Diamonsil Plus C18色谱柱(250 mm×4.6 mm,5 μm);流动相乙腈(A)~0.1%磷酸水溶液(B),梯度洗脱(0~10 min,45%~70% A;10~16 min,70%~45% A);检测波长227 nm;柱温30 ℃;流速1 mL/min;进样量10 μL。
1.3.1.3 专属性考察 分别精密吸取对照品溶液、供试品溶液和空白样品溶液适量,按照“1.3.1.2”项下色谱条件进行分析。
1.3.1.4 线性关系考察 精密吸取“1.3.1.1”项下紫杉醇对照品溶液0.5、1、1.5、2、3、5、7 mL分别于10 mL容量瓶中,加甲醇定容至刻度,摇匀;同理精密吸取“1.3.1.1”项下姜黄素对照品溶液0.1、0.2、0.5、1、2、4 mL分别于10 mL容量瓶中,加甲醇定容至刻度,摇匀。按照“1.3.1.2”项下色谱条件进行测定。
1.3.1.5 精密度试验 取低、中、高质量浓度(10.2、20.4、50.1 μg/mL)的紫杉醇对照品溶液和低、中、高质量浓度(4.406、20.32、81.28 μg/mL)的姜黄素对照品溶液,按照“1.3.1.2”项下色谱条件测定,计算各组峰面积的RSD值。
1.3.1.6 重复性试验 精密量取400 μL紫杉醇/姜黄素双载药脂质体6份,按照“1.3.1.1”项下方法制得6份供试品溶液,并按“1.3.1.2”项下色谱条件测定,计算各组峰面积的RSD值。
1.3.1.7 稳定性试验 精密量取400 μL紫杉醇/姜黄素双载药脂质体按照“1.3.1.1”项下方法制得供试品溶液,分别在0、4、8、12、16、24 h进样,按“1.3.1.2”项下色谱条件测定,记录相应的色谱峰面积。
1.3.1.8 加样回收率试验 精密量取空白脂质体500 μL,分别加入质量浓度为0.401 6 mg/mL紫杉醇对照品储备液(0.5、1.0、1.5 mL)和质量浓度为0.406 4 mg/mL姜黄素对照品储备液(0.5、1.0、1.5 mL)于10 mL离心管内,加3 mL甲醇混匀涡旋5 min,破乳后离心5 min(转速为10 000 rpm),吸取上清液加甲醇定容至10 mL容量瓶内,摇匀过0.45 μm微孔滤膜,按“1.3.1.2”项下色谱条件测定,记录峰面积计算其回收率。
1.3.2 双载药脂质体的制备 称取卵磷脂(3.32 mg)、胆固醇(0.86 mg)、DSPE-PEG2000-OME(1.35 mg)、姜黄素(0.13 mg)、紫杉醇(0.13 mg)溶于1.5 mL混合有机溶剂(氯仿∶甲醇v/v,2∶1)中,置梨形瓶内旋转蒸发成膜后,薄膜置于真空干燥器内(放置6 h以上),取出梨形瓶加入1 mL水化介质水化30 min(25 ℃,180 rpm),溶液移入EP管内,探头超声(功率35%)2 min即得。
1.3.3 双载药脂质体包封率的测定[15-16]采用葡聚糖凝胶(G50)色谱柱法分离紫杉醇/姜黄素双载药脂质体和游离药物,使用HPLC法测定姜黄素和紫杉醇的含量。取200 μL紫杉醇/姜黄素双载药脂质体溶液加于G50柱顶端,以PBS缓冲液进行脱液,连接紫外检测仪,从紫外检测信号开始时收集2 mL洗脱液于离心管内。取过柱后的紫杉醇/姜黄素双载药脂质体溶液200 μL,加800 μL甲醇破乳,离心5 min(10 000 rpm),取上清液按照“1.3.1.2”项下色谱条件测定双载药脂质体中药物的含量,记为W包封;另取未过柱的紫杉醇/姜黄素双载药脂质体200 μL,加800 μL甲醇破乳同法处理后,取上清液按“1.3.1.2”项下色谱条件进样测定总药物的含量,记为W总。包封率(Encapsulation efficiency,EE)=W包封/W总×100%。注:W包封─包封于脂质体中的姜黄素、紫杉醇的含量;W总─总姜黄素、紫杉醇的含量。
1.3.4 单因素试验
1.3.4.1 磷脂种类考察 固定其他因素不变,只改变磷脂种类,分别使用大豆卵磷脂(SPC:3.24 mg)、氢化大豆磷脂(HSPC:3.25 mg)、蛋黄卵磷脂(EPC:3.24 mg),按照“1.3.2”项下方法制备紫杉醇/姜黄素双载药脂质体,并按“1.3.3”项下方法进行姜黄素和紫杉醇包封率的测定,考察磷脂种类对两种药物包封率的影响。
1.3.4.2 磷脂浓度考察 固定其它因素不变,只改变磷脂浓度,使SPC浓度分别为10、20、30、40、50、60 mg/mL,按“1.3.2”项下方法制备紫杉醇/姜黄素双载药脂质体,并按“1.3.3”项下方法测定姜黄素和紫杉醇的包封率,考察磷脂浓度对两种药物包封率的影响。
1.3.4.3 磷脂-胆固醇比例考察 固定磷脂浓度40 mg/mL,使磷脂-胆固醇比例为5∶1、4∶1、3∶1、2∶1、1∶1、1∶2,其余因素不变,按照“1.3.2”项下方法制备紫杉醇/姜黄素双载药脂质体,并按“1.3.3”项下方法测定姜黄素和紫杉醇的包封率,考察磷脂-胆固醇比例对两种药物包封率的影响。
1.3.4.4 药脂比考察 固定磷脂浓度40 mg/mL,磷脂-胆固醇比例3∶1,使药脂比为1∶10、1∶20、1∶30、1∶40、1∶50,其余因素不变,按照“1.3.2”项下方法制备紫杉醇/姜黄素双载药脂质体,并按“1.3.3”项下方法测定姜黄素和紫杉醇的包封率,考察药脂比对两种药物包封率的影响。
1.3.4.5 水化介质考察 固定磷脂浓度40 mg/mL,磷脂-胆固醇比例3∶1,药脂比1∶30,水化介质分别为超纯水、生理盐水、pH值分别为(7.0、7.4、6.5)的PBS缓冲液、Hepes缓冲液,按照“1.3.2”项下方法制备紫杉醇/姜黄素双载药脂质体,并按“1.3.3”项下方法测定姜黄素和紫杉醇的包封率,考察水化介质对两种药物包封率的影响。
1.3.5 正交试验
1.3.5.1 制备工艺优化 根据单因素考察结果,选取磷脂浓度、磷脂-胆固醇比(膜脂比)和药脂比3个因素进行考察,每个因素3个水平,以姜黄素和紫杉醇的包封率为考察指标,选用L9(34)正交表进行试验。因素水平表(见表1)。
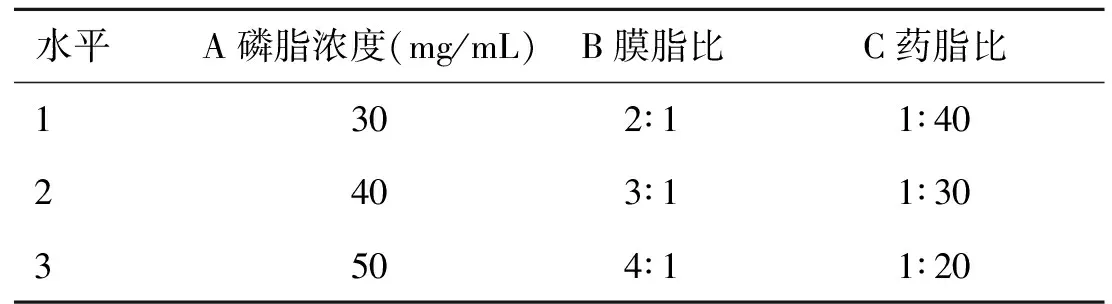
表1 因素水平表
根据正交表L9(34)进行试验,按照“1.3.2”项下方法制备紫杉醇/姜黄素双载药脂质体,并按“1.3.3”项下方法进行姜黄素和紫杉醇包封率的测定。
1.3.5.2 验证性试验 按优化后的条件平行制备3份紫杉醇/姜黄素双载药脂质体,并按“1.3.3”项下方法进行姜黄素和紫杉醇包封率的测定。
1.3.6 双载药脂质体药剂学性质的研究
1.3.6.1 双载药脂质体粒径和多分散系数考察 取紫杉醇/姜黄素双载药脂质体100 μL,加PBS缓冲液稀释至2 mL,采用激光粒度仪对其粒径及多分散系数进行测定。
1.3.6.2 双载药脂质体稳定性考察 将制备好的紫杉醇/姜黄素双载药脂质体放置于4 ℃冰箱中,分别于制备当天(第1天)和制备后连续6 d取样测定样品的粒径和Zeta电位,考察4 ℃条件下样品稳定性。
1.3.6.3 双载药脂质体体外血清稳定性考察 取紫杉醇/姜黄素双载药脂质体100 μL,加入等体积50%胎牛血清1∶1(v/v)混合,加入96孔板并在37 ℃、50 rpm摇床中孵育,分别于0、0.5、2、4、6、8、10、12、24和48 h对其浊度进行测定(750 nm),考察脂质体在血清中的稳定性。
1.3.6.4 双载药脂质体形态考察 将紫杉醇/姜黄素双载药脂质体用超纯水稀释2倍,混合均匀,采用2%磷钨酸负染法,小心滴加于覆盖碳膜的铜网上,染色30 s~1 min,将铜网置于滤纸上自然干燥,然后将干燥后的铜网于透射电镜下观察形态。
2 结果
2.1 方法学考察结果
2.1.1 专属性考察 测得色谱图如图1所示,在该测定条件下,对照品和供试品溶液色谱峰峰形良好,且空白样品溶液在相应位置没有出现色谱峰,说明各类辅料对姜黄素与紫杉醇的含量测定均无干扰,表明方法专属性良好。
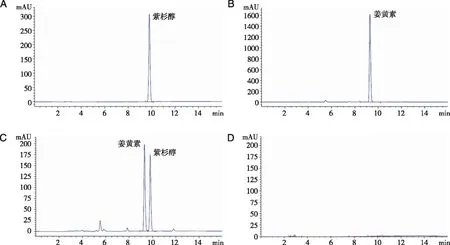
A:PTX对照品溶液;B:Cur对照品溶液;C:PTX/Cur脂质体样品;D:空白脂质体阴性对照。
2.1.2 线性关系考察 按照“1.3.1.2”项下色谱条件进样,以对照品质量浓度(μg/mL)为横坐标,峰面积为纵坐标作标准曲线,得紫杉醇回归方程为Y=23.96X-15.07(R2=0.999 6),表明紫杉醇在5.01~70.14 μg/mL范围内呈良好的线性关系;姜黄素回归方程为Y=20.05X+7.09(R2=0.999 9),表明姜黄素在4.41~162.56 μg/mL范围内呈良好的线性关系。
2.1.3 精密度、重复性、稳定性试验 根据各测定结果计算紫杉醇和姜黄素的RSD(n=6)值。结果见表2,表面仪器的日内精密度与日间精密度均良好,同时双载药脂质体供试品溶液在24 h内稳定性良好,该方法重复性良好。

表2 精密度、重复性、稳定性试验结果(%,n=6)
2.1.4 加样回收率试验 按“1.3.1.2”项下色谱条件测定,记录峰面积计算其回收率。结果紫杉醇的平均回收率分别为96.65%、96.26%、99.87%,RSD分别为0.45%、1.33%、0.85%;姜黄素的平均回收率分别为97.86%、99.80%、95.24%,RSD分别为0.44%、1.08%、0.75%,表明方法的准确性良好。
2.2 单因素试验结果
2.2.1 磷脂种类考察结果 由图2可知,SPC制备的双载药脂质体中姜黄素和紫杉醇的包封率比HSPC和EPC均高,故本实验选用大豆卵磷脂作为姜黄素和紫杉醇双载药脂质体的成膜材料。
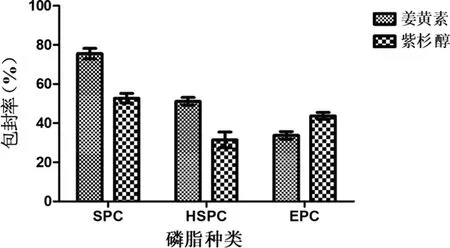
图2 磷脂种类对姜黄素和紫杉醇包封率的影响(n=3)
2.2.2 磷脂浓度考察结果 由图3可知,姜黄素和紫杉醇包封率随着磷脂浓度的升高而增加,增加到40 mg/mL时趋于平稳,当磷脂浓度为60 mg/mL时姜黄素的包封率大于100%,可判断该磷脂浓度下双载药脂质体出现渗漏现象。在抽膜过程中,50~60 mg/mL的膜层出现固体颗粒析出,对其包封率有影响,不宜选用。故本实验选用40 mg/mL的磷脂浓度作为紫杉醇/姜黄素双载药脂质体的成膜浓度。
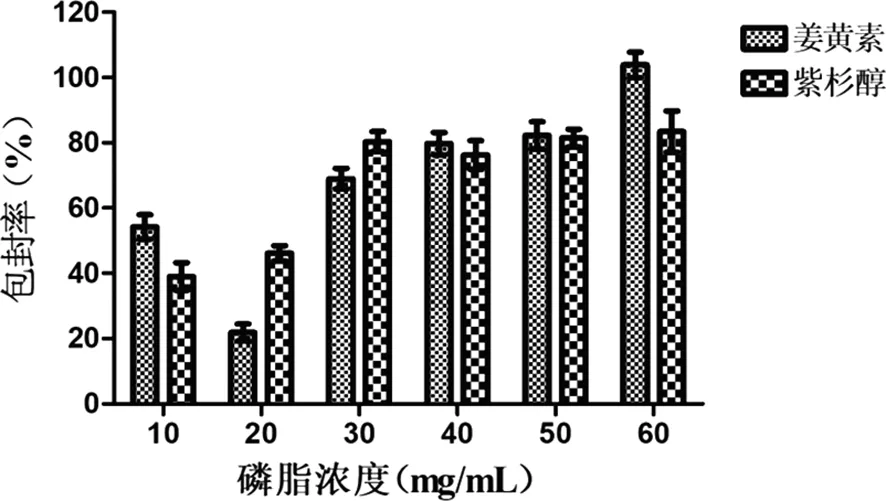
图3 磷脂浓度对姜黄素和紫杉醇包封率的影响
2.2.3 磷脂-胆固醇比例考察结果 由图4可知,磷脂-胆固醇比例为3∶1时姜黄素和紫杉醇的包封率最高,故本实验选用3∶1的磷脂-胆固醇比例作为紫杉醇/姜黄素双载药脂质体的膜脂比。
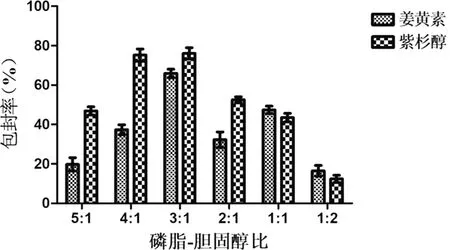
图4 磷脂-胆固醇比例对姜黄素和紫杉醇包封率的影响
2.2.4 药脂比考察结果 由图5可知,随着药脂比的降低,姜黄素和紫杉醇的包封率先升高后降低,当药脂比为1∶30时,包封率达到最高。实验过程中药脂比为1∶10所制备的双载药脂质体在探头超声后出现浑浊现象,说明药脂比过大会超出脂质双分子层的包载能力,不能形成稳定的脂质体,所以包封率小。故本实验选用1∶30的药脂比进行实验。

图5 药脂比对姜黄素和紫杉醇包封率的影响
2.2.5 水化介质考察结果 由图6可知,复方脂质体中采用pH 6.5的PBS缓冲液作为水化介质时姜黄素和紫杉醇包封率最好,因为水化介质的浓度、pH值、离子种类等会对磷脂头部的电离层产生影响,故选用PBS缓冲液(pH 6.5)作为复方脂质体的水化介质。
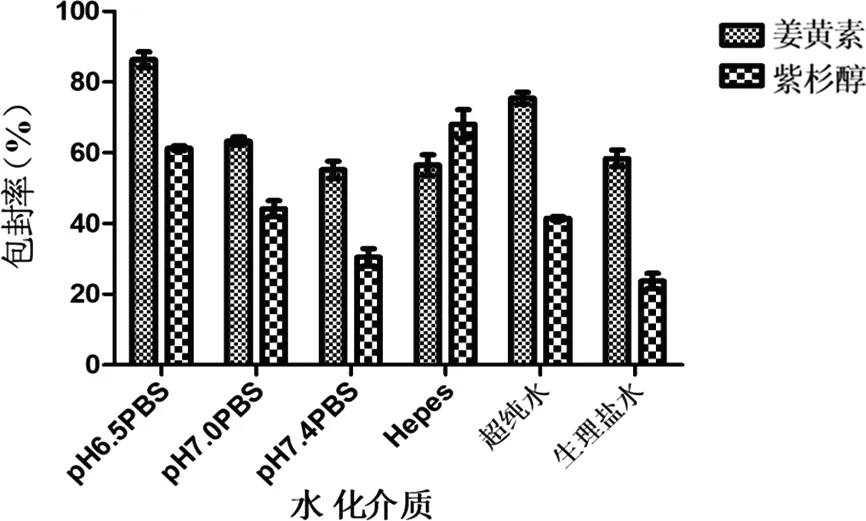
图6 水化介质对姜黄素和紫杉醇包封率的影响
2.3 正交试验结果 由表3可知,A因素K2最大,B因素K3最大,C因素K1最大,所以最佳制备工艺为A2B3C1。极差R为C>B>A,其中说明C因素的影响最大,即药脂比,其次是膜脂比,磷脂浓度的影响较小。并且由表4可知B、C项中P<0.05,存在显著性差异,A项中P>0.05,无显著性差异。最终确定处方和制备工艺为:磷脂浓度为40 mg/mL,膜脂比为4∶1,药脂比为1∶40,以pH 6.5的PBS缓冲液为水化介质,水化温度为25 ℃,水化时间30 min。
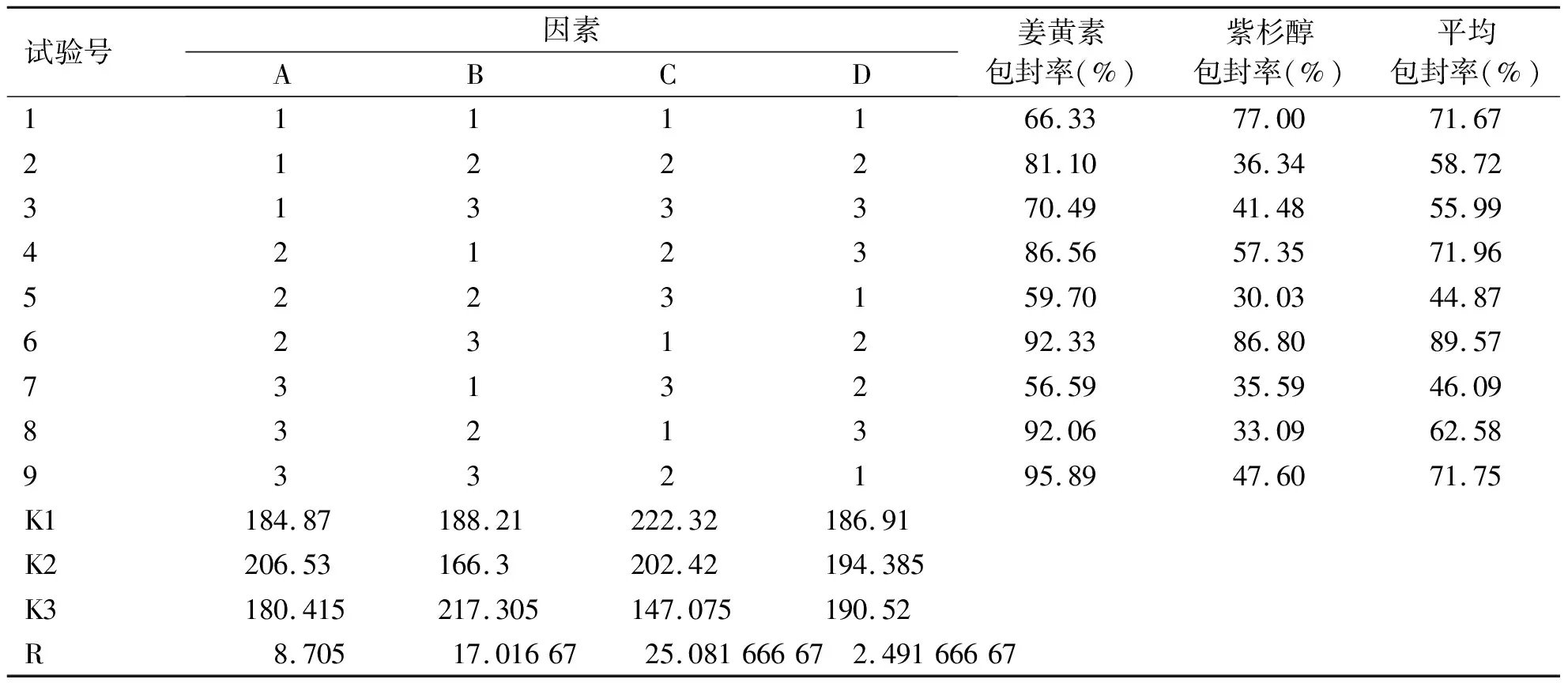
表3 正交试验结果
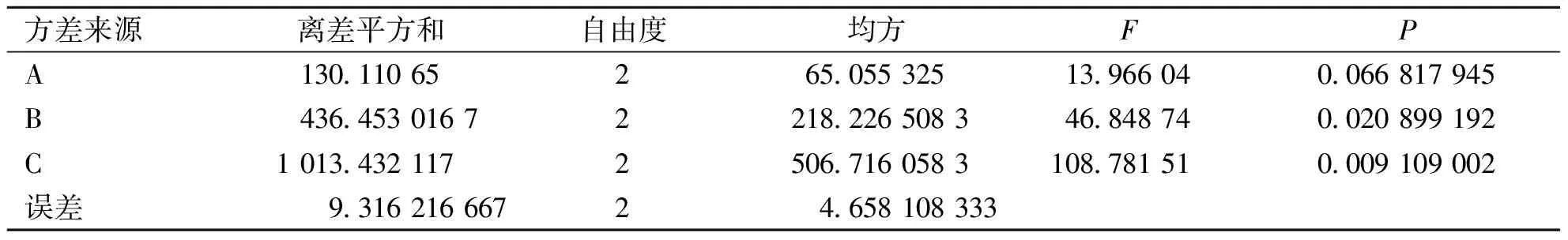
表4 方差分析结果
2.4 验证性试验结果 由表5可知,3份紫杉醇/姜黄素双载药脂质体的总包封率较高,且结果波动不大。故确定最佳制备工艺为:磷脂浓度为40 mg/mL,膜脂比为4∶1,药脂比为1∶40,以pH 6.5的PBS缓冲液为水化介质,水化温度为25 ℃,水化时间30 min。

表5 处方验证实验结果(n=3)
2.5 双载药脂质体药剂学性质研究结果
2.5.1 双载药脂质体粒径和多分散系数考察结果 由表6和图7可知,紫杉醇/姜黄素双载药脂质体粒径为(107.39±1.85)nm,多分散系数为(0.238±0.002),结果表明,双载药脂质体在PBS缓冲液中分布均匀,粒径适宜,均在100 nm左右,分散较好。
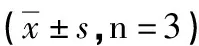
表6 紫杉醇/姜黄素双载药脂质体粒径电位考察结果
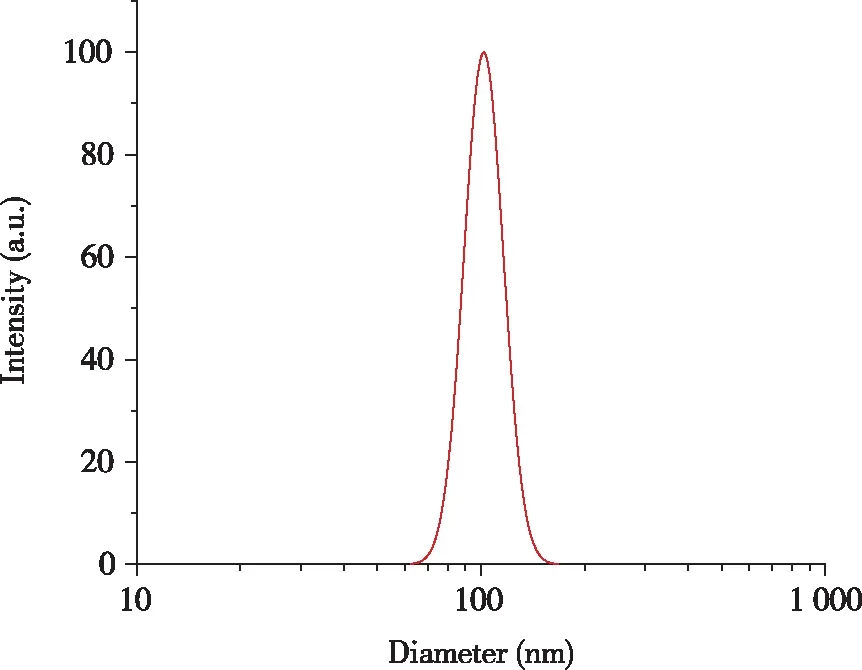
图7 紫杉醇/姜黄素双载药脂质体粒径分布
2.5.2 双载药脂质体稳定性考察结果 如图8、9所示,紫杉醇/姜黄素双载药脂质体溶液在4 ℃避光条件下粒度分布均匀,无絮集现象产生,连续7 d测定其粒径和Zeta电位,变化不大,其中第7天测定的粒径为103.97 nm,表明紫杉醇/姜黄素双载药脂质体较为稳定。

图8 双载药脂质体粒径稳定性结果

图9 双载药脂质体Zeta电位稳定性结果
2.5.3 双载药脂质体体外血清稳定性考察结果 由图10可知,紫杉醇/姜黄素双载药脂质体在48 h内浊度没有明显变化,说明脂质体在血清环境中均较为稳定,不会发生明显的聚集或者蛋白吸附现象。这主要是由于PEG亲水层可以屏蔽脂质体的表面电荷,减少与血浆蛋白的相互作用,增加脂质体的稳定性。

图10 紫杉醇/姜黄素双载药脂质体在血清中的稳定性
2.5.4 双载药脂质体形态考察 由图11可知,制得的脂质体形态均匀,大多呈球形或类球形,粒径在100 nm左右。
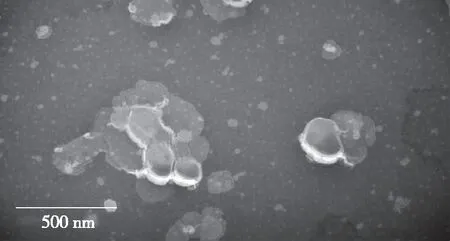
图11 紫杉醇/姜黄素双载药脂质体透射电镜图
3 讨论
脂质体的制备方法常有薄膜分散-超声法、逆向蒸发法、注入法(乙醇注入法、乙醚注入法)等[17-18]。本实验结合文献资料以及预实验结果综合考虑采用薄膜分散-超声法制备紫杉醇/姜黄素双载药脂质体,并采用G50葡聚糖凝胶过柱法测定其包封率。同时前期对成膜温度也进行考察,根据成膜后膜的质量进行评判,温度较低时茄型瓶底部出现凝集,温度过高则膜周围出现空洞现象,同时为兼顾两者的包封率以及粒径等因素最终选择在25℃条件制备脂质体。在磷脂种类考察时发现HSPC和EPC包封率相对较低,可能是因为它们均为高饱和度卵磷脂,制备脂质体时会使其磷脂双分子层的流动性降低,从而减少脂质体包载药物的能力。另考察磷脂-胆固醇比例发现随着胆固醇比例不断增高,药物的包封率随之下降,主要是由于胆固醇可使脂质双分子层刚性增加,降低脂质膜流动性,从而降低脂溶性药物的包载。
传统普通脂质体在血液循环中易被网状内皮系统清除,因此本实验加入PEG化磷脂(DSPE-PEG2000-OME)进行修饰以延长其在体内的循环时间。由于PEG 亲水层可以屏蔽脂质体的表面电荷,减少与血浆成分的聚集或蛋白吸附现象,在双载药脂质体体外血清稳定性考察实验中已被证实。经过试验优化制备的复方脂质体为大小均一,形态规整的类球形脂质体,粒径为(107.39±1.68)nm,据文献报道,粒径在100~200 nm的纳米粒子对实体瘤具有更高通透性和更强的EPR效应[14]。紫杉醇/姜黄素双载药脂质体既可以被动靶向到肿瘤组织,提高其在肿瘤部位的药物浓度,又可以在肿瘤部位缓慢发挥紫杉醇的抗肿瘤作用和姜黄素抑制肿瘤多药耐药的作用,从而达到双载药的目的。本文主要研究了紫杉醇/姜黄素双载药脂质体的处方工艺和相关药剂学性质,为后续体内评价提供实验基础。

