羊肚菌胞外多糖体外降血糖降血脂活性研究
(合肥工业大学食品与生物工程学院,安徽合肥230009)
羊肚菌是一种名贵食用药用真菌,于1818年被发现,由于菌盖表面凹凸不平,具有很多褶皱,形似羊肚而得名。羊肚菌不仅营养丰富,滋味鲜美,而且还具有较高的药用价值。中医理论认为羊肚菌具有“益肠胃,化痰理气”的功效[1]。现代研究也显示,羊肚菌具有一定的调节人体免疫能力,预防感冒等效果。因此,有必要对羊肚菌活性物质展开深入研究。
羊肚菌子实体主要通过野外采集获得,资源有限,价格也较高。目前羊肚菌的人工栽培技术还不成熟,同时培养周期长,成本较高,限制了对于羊肚菌活性物质的进一步研究。采用液体深层发酵的技术可以大量、低成本获得真菌菌丝体,同时有利于分离提取纯化包括胞外多糖在内的多种活性物质,因此可以利用液体深层发酵技术研究羊肚菌活性产物[2]。前期研究结果显示,利用羊肚菌子实体获得的子实体多糖具有较强的降血脂活性[3]。而羊肚菌胞内多糖可以显著降低四氯化碳引起的小鼠血清谷丙转氨酶、谷草转氨酶浓度上升,降低肝脏丙二醛(malondialdehyde,MDA)含量,提高超氧化物歧化酶(superoxide dismutase,SOD)活性,具有较强的肝脏保护能力[4]。羊肚菌多糖还可以有效刺激淋巴细胞的增殖,提高巨噬细胞的吞噬能力,具有显著的免疫调节作用[5]。前期研究表明粒毛盘菌等真菌通过深层发酵可以产生大量的胞外多糖,并具有抗氧化、降血糖等生物活性[6-8]。也有相关研究指出,深层发酵羊肚菌可以获得大量胞外多糖,同时有不少文献对羊肚菌深层发酵的工艺参数进行了调查和优化[9-10]。但是对于羊肚菌胞外多糖的生物活性的研究报道较少。
本研究采用液体深层发酵技术培养羊肚菌菌丝体,分离纯化获得羊肚菌胞外多糖,研究羊肚菌胞外多糖的降血糖和降血脂活性,为开发相关保健食品或药品提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
羊肚菌由上海农科院食用菌研究所提供,保藏于合肥工业大学微生物资源与应用研究室。葡萄糖、蛋白胨、酵母膏、氯仿、正丁醇:天津市博迪化工有限公司;可溶性淀粉、3,5-二硝基水杨酸(3,5-dinitro salicylic acid,DNS)、四水合酒石酸钾钠、牛磺胆酸钠(sodium taurocholate,ST)、甘氨胆酸钠(sodium glycocholate,SG)、聚乙烯醇、橄榄油、胰脂肪酶(30 000 U/g)、胃蛋白酶(2 500 U/mg)、α-淀粉酶(2 000 U/g)、阿卡波糖:国药集团化学试剂有限公司;α-葡萄糖苷酶(300 000 U/g)、对硝基苯-α-D-葡萄糖苷(4-nitrophenyl α-D-glucopyranoside,PNPG):阿拉丁试剂公司;浓盐酸、浓硫酸、苯酚:上海中成化学试剂有限公司;化学试剂均为市售分析纯。
1.2 仪器与设备
752型紫外可见分光光度计:上海菁华仪器有限公司;AR1140型电子分析天平:奥毫斯国际贸易(上海)有限公司;HH-2型数显恒温水浴锅:金坛市江南仪器厂;TDL-50B型台式离心机:上海安亭科学仪器厂;SW-CJ-ICU型超净工作台:上海博讯实业有限公司;250 D数显光照培养箱:江苏省正基仪器有限公司;RE-85旋转蒸发仪:上海青浦沪西仪器厂;FD-1B-50冷冻干燥机:北京博医康实验仪器有限公司;680 i-Mark酶标仪:美国伯乐公司。
1.3 方法
1.3.1 羊肚菌发酵液的制备以及发酵条件
根据相关文献,确定发酵液配方和发酵条件[11]。液体发酵培养基:葡萄糖20 g/L,酵母膏5 g/L,蛋白胨5 g/L。配制3 L,分装于20个250 mL锥形瓶中,用高压蒸汽灭菌锅121℃下灭菌20 min。待冷却至室温(25℃),在超净工作台内将保藏良好的羊肚菌菌种接种于装有液体培养液的锥形瓶中,置于摇床内在25℃条件下摇动4 d,摇床转速为160 r/min。
1.3.2 生物量测定
在250 mL锥形瓶中接种定量的羊肚菌,摇床培养。培养一定时期,将发酵液抽滤,菌丝体用蒸馏水清洗2次~3次后于60℃干燥箱中烘干至恒重,称重换算为菌体干重,并记录不同发酵时间的生物量结果(生物量=菌体干重/发酵液体积)。
1.3.3 羊肚菌粗多糖(Morchella esculenta polysaccharides,MEP)分离与纯化
发酵结束后,将发酵液抽滤,滤液抽入旋转蒸发仪中,利用真空泵抽真空于60℃条件下浓缩,直到留下100 mL左右的浓缩液。向得到的发酵液浓缩液中加入3倍体积的95%乙醇溶液,在4℃条件下醇沉24 h。然后在25℃条件下在4 000 r/min离心10 min,取沉淀物,即为羊肚菌粗多糖。
粗多糖脱蛋白采用Sevage法。向多糖溶液中加入1/3体积的Sevage试剂(氯仿、正丁醇溶液体积比5∶1),混合物剧烈振摇20 min,静置20 min,反复操作5次~6次。之后置于分液漏斗中静置分液,分去水层与溶剂层交界处的变性蛋白。重复以上操作至水相与溶剂相的交界面无胶状变性蛋白质(即乳白色分界)时,即为脱蛋白结束。
脱蛋白结束后,用H2O2对多糖溶液进行脱色处理,向多糖溶解液中加入其体积1/10的浓度为30%的H2O2,50℃保温脱色1 d,期间每隔12 h补充一次H2O2,脱色最终得到淡黄色的溶液。
将脱蛋白、脱色处理后的多糖水溶液放进透析袋(直径25 mm、截留分子量3 500 Da)中,用自来水反向流动透析48 h。自来水透析之后再用蒸馏水透析24 h。最后将透析后的多糖溶液进行旋蒸器浓缩,体积浓缩到100 mL以下,多糖溶液放入-80℃冰箱中冷冻24 h。之后将冷冻24 h的多糖溶液置于冻干机中处理24 h,最终得到羊肚菌多糖。
MEP过DEAE-纤维素52凝胶柱处理,对羊肚菌胞外多糖进行分级分离。采用苯酚-硫酸法测多糖含量,取 40 μL 羊肚菌多糖溶液、40 μL 6%的苯酚、200 μL浓硫酸于96孔板中混匀,静置10 min,在25℃中保温20 min,490 nm处测吸光度。对照葡萄糖标准曲线,求得多糖含量。
1.3.4 MEP对α-葡萄糖苷酶和α-淀粉酶抑制活性
参照文献检测MEP对α-葡萄糖苷酶的抑制活性[12]。将 100 μL 的 α-葡萄糖苷酶(0.5 U/mL)添加到50 μL的样品溶液中,并在37℃下孵育10 min。然后向每个样品溶液中加入100 μL的PNPG(5 mmol/L),并在37℃下孵育20 min。加入1 mL的碳酸钠溶液(1 mol/L)终止反应。阿卡波糖作正对照。在405 nm处测量了吸光度,并使用以下方程计算α-葡萄糖苷酶的抑制率:
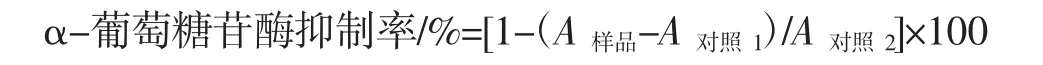
式中:A对照1是PNPG溶液和样品的混合物的吸光度;A对照2是PNPG和酶的混合物的吸光度。
参照文献检测MEP对α-淀粉酶抑制活性[12]。首先将0.4 mL的α-淀粉酶(2 U/mL)溶液在37℃下与0.2 mL多糖溶液预混合10 min。然后,加入0.3 mL的淀粉溶液(5%),反应10 min后,加入2 mL的DNS试剂(10 mg/mL 3,5-二硝基水酸和120 mg/mL酒石酸钾钠溶于0.4 mol/L的氢氧化钠溶液)以终止试验,并在100℃加热15 min。冷却后,在540 nm处测量吸光度。α-淀粉酶抑制活性的计算如下:
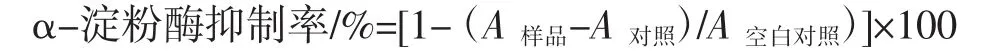
式中:A样品、A对照和 A空白对照分别定义为样品、对照和样品空白对照的吸光度;阿卡波糖作为对照。
1.3.5 MEP对脂肪酶抑制活性
参照相关文献测得MEP对胰脂肪酶活性的抑制能力[13]。在试管中加入5 mL磷酸缓冲盐溶液(pH7.4)、4 mL聚乙烯醇为乳化剂和橄榄油为油相的底物乳化液(0.229 g/mL),同时加入一定浓度的MEP多糖溶液进行混合,混合液37℃水浴孵育10 min,然后加入1 mL胰脂肪酶液(2 mg/mL),反应 15 min,加 95%乙醇15 mL终止酶反应。滴加酚酞,用NaOH标准溶液滴定至微红色。空白试验的酶液在反应终止后加入。脂肪酶抑制活性的计算如下:
脂肪酶活性抑制率/%=(不加MEP酶活性-加入MEP酶活性)/不加MEP酶活性×100
1.3.6 MEP对胆酸盐结合能力试验(模拟肠道环境)
根据前期研究方法,检测MEP对胆酸盐结合能力判断其降血脂活性[6]。首先利用甘氨胆酸钠和牛磺胆酸钠绘制胆酸盐标准曲线,然后在模拟肠道环境下检测MEP与胆酸盐结合能力,判断其体外降血脂活性。
取不同浓度的标准溶液(甘氨胆酸钠0.03、0.06、0.12、0.18、0.24、0.30 mmol/L,牛磺胆酸钠 0.05、0.10、0.15、0.20、0.25、0.30 mmol/L)2 mL 于具塞试管中,加入6 mL质量分数60%的H2SO4,于70℃水浴20 min,后冰浴5 min,在387 nm波长处测定吸光度。
以胆酸盐含量为横坐标,吸光度为纵坐标绘得胆酸盐含量标准曲线。
取3 mL MEP溶液于具塞锥形瓶中,加入3 mL 10 mg/mL胃蛋白酶(溶于pH 6.3的0.1 mol/L磷酸盐缓冲液),1 mL0.01mol/L的HCl,在37℃下恒温振荡消化1 h,模拟胃消化过程。随后,用0.1 mol/L的NaOH溶液调节溶液pH值至6.3,后加入4 mL 10 mg/mL胰蛋白酶,在37℃条件下,恒温振荡消化1 h,模拟肠道环境进行消化。每个样品中加入4 mL 0.4 mmol/L甘氨胆酸钠、0.5 mmol/L牛磺胆酸钠,在37℃条件下恒温振荡1 h后混合物转移至离心管中,4 000 r/min离心20 min,取上清液,比色法测定甘氨胆酸钠和牛磺胆酸钠含量,每个样品平行3次。胆酸盐结合率计算方法如下:
胆酸盐结合率/%=(胆酸盐加入量-胆酸盐剩余量)/胆酸盐加入量×100
1.3.7 MEP对葡萄糖在溶液中扩散的抑制作用
参照文献,检测MEP对葡萄糖扩散抑制作用[14]。在密封透析袋(截留分子量1 000 Da)中加入含有约0.5 g MEP的葡萄糖溶液(25 mmol/mL)。该混合物浸入含有200 mL的去离子水的烧杯中,将烧杯置于37℃水浴锅中。经过 15、30、60、120、150 min 的透析,采用苯酚-硫酸法检测外部溶液中的葡萄糖量,无样品的混合物作为对照。
1.4 数据处理
所有试验最少重复3次,数据为平均值±标准差,利用Excel处理数据。
2 结果与分析
2.1 深层发酵条件下羊肚菌菌丝体生物量变化
液体培养条件下,培养一定时间后,对发酵液抽滤获得菌丝体并干燥称重,计算生物量。液态深层发酵过程中羊肚菌生物量的变化见图1。
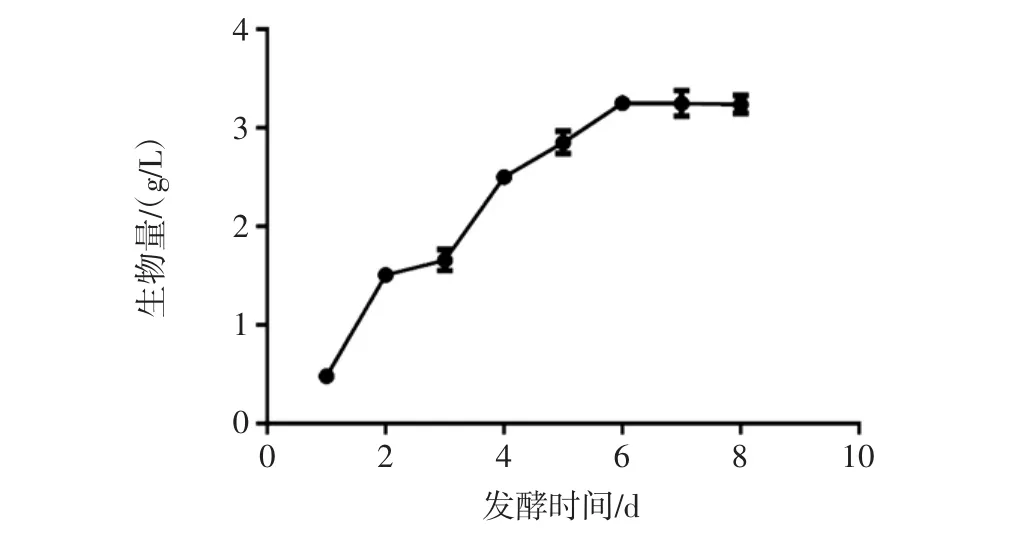
图1 液态深层发酵过程中羊肚菌生物量的变化Fig.1 Biomass change of Morchella esculenta under depth fermentation
由图1可知,在发酵进行的1 d~6 d,羊肚菌发酵液中的生物量缓慢上升,到第6天达到最大值,之后基本稳定在最大值附近。在第6天的时候,羊肚菌生物量最高,为3.2 g/L。本课题组前期研究显示深层发酵条件下粒毛盘菌生物量最大为6 g/L~8 g/L[15]。赵春艳等报道了不同液体培养基配方对于羊肚菌菌丝体生物量的影响,结果显示主要成分为麦麸、黄豆粉、麦芽糖、可溶性淀粉和葡萄糖的培养基中的生物量最大,每200 mL培养基可以获得干重8.48 g的菌丝体[9]。刘生梅报道了不同微量元素对于羊肚菌菌丝体生物量的影响,结果显示,Zn、Cu、Se等微量元素对羊肚菌生长具有刺激作用,生物量可达4 g/L左右,和本试验得到的结果比较接近[16]。因此,认为液体培养条件下,在培养到第6天时即可以结束,进行后续试验。
2.2 MEP的分级分离
对MEP进行脱蛋白、脱色和透析一系列处理后,再使用DEAE-纤维素52进行初步分离纯化。MEP经凝胶柱层析洗脱后得到3个主要的洗脱峰,分别是用蒸馏水、0.2、0.4 mol/L NaCl,3种溶液洗脱得到的多糖曲线见图2。
由图2可知蒸馏水洗脱条件下所得多糖峰面积最大即洗脱含量最多,在0.2 mol/L NaCl洗脱条件下获得的多糖峰面积次之,而0.4 mol/L NaCl洗脱条件下获得的多糖峰面积最小。根据洗脱结构,可以判断MEP主要由不带电荷的中性多糖(即蒸馏水洗脱部分)和带有少量负电荷的酸性多糖(0.2 mol/L NaCl洗脱部分)组成,且MEP中中性多糖的含量要多于酸性多糖的含量。
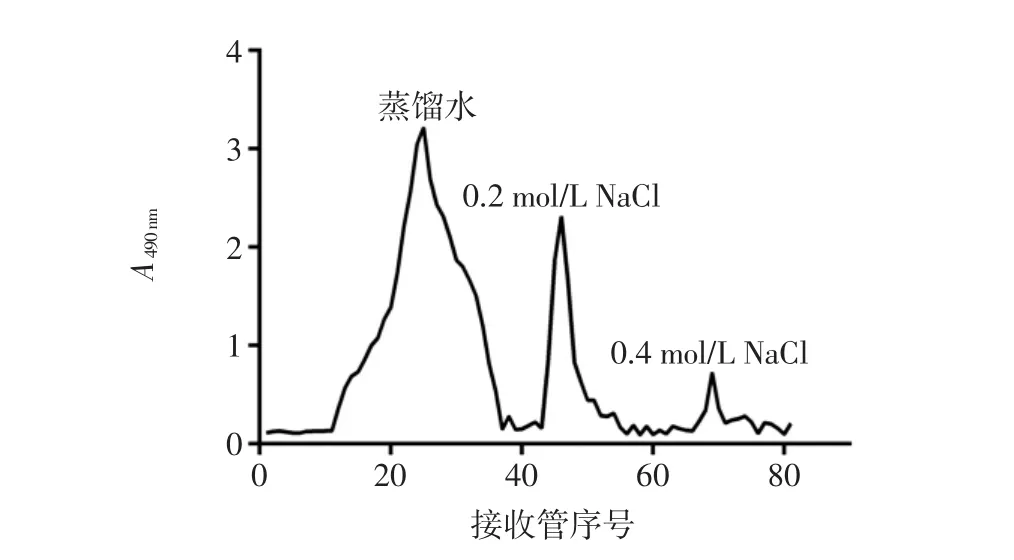
图2 羊肚菌胞外多糖(MEP)的分级分离洗脱曲线Fig.2 Elution curve of MEP using different elution phase
2.3 MEP对α-葡萄糖苷酶和α-淀粉酶的抑制率
α-葡萄糖苷酶可以水解葡萄糖苷键,释放葡萄糖,提高血糖浓度等。抑制α-葡萄糖苷酶的活性可以有效抑制饭后体内血糖上升,同时这也是筛选降血糖药物的常规检测方法,羊肚菌胞外多糖对α-葡萄糖苷酶抑制率见图3。

图3 羊肚菌胞外多糖(MEP)对α-葡萄糖苷酶抑制率Fig.3 Inhibition rate of MEP to α-glucosidase
由图3可知,MEP可以抑制α-葡萄糖苷酶活性,但不如常规药品阿卡波糖抑制率高。需要注意由于阿卡波糖对α-葡萄糖苷酶抑制效果较强,本研究中MEP的浓度为0.1 mg/mL~0.8 mg/mL,而阿卡波糖的浓度为0.01 mg/mL~0.08 mg/mL。在一定浓度范围内,随着MEP浓度增大,其对α-葡萄糖苷酶活性抑制效果越来越明显,但是最后随着浓度增加,其抑制增长率趋于稳定,推测是由于MEP的抑制作用趋于稳定或者饱和导致。多种真菌的多糖都对α-葡萄糖苷酶有一定的抑制作用。朱振等报道了蛹虫草多糖对α-葡萄糖苷酶活性的抑制作用,发现其多糖的抑制作用低于阿卡波糖,半数抑制的时候浓度为4.22 mg/mL,而且当浓度较高时其对α-葡萄糖苷酶活性的抑制作用同样会趋于平缓甚至下降,呈现出饱和的状态,这与本研究结果较为一致[17]。鲁梅等研究了灰树花多糖对α-葡萄糖苷酶的抑制活性,报道的半数抑制浓度为35.79 mg/mL[18]。
α-淀粉酶可以水解食物中的淀粉类物质产生葡萄糖,之后被小肠吸收进入血液,提高血糖浓度。研究表明,抑制α-淀粉酶的活性也是抑制血糖升高和筛选降血糖药物的有效方法之一,羊肚菌胞外多糖(MEP)对α-淀粉酶抑制率见图4。
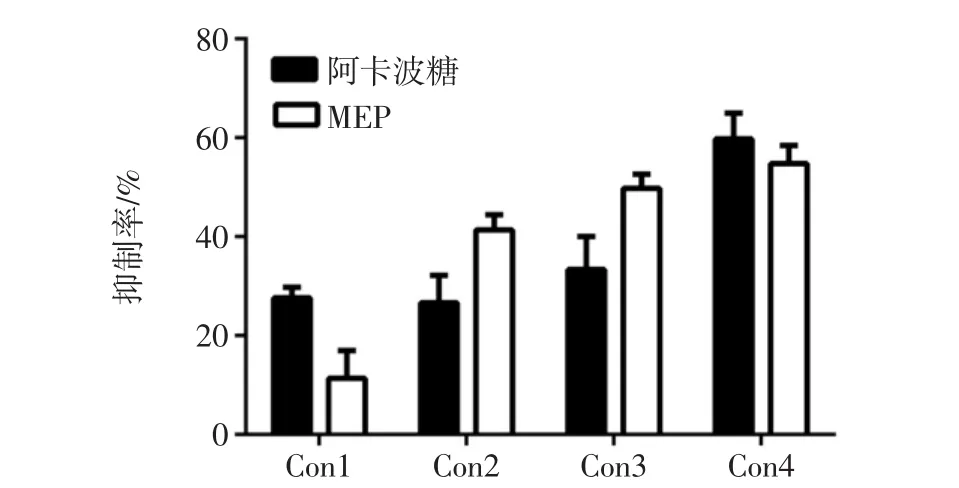
图4 羊肚菌胞外多糖(MEP)对α-淀粉酶抑制率Fig.4 Inhibition rate of MEP to α-amylase
由图4可知MEP具有抑制α-淀粉酶活性的作用,而且在一定范围内,随着多糖浓度增大,其抑制作用越明显。这与图3中显示的结果相似。之后再随着MEP浓度的增加,其对α-淀粉酶的活性的抑制率不再上升,说明MEP对α-淀粉酶的活性抑制作用有饱和效应。影响多糖对α-淀粉酶抑制活性的因素较多,不仅有多糖自身的分子结构和空间构象,同时还包括多糖中杂质的含量。尤玲玲等报道了黄秋葵多糖对α-淀粉酶的抑制活性,研究结果表明相比于粗多糖,经过脱蛋白处理后的多糖其对α-淀粉酶的抑制活性显著降低[19]。
2.4 MEP对脂肪酶抑制率
本研究中MEP的降血脂活性通过对脂肪酶抑制率和胆酸盐结合试验来确定。脂肪酶抑制试验原理是脂肪酶水解油脂产生脂肪酸,游离脂肪酸再与NaOH结合,通过滴定来确定消耗NaOH的量间接确定脂肪酶的活性。多种活性多糖在脂肪酶水解甘油三酸酯反应中起抑制剂作用。羊肚菌胞外多糖(MEP)对脂肪酶抑制率见图5。
由图5可知,在一定范围内,随着MEP浓度增加,其对脂肪酶的抑制作用也增强。在MEP浓度达到5 mg/mL后,其对脂肪酶活性的抑制率达到30%,表现出一定的饱和效应。冉琳等研究了黑木耳多糖对脂肪酶的抑制作用,研究结果显示黑木耳多糖对脂肪酶的最高抑制率为47%左右,之后提高多糖浓度,也没有观测到脂肪酶活性受到进一步的抑制,所以推测黑木耳多糖只是改变脂肪酶的构象,从而达到影响其催化活性的目的,但是不使脂肪酶失活[20]。由于试验结果与冉琳等的试验结果相似,所以推测羊肚菌多糖只是通过改变脂肪酶的构象而不是使脂肪酶失活来达到降低脂肪酶活性的目的。

图5 羊肚菌胞外多糖(MEP)对脂肪酶抑制率Fig.5 Inhibition rate of MEP to lipase
2.5 MEP的胆酸盐结合率
胆酸盐是体内排泄胆固醇的主要途径,大部分胆酸盐经过肠道-肝脏进行回收。而通过结合胆酸盐可以有效排除体内胆汁酸,间接降低胆固醇含量,达到降低血脂的目标。本研究中以甘氨胆酸钠和牛磺胆酸钠作为标准物质,在387 nm下测定其吸光值,制作标准曲线见图6。得到回归方程,分别为y=2.319 4x+0.096 81和y=2.234 5x+0.078 1,相关系数分别为R2=0.996 4和R2=0.991 9。

图6 牛磺胆酸钠和甘氨胆酸钠标准曲线Fig.6 Standard curve of sodium taurocholate(ST)and sodium glycocholate(SG)
分别制备 1.6 μmol/mL和2.0 μmol/mL的甘氨胆酸钠和牛磺胆酸钠溶液作为检测MEP对胆酸盐结合率的标准溶液,结果见图7。
如图7所示,MEP对两种胆酸盐都有一定的结合能力,当MEP的浓度达5 mg/mL时,牛黄胆酸钠的结合率达到了35%左右,甘氨胆酸钠也达到了30%左右。羊肚菌多糖的胆酸盐结合率和杨青松等报道的水溶性红雪茶多糖结合胆酸盐率相似[21],但是要低于王振宇等报道的黑木耳多糖的胆酸盐结合率[22]。

图7 羊肚菌胞外多糖(MEP)与牛磺胆酸钠和甘氨胆酸钠的结合率Fig.7 Binding rate of MEP with sodium taurocholate(ST)and sodium glycocholate(SG)
2.6 MEP对葡萄糖扩散的影响
葡萄糖在小肠中的扩散速率对其吸以及血糖升高均有影响。部分多糖溶液可以延缓葡萄糖在血液中的扩散,从而达到抑制血糖升高的作用。MEP对葡萄糖扩散的抑制作用见图8。

图8 羊肚菌胞外多糖(MEP)对葡萄糖扩散的抑制作用Fig.8 Inhibition ability of MEP on glucose
由图8可知,与对照组相比,MEP可以有效抑制葡萄糖扩散速率,说明MEP具有抑制葡萄糖吸收的功能。前期对于粒毛盘菌多糖的研究结果显示粒毛盘菌多糖可以抑制葡萄糖的扩散,同时通过化学修饰,可以提高其对于葡萄糖扩散的抑制作用,说明多糖的结构对葡萄糖的结合或者扩散抑制具有一定的影响[23]。
3 结论
本研究对羊肚菌胞外多糖进行了分离纯化,并对其体外降血糖和降血脂活性进行了研究。结果显示通过液体深层发酵可以获得羊肚菌胞外多糖(MEP),在脱蛋白和脱色透析后,MEP主要成分为中性多糖,且包含少量的酸性多糖。同时,MEP对α-葡萄糖苷酶和α-淀粉酶活性具有一定的抑制作用,在较高浓度条件下,MEP对α-葡萄糖苷酶和α-淀粉酶的抑制率分别达到53.13%和54.76%,MEP对两种胆酸盐也具有一定的结合能力,并且呈现计量依赖效应,MEP对胰脂肪酶的抑制率在较高浓度(5 mg/mL)也可以接近30%,并且可以在一定程度上抑制葡萄糖的扩散。以上结果显示,MEP具有较强的降血糖和降血脂活性,但其在体内的作用效果和机理还需要进一步的研究。

