脑胶质瘤组织中肿瘤坏死因子受体1、丙酮酸脱氢酶复合物E2的表达变化及其临床意义
柴宇飞,康凯,赵德强
铁岭市中心医院,辽宁铁岭112000
脑胶质瘤是最常见的脑部肿瘤,占中枢神经系统肿瘤的40%以上[1]。研究[2]显示,恶性脑胶质瘤患者的总体中位生存期约为15个月,预后较差,而复发、化疗耐药性及脑胶质瘤细胞高度侵袭的特性是影响其预后的重要因素[3,4]。脑胶质瘤的具体发病机制尚未明确,因此研究脑胶质瘤分子和基因的变化,寻找脑胶质瘤潜在治疗靶点,对改善患者预后至关重要。肿瘤坏死因子受体1(TNFR1)是肿瘤坏死因子受体家族成员。研究[5,6]报道,TNFR1在胰腺癌和慢性淋巴细胞白血病等多种肿瘤中高表达,并参与凋亡、增殖和侵袭转移等生物学过程。丙酮酸脱氢酶复合物E2(PDC-E2)为调节糖代谢的关键酶亚基,目前其在肿瘤恶性生物学行为中的作用未知。研究[7]显示,肿瘤快速增殖需要大量的能量,包括有氧糖酵解和氧化磷酸化,提示PDC-E2与肿瘤的发生发展密切相关。本研究通过检测脑胶质瘤组织中TNFR1、PDC-E2的表达情况,分析两者与脑胶质瘤患者临床病理参数及预后的关系,现报告如下。
1 资料与方法
1.1 临床资料 选取2012年1月~2014年8月铁岭市中心医院收治的脑胶质瘤患者79例,患者男43例、女36例,年龄15~76(43.25±22.83)岁,<50岁者28例,≥50岁者51例,肿瘤直径>5 cm者47例、≤5 cm者32例,病理类型为星形细胞瘤40例、胶质母细胞瘤39例,侵犯脑叶数<2个者49例、≥2个者30例,WHO肿瘤分级Ⅰ~Ⅱ级55例、Ⅲ级24例。患者均接受手术治疗,术中留取脑胶质瘤组织及癌旁组织(距癌组织3 cm处)。纳入标准:①首次手术并且术前未接受任何形式的抗肿瘤治疗;②术后经病理认证为脑胶质瘤;③病例和随访资料完整。排除标准:①合并其他肿瘤;②患有严重急危重症病;③合并其他脑部疾病。本研究患者均签署知情同意书,且经医院伦理委员会审核通过。
1.2 脑胶质瘤组织及癌旁组织中TNFR1、PDC-E2检测方法 采用免疫组织化学法。取脑胶质瘤组织及癌旁组织样本,福尔马林液固定过夜,石蜡包埋、切片(厚度为4 μm)、二甲苯脱蜡、乙醇水化,在枸橼酸钠溶液中沸水高压进行抗原修复3 min,放置于3%过氧化氢甲醇溶液中室温避光30 min,加入非免疫羊血清室温孵育1 h,滴加一抗工作液(TNFR1稀释比为1∶1 000,PDC-E2稀释比为1∶100,以PBS替代一抗作阴性对照),4 ℃孵育过夜,PBS洗涤3次、每次5 min,滴加二抗(稀释比为1∶200),37 ℃孵育30 min,PBS洗涤3次,每次5 min,加入3,3′-二氨基联苯胺四氢氯化物显色,苏木素染色,冲洗完全后乙醇脱水、干燥、二甲苯透明和封片,显微镜下观察并计算阳性表达率。阳性表达率=阳性表达组织标本数量/组织标本总数量×100%。TNFR1、PDC-E2在脑胶质瘤组织及癌旁组织中阳性染色均为棕黄色,TNFR1主要位于细胞膜,PDC-E2主要位于细胞质。按阳性细胞所占比例和染色程度综合计分,其中无阳性细胞为0分,1%~25%为1分,25%~50%为2分,50%~75%为3分,75%~100%为4分;无阳性着色为0分,浅棕黄色为1分,深棕黄色为2分,棕黄色为3分;二者之和≤3分为阴性表达,>3分为阳性表达。
1.3 随访及预后分析 对患者进行专业随访,随访时间为手术后1~60个月,方式为电话及门诊跟踪访问,患者死亡或者时间截止时终止随访。根据脑胶质瘤组织中TNFR1、PDC-E2检测结果,将患者分为TNFR1阳性表达组、TNFR1阴性表达组和PDC-E2阳性表达组、PDC-E2阴性表达组,分析TNFR1、PDC-E2阳性表达与脑胶质瘤患者预后的关系。
1.4 统计学方法 采用SPSS12.0统计软件。计数资料比较用χ2检验,相关性分析采用Pearson相关分析法。采用Kaplan-Meier生存曲线法分析TNFR1、PDC-E2阳性表达与脑胶质瘤患者预后的关系,组间生存率比较用Logrank检验。P<0.05为差异有统计学意义。
2 结果
2.1 脑胶质瘤组织及癌旁组织中TNFR1、PDC-E2阳性表达率比较 脑胶质瘤组织中TNFR1、PDC-E2阳性表达率分别为70.89%(56/79)、64.56%(51/79),癌旁组织中TNFR1、PDC-E2阳性表达率分别为36.70%(29/79)、46.83%(37/79),两者相比,P均<0.05。
2.2 脑胶质瘤组织中TNFR1、PDC-E2阳性表达的相关性 脑胶质瘤组织中TNFR1、PDC-E2阳性表达呈正相关关系(r=0.653,P<0.05)。
2.3 TNFR1、PDC-E2阳性表达与脑胶质瘤患者临床病理参数的关系 TNFR1、PDC-E2阳性表达与脑胶质瘤患者临床病理参数的关系见表1。由表1可知,TNFR1、PDC-E2阳性表达与脑胶质瘤患者肿瘤直径、WHO肿瘤分级有关(P均<0.05),而与年龄、性别、病理类型、侵犯脑叶数无关(P均>0.05)。
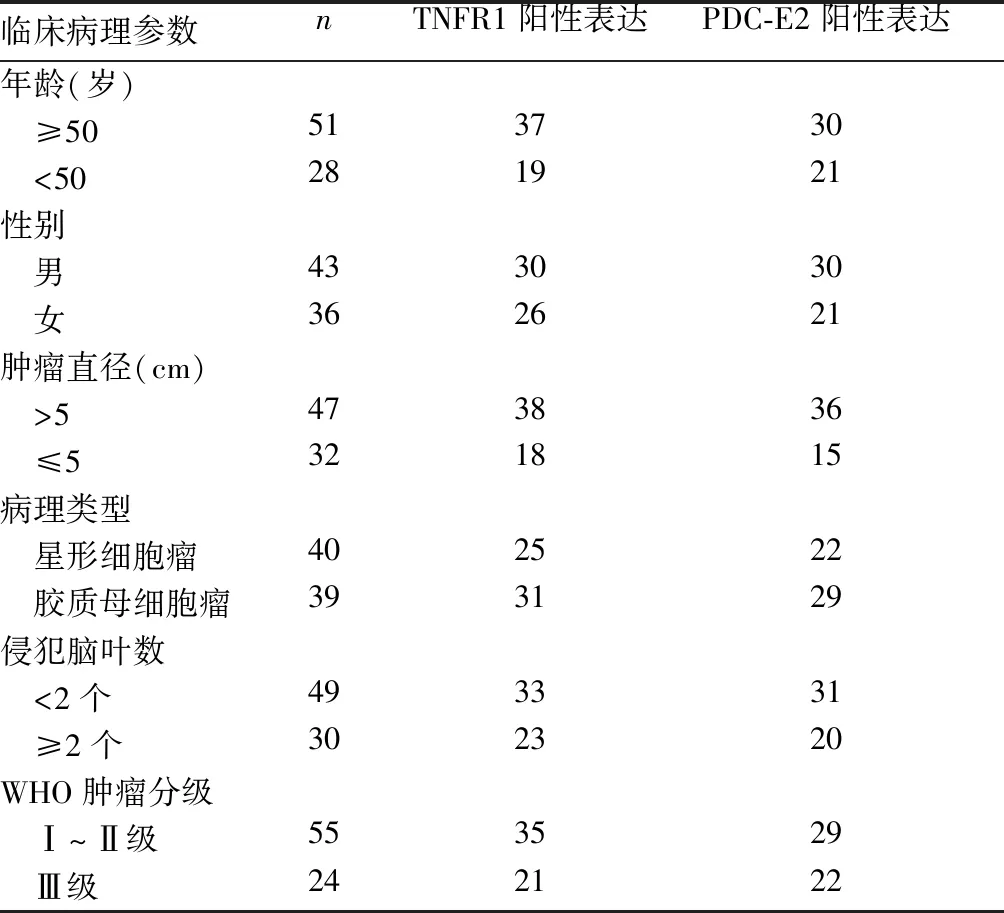
表1 TNFR1、PDC-E2阳性表达与脑胶质瘤患者临床病理参数的关系(例)
2.4 TNFR1、PDC-E2阳性表达与脑胶质瘤患者预后的关系 TNFR1阳性表达组56例、TNFR1阴性表达组23例,Kaplan-Meier分析结果显示,TNFR1阳性表达组5年生存率为30.36%,TNFR1阴性表达组5年生存率为65.22%,两组相比,P<0.05。PDC-E2阳性表达组51例、PDC-E2阴性表达组28例,Kaplan-Meier分析结果显示,PDC-E2阳性表达组5年生存率为31.37%,PDC-E2阴性表达组5年生存率为57.14%,两组相比,P<0.05。
3 讨论
脑胶质瘤是最常见的中枢神经系统肿瘤,发病率每年增加3%,发病人群也逐渐年轻化。脑胶质瘤治疗方式主要是化学治疗,近年来虽然术后放疗、化疗及免疫治疗的联合应用取得了一定的疗效,但是由于脑胶质瘤细胞具有生长快、易沿白质纤维侵袭、浸润蔓延的特性,使得脑胶质瘤患者复发率极高,导致患者预后较差。目前,脑胶质瘤具体发病机制仍然未知,随着科学技术的不断进步,尤其是基因技术的研究,脑胶质瘤分子水平的发病机制也取得了一定进展。因此,研究与脑胶质瘤发病密切相关基因的变化,对寻找治疗脑胶质瘤候选靶点提供了理论依据。
TNFR是炎性细胞因子肿瘤坏死因子-α(TNF-α)的受体,TNF-α主要作用为调控血管内皮生长因子(VEGF)的表达,VEGF在肿瘤的增殖、侵袭转移中发挥重要作用。研究[8]报道,TNF-α在乳腺癌、肺癌、卵巢癌等多种恶性肿瘤的发生发展以及侵袭转移中均有重要作用。而TNF-α调节肿瘤生物学恶性行为需要与两个不同的受体TNF-α的受体1(TNFR1)和TNF-α的受体2(TNFR2)的结合,TNFR1广泛表达于所有细胞中,TNFR2仅在免疫细胞表面表达,且TNFR1在介导下游信号通路的活化作用明显较强。同时研究[9]表明,TNFR1在宫颈癌、乳腺癌和肝癌等多种恶性肿瘤中高表达。同时一项较大的前瞻性临床研究[10]表明,脑胶质瘤患者血浆中可溶性TNFR1水平升高的患者生存期较短。本研究发现,TNFR1阳性表达率在脑胶质瘤患者组织标本中增加,在WHO肿瘤分级级别较高及直径较大的脑胶质瘤患者组织中TNFR1阳性表达率较高。TNFR1作为TNF-α的主要受体,而TNFR1受TNF-α的调节参与肿瘤的发生,因此TNFR1可能是与TNF-α结合调控多条信号途径而参与脑胶质瘤的进展。生存曲线结果显示,TNFR1阳性表达者生存期较短,提示TNFR1在脑胶质瘤中可能发挥促癌作用,可能是脑胶质瘤患者预后不良的分子标志物。
肿瘤快速增殖需要大量的能量,能量的产生包括有氧糖酵解和氧化磷酸化代谢过程,而肿瘤的代谢也是近几年的研究热点,其中代谢关键酶是催化糖酵解的关键。PDC-E2为调节糖代谢的关键酶亚基,将丙酮酸转化为乙酰辅酶A,用于线粒体呼吸的氧化磷酸化。同时,PDC-E2作为线粒体内膜上的抗原,表达于所有有核的细胞中,PDC-E2在凋亡的细胞中会降解,而PDC-E2降解出现异常时可引起自身免疫性疾病。PDC-E2在肿瘤中的恶性进展研究甚少,新近研究[11]表明,PDC-E2可以与信号转导子和转录激活子5(STAT5)直接结合,而JNK/STAT信号通路参与调节肿瘤恶性行为,包括促进增殖、促进侵袭转移、抑制凋亡等多种过程,因此PDC-E2可能参与肿瘤的发生发展。本研究结果表明,PDC-E2阳性表达率在脑胶质瘤患者中升高,生存曲线结果显示,PDC-E2阳性表达者生存期较短,且在WHO肿瘤分级级别较高及直径较大的脑胶质瘤患者组织中PDC-E2阳性表达率高,提示PDC-E2在脑胶质瘤中可能发挥促癌作用,可能是脑胶质瘤患者预后不良的分子标志物。
同时,本研究结果显示,TNFR1与PDC-E2在脑胶质瘤组织中的阳性表达成正相关。林素平等[12]报道,TNFR1和PDC-E2在脑胶质瘤细胞中共同促进细胞的凋亡,具有协同作用,与本研究的结果具有一定的相似性。但是,本研究未在细胞水平对TNFR1与PDC-E2在脑胶质瘤细胞中发挥的具体作用进行研究,后续仍需进行探讨。此外,本研究的实验样本数量较少,仍需扩大样本量深入进行验证,以得到更可靠的结论。
综上所述,与癌旁组织相比,脑胶质瘤组织中TNFR1、PDC-E2阳性表达率升高;脑胶质瘤组织中TNFR1、PDC-E2阳性表达呈正相关关系,并与肿瘤直径、WHO肿瘤分级有关,TNFR1、PDC-E2阳性表达的脑胶质瘤患者术后生存率较低。TNFR1及PDC-E2在促进脑胶质瘤发生发展中可能发挥协同作用,可能是评估脑胶质瘤预后的分子标志物和治疗潜在靶点。

