小梁切除术前应用玻璃酸钠滴眼液对术后眼表恢复的促进作用
王阜蕾 朱海峰
青光眼是导致人类失明的三大原因之一,病理性高眼压是目前唯一明确导致青光眼发生和发展的致病因素[1]。通过抗青光眼药物或手术来降低眼压、阻止或减缓视神经损害是其主要的治疗手段。但是在治疗青光眼的同时也会出现一些并发症,临床上最常见的就是药物或手术对眼表的损伤。研究表明,长期使用抗青光眼药物可导致患者泪膜稳定性下降、泪液分泌减少、角膜上皮细胞凋亡、结膜上皮细胞鳞状化生和杯状细胞减少,从而出现干燥、异物感等不适症状[2];而抗青光眼手术则通过机械损伤、术后炎症反应、滤过泡干扰等方式影响泪液的分泌、分布和组成,进一步促进干眼的发生和发展[3]。目前,应用人工泪液中和抗青光眼药物的眼表毒性和改善抗青光眼术后干眼症状的报道已有很多,但术前人工泪液干预对术后泪膜的影响却缺乏系统的研究。我们对青光眼患者小梁切除术前应用3 g·L-1玻璃酸钠滴眼液,评价其对术后眼表恢复的作用,现报告如下。
1 资料与方法
1.1 一般资料前瞻性病例对照研究。选取2017年1月至2018年3月于我院住院首次行小梁切除术治疗的原发性慢性闭角型青光眼和原发性开角型青光眼患者52例63眼,其中男23例,女29例,年龄42~67 (54.36±9.32)岁。纳入标准:(1)符合原发性开角型青光眼和原发性慢性闭角型青光眼诊断,拟行小梁切除术的患者;(2)年龄40~70岁;(3)术后不使用任何降眼压药物眼压为10~21 mmHg(1 kPa=7.5 mmHg)。排除标准:(1)有眼部手术史;(2)合并眼睑病变、角膜病变、结膜病变或葡萄膜炎等眼部病变;(3)合并糖尿病、甲状腺疾病、自身免疫性疾病,或除抗青光眼药物外使用过其他影响泪液分泌或泪膜稳定性的药物。本研究遵循医学伦理学原则,经医院伦理委员会审核批准,告知患者检查和治疗的目的,所有患者均签署知情同意书。
1.2 患者分组及处理52例(63眼)青光眼患者根据随机数字表法分为干预组和对照组。其中干预组25例(31眼),男11例,女14例,年龄(56.12±8.62)岁;对照组27例(32眼),男12例,女15例,年龄(53.85±9.16)岁。两组患者间年龄、性别构成比差异均无统计学意义(均为P>0.05)。干预组从术前1周即开始给予3 g·L-1玻璃酸钠滴眼液[规格:5 mL:15 mg,参天制药(中国)有限公司],观察组则从术后1 d开始给予3 g·L-1玻璃酸钠滴眼液。用法均为每天滴眼4次,术后1个月停药。
1.3 手术方法所有患眼均行小梁切除术,且手术均由同一位经验丰富的医师完成。具体步骤为:患眼上方做以角巩膜缘为基底的结膜瓣及1/3~1/2厚度的梯形巩膜瓣,结膜瓣下放置20 g·L-1丝裂霉素C棉片1~2 min,充分冲洗后切除小梁组织3 mm×2 mm,并做相应部位的虹膜根部切除,巩膜瓣置可调节缝线。术后局部滴用妥布霉素地塞米松滴眼液。
1.4 观察指标所有患眼均由同一位医师分别于术前1周及术后1周、1个月和3个月进行观察评估。每次检查均选择在上午900~1000,安静、暗光环境下进行,检查室保持温度(25±2)℃、湿度41%±6%。观察项目:(1)眼表症状评分:患者根据最近1周症状填写眼表疾病指数(ocular surface disease index,OSDI)问卷调查,该问卷包括12个问题,共100分,其中<12分为正常。(2)裂隙灯显微镜眼前节检查:观察滤过泡形态、结膜充血、前房反应、角膜透明度及完整性等。(3)角膜荧光染色评分:用无菌生理盐水湿润荧光素试纸条,将浸湿部分轻轻接触患者下方睑结膜,嘱其自然瞬目数次后平视正前方,在裂隙灯显微镜钴蓝光下观察角膜上皮着染情况。评分采用 0~12分制,将角膜分为4个象限,每个象限0~3 分。0分:无染色;1分:散在染色点;2分:较密集的染色点;3分:密集染色点或斑片状染色。(4)泪膜破裂时间(tear break-up time,BUT):上述检查完成后,嘱患者再次瞬目数次,然后平视正前方,继续钴蓝光下记录从最后一次瞬目到角膜出现黑斑或黑线的时间。重复3次,取平均值。BUT<10 s 为泪膜不稳定。(5)非表面麻醉性Schirmer Ⅰ:自然状态下将检测滤纸条挂于患者下睑中外1/3交界处5 min,记录滤纸条浸湿长度刻度,得出滤纸条刺激引起的泪液分泌量,用于评估主泪腺的分泌功能。(6)表面麻醉性Schirmer Ⅰ:患者结膜囊内滴 1滴表面麻醉剂,闭眼2 min后重复Schirmer Ⅰ检查,得出的是基础泪液分泌量,用于评估副泪腺的分泌功能。
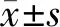
2 结果
2.1 两组患眼术前1周眼表情况比较两组患眼术前均有不同程度干眼症状和体征,但两组间术前OSDI评分、角膜荧光染色评分、BUT、非表面麻醉性SchirmerⅠ和表面麻醉性SchirmerⅠ比较差异均无统计学意义(均为P>0.05)。见表1。

表1 两组患眼术前1周眼表情况比较
2.2 两组患眼术后1周眼表情况比较两组患眼术后均无滤过泡渗漏、浅前房等不良反应发生;术后2周~1个月拆除巩膜瓣可调节缝线。5例(6眼)术后早期眼压为24~30 mmHg,经滤过泡按摩后眼压稳定在13~16 mmHg。术后1周,干预组和对照组患眼干眼症状均较术前加重,且对照组症状加重更为显著;干预组OSDI评分和角膜荧光染色评分均较术前增加,差异均有统计学意义(P=0.044、0.016),BUT、非表面麻醉性SchirmerⅠ和表面麻醉性SchirmerⅠ均较术前减少,但差异均无统计学意义(P=0.108、0.062、0.122);对照组OSDI评分和角膜荧光染色评分均较术前明显增加,BUT较术前缩短,差异均有统计学意义(P=0.013、0.005、0.009),非表面麻醉性SchirmerⅠ和表面麻醉性SchirmerⅠ也较术前减少,但差异均无统计学意义(P=0.232、0.088)。术后1周,干预组OSDI评分、角膜荧光染色评分及BUT均优于对照组,组间比较差异均有统计学意义(均为P<0.05),但非表面麻醉性SchirmerⅠ及表面麻醉性SchirmerⅠ两组间比较差异均无统计学意义(均为P>0.05)。见表2。

表2 两组患眼术后1周眼表情况比较
2.3 两组患眼术后1个月眼表情况比较术后 1个月两组患者干眼症状均较术后1周改善,且以干预组改善明显。术后1个月,干预组和对照组OSDI评分、角膜荧光染色评分均较术后1周下降,差异均有统计学意义(P干预组=0.006、0.002;P对照组=0.006、0.002),BUT均较术后1周增加(P干预组=0.001,P对照组=0.001);两组非表面麻醉性SchirmerⅠ和表面麻醉性SchirmerⅠ均较术后1周略有增加,但差异均无统计学意义(P干预组=0.056、0.062;P对照组=0.106、0.082)。术后1个月,干预组OSDI评分、角膜荧光染色评分和BUT的恢复均优于对照组,组间比较差异均具有统计学意义(均为P<0.01);但非表面麻醉性SchirmerⅠ及表面麻醉性SchirmerⅠ组间比较差异均无统计学意义(均为P>0.05)。见表3。

表3 两组患眼术后1个月眼表情况比较
2.4 两组患眼术后3个月眼表情况比较术后3个月,干预组患眼干眼症状较术后1个月稍改善,但OSDI评分、角膜荧光染色评分、BUT、非表面麻醉性SchirmerⅠ和表面麻醉性SchirmerⅠ与术后1个月比较差异均无统计学意义(P=0.656、0.076、0.152、0.700、0.744);对照组干眼症状则较术后1个月明显改善,OSDI评分、角膜荧光染色评分、BUT与术后1个月比较差异均有统计学意义(P=0.024、0.009、0.042),非表面麻醉性SchirmerⅠ、表面麻醉性SchirmerⅠ与术后1个月比较差异均无统计学意义(P=0.522、0.785)。两组术后3个月OSDI评分、角膜荧光染色评分、BUT、非表面麻醉性SchirmerⅠ及表面麻醉性SchirmerⅠ比较差异均无统计学意义(均为P>0.05)。见表4。

表4 两组患眼术后3个月眼表情况比较
3 讨论
青光眼患者由于长期局部应用降眼压滴眼液以及相关的接触性检查,不可避免地会出现眼表损伤,表现为泪膜稳定性下降、泪液分泌减少、角膜上皮细胞损伤、结膜上皮细胞鳞状化生和杯状细胞减少[2]。本研究中术前患者普遍主诉干眼症状,检查后发现BUT缩短、角膜荧光染色阳性等也证实了上述研究结果。其可能的机制为:(1)抗青光眼药物中的防腐剂苯扎氯胺通过直接破坏泪液脂质层、升高泪液中的炎症因子、对结膜杯状细胞和角膜上皮细胞产生毒性作用等途径对眼表造成不良反应[4-6];(2)抗青光眼药物可引起结膜细胞分泌的炎症介质增多,引起亚临床炎症的产生[7];(3)β受体阻滞剂类抗青光眼药物还能减少结膜杯状细胞数量,抑制角膜上皮细胞增生,降低角膜神经敏感性,导致泪液分泌减少,泪液蒸发过多[8-9]。幸运的是,抗青光眼药物对眼表的这种不良反应是可逆的,在停药或改用不含防腐剂的药物2周后干眼症状即可得到缓解[10-11]。本研究中,所有患眼术后眼压控制稳定,未继续使用降眼压药物,故术后眼表的异常考虑主要与抗青光眼手术有关。
术前表面麻醉剂的防腐剂成分导致眼表上皮细胞损伤[12],手术切口的机械性损伤导致结膜杯状细胞减少和上半角膜去神经支配,术中抗代谢药物的应用导致邻近角结膜上皮细胞增殖抑制,术后功能性滤过泡的干扰导致泪膜涂布和成分异常[3],这些都是小梁切除术后眼表损伤的可能机制。本研究中,术后1周患者干眼症状普遍较术前加重,表现为OSDI评分和角膜荧光染色评分增加、BUT缩短和泪液分泌减少,与以往研究结果一致[13-14]。这些眼表的异常必然会导致患眼出现干涩、异物感等不适症状。如何在保证滤过手术成功率的同时,尽可能地减轻患者术后的不适症状,是值得眼科医师深入探讨的问题。目前,多数学者主张术后加用人工泪液,认为它不但可以润滑眼表,促进泪膜修复,而且可以稀释可溶性炎症介质,减轻患者的不适症状[15]。玻璃酸钠是天然高分子化合物,其分子结构和性质与泪液中的黏蛋白相似,易于与泪液发生作用,增加泪膜的稳定性。同时,它还可以与纤维连接蛋白结合,促进上皮细胞的连接和伸展,加速角膜上皮的修复[16]。目前,3 g·L-1玻璃酸钠滴眼液已被广泛应用于抗青光眼术后以改善干眼症状。本研究对照组术后应用3 g·L-1玻璃酸钠滴眼液后眼表指标改善的结果也证实了上述理论。同时我们还发现,术前 1周即开始应用3 g·L-1玻璃酸钠滴眼液的干预组术后1周OSDI评分、角膜荧光染色评分和BUT均优于对照组,表明玻璃酸钠术前干预可以修复青光眼患者术前已经存在的不稳定的泪膜,增加其抵御手术损伤的能力,从而对术后眼表损伤起到一定的保护和预防作用。并且干预组OSDI评分、角膜荧光染色评分和BUT于术后1个月已基本恢复,而对照组术后3个月才得以恢复,可见术前干预还可有效缩短术后眼表修复时间。但是,两组在改善泪液分泌功能方面无明显差别。考虑泪液分泌主要依靠正常的神经反射和结膜杯状细胞的功能,而手术机械性损伤导致的上半角膜去神经状态和结膜杯状细胞减少需要一定的时间修复。因此,有关小梁切除术后泪液分泌功能的恢复有待更大样本量的长期观察。
综上所述,本研究证实小梁切除术确实会影响青光眼患者泪膜的稳定性,导致干眼。3 g·L-1玻璃酸钠滴眼液术前干预可以有效预防和减轻术后眼表损伤,缩短眼表恢复时间,改善干眼症状。临床工作中,在保证滤过手术成功的同时,应当加强对患者眼表结构和功能异常的正确认识与处理,减少相关并发症的发生。

