内质网跨膜蛋白EVA1A对肝细胞癌Huh7细胞生物学行为的影响
杨杰杰 徐倩 杨玉玲 李奕璇 王彬 侯琳 李宁
(1 青岛大学基础医学院生物化学与分子生物学系,山东 青岛 266071; 2 青岛大学附属医院感染科; 3 青岛大学电子信息学院)
肝细胞癌(HCC)是肝脏最常见的原发性恶性肿瘤[1-2]。现阶段肝癌的临床首选治疗方法仍然是早期手术切除,但术后2年复发率高达55%[3-5]。近年来,大规模临床试验证实靶向治疗可显著延长晚期肝癌患者的生存期,靶向治疗被广泛推荐为一线治疗方法[6-7],但是靶向治疗的副作用和耐药性又显著降低了其临床效益[8-10]。因此,寻找新的有效分子靶点已成为HCC靶向治疗研究的主要方向。
内质网跨膜蛋白EVA1A基因是于2007年通过高通量筛选鉴定出来的一种参与细胞程序性死亡的新基因[11-12],定位于人类2号染色体短臂12区(2p12),在各种脊椎动物中的表达高度保守。研究发现EVA1A过表达可诱导细胞自噬和凋亡[13-15]。值得注意的是,与正常组织相比,EVA1A在食管鳞癌、胃腺癌、胰腺癌等人类肿瘤组织中均有明显的下调或不表达[16-17],提示其可能参与了这些肿瘤的发生或进展。目前已有研究发现EVA1A在人胃癌、神经母细胞瘤等肿瘤中具有重要功能[12,18],然而其在HCC中的功能尚未见报道。本研究借助Huh7肝癌细胞模型过表达EVA1A,研究其对Huh7细胞增殖、迁移和凋亡的影响,为进一步探讨EVA1A在肝细胞癌发生发展中的作用及寻找新的HCC治疗靶点奠定基础。
1 材料与方法
1.1 材料
选取2019年在青岛大学附属医院确诊为HCC行手术治疗的患者20例,所有患者均未接受过放疗或化疗。于手术过程中切取HCC患者癌组织及其癌旁正常组织,所有组织样本均经病理组织学检查确诊为肿瘤组织和正常组织。人正常肝细胞L02与人肝细胞癌细胞系Huh7来自于青岛大学基础医学院生物化学与分子实验室。
1.2 试剂与仪器
RIPA蛋白提取试剂盒、DAB显色试剂盒以及MTT试剂(北京索莱宝生物科技有限公司),小鼠抗人EVA1A单克隆抗体及小鼠抗人 GAPDH单克隆抗体(英国Abcam公司),荧光定量PCR试剂盒、RNA反转录试剂盒(北京全式金生物技术有限公司),EVA1A、GAPDH引物 (上海生工生物工程有限公司),Trizol RNA提取试剂盒及DAPI试剂(美国Invitrogen公司)。
1.3 研究方法
1.3.1实时荧光定量PCR(RT-qPCR)检测HCC患者癌组织及其癌旁正常组织中EVA1AmRNA表达水平 将HCC患者癌组织和癌旁正常组织碾碎后用Trizol法提取总RNA,测定两组RNA浓度与纯度,反转录合成cDNA,然后进行RT-qPCR。根据试剂盒使用说明配制反应体系。每个样品设3个复孔,比较HCC患者癌组织和配对癌旁正常组织EVA1AmRNA的相对表达丰度。实验重复3次。以2-△△CT表示样本中mRNA的相对表达量。引物序列见表1。
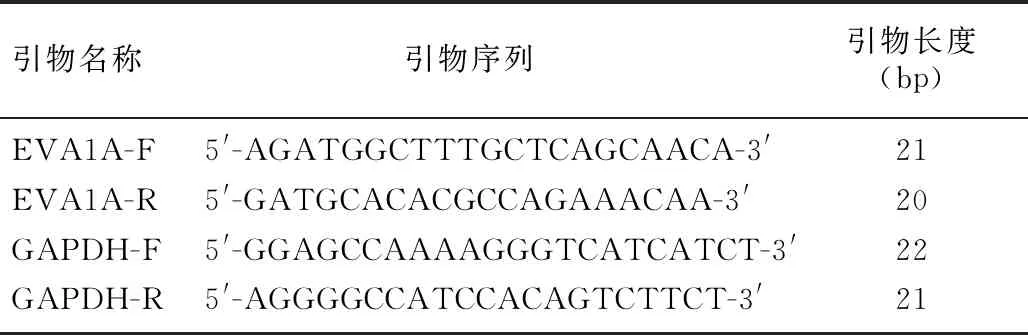
表1 RT-qPCR引物序列
1.3.2免疫组化染色方法测定HCC患者组织中EVA1A蛋白表达 采用自动脱水机对HCC患者癌组织和癌旁正常组织标本进行梯度乙醇脱水,常规石蜡包埋,5 μm厚切片。从20例HCC患者的癌组织和癌旁正常组织样本中随机抽取15例,按照试剂盒说明书进行EVA1A免疫组织化学染色。免疫组织化学染色结果的判断标准:①按切片中阳性细胞数量占总细胞数量的比例进行计分:阴性计0分,阳性细胞比例1%~10%计1分,阳性细胞比例11%~50%计2分,阳性细胞比例51%~75%计3分,阳性细胞比例>75%计4分。②对阳性细胞的染色程度进行计分:不着色计0分,淡黄色计1分,棕黄色计2分,棕褐色计3分。对两项指标计分相乘,对染色结果进行判断:0~2分为阴性(-),3~5分为弱阳性(+),6~8分为阳性(),9~12分为强阳性()。
1.3.3Western blot方法检测细胞系中EVA1A的蛋白表达水平 分别培养正常肝细胞L02细胞、肝细胞癌Huh7细胞,待细胞融合度达90%时,弃掉培养基,用PBS洗涤1次,采用RIPA裂解法提取总蛋白;BCA法测定同时调整蛋白的浓度,加入5×Loading buffer以后加热5 min使蛋白变性。然后SDS-PAGE电泳、转模,封闭2 h,以1∶1 000稀释的鼠抗人EVA1A一抗4 ℃孵育过夜。以GAPDH作为内参照蛋白,TBST洗膜以后,用对应的二抗室温孵育1 h后,重复TBST洗膜步骤,ECL发光显影,使用 ImageG-Pro Plus 6软件分析目的蛋白条带EVA1A和内参蛋白条带GAPDH的灰度值,将目的蛋白条带的灰度值与内参蛋白条带的灰度值进行比较,得出目的蛋白的相对表达量,结果以3次重复实验的均值表示。
1.3.4细胞转染并检测EVA1A过表达水平 将肝癌细胞系Huh7分成2组分别进行转染,对照组转染Myc-tag质粒,实验组转染EVA1A-Myc质粒,参照Lipofectamine 2000说明书正常转染24 h后,采用RIPA裂解法分别裂解两组细胞,提取蛋白,并按照1.3.3中Western blot方法进行EVA1A蛋白表达的检测,然后进行条带的灰度值分析,以相对内参GAPDH的灰度值代表EVA1A蛋白的相对表达水平,结果以3次重复实验的均值表示。
1.3.5MTT法检测Huh7细胞的增殖能力 取转染成功后的实验组和对照组Huh7细胞,消化后接种于96孔板,每组设5个复孔,每孔约4 000个细胞,共铺4个板,从培养12 h开始计时,每24 h任取一板采用MTT法测细胞活力,共检测4 d。每个板在距检测前4 h,每孔加入20 μL质量浓度为5 g/L的MTT试剂,4 h以后弃去培养基,每孔再加入DMS0 150 μL,震荡5 min使甲瓒颗粒完全溶解,然后用酶标仪检测波长490 nm处各孔的吸光度值,分别制作实验组和对照组细胞的生长曲线。
1.3.6细胞划痕法检测Huh7细胞迁移能力 取转染成功后的实验组和对照组Huh7细胞,消化后接种于6孔板,待细胞融合度达到90%时进行划痕实验,分别于划痕第0、48小时时观察细胞迁移情况并拍照,应用ImageG-Pro Plus 6软件计算划痕面积,结果取3次重复实验的均值。
1.3.7DAPI染色法检测Huh7细胞的凋亡情况取转染成功后的实验组和对照组Huh7细胞,弃去培养基,使用PBS洗涤1次,加入适量的甲醇固定5 min。弃去固定液后用PBS洗涤1次,加入少量4,6-二脒基-2-苯基吲哚(DAPI)染色液,于室温放置5 min,吸去染色液,用PBS洗涤3次,每次3 min。荧光显微镜下观察并拍照。
2 结 果
2.1 HCC患者癌组织、癌旁正常组织中EVA1A mRNA和蛋白表达
RT-qPCR检测结果显示,HCC患者癌组织和癌旁正常组织中EVA1AmRNA平均相对表达量分别为1.099±0.028、0.254±0.034,两者比较差异具有显著性(t=33.23,P<0.01)。免疫组化染色结果显示,HCC患者癌旁正常组织EVA1A表达为阳性,肝细胞呈棕黄色(图1A);其癌组织EVA1A表达为阴性,细胞不着色 (图1B)。15对标本中,HCC患者癌组织中EVA1A表达阴性14例,癌旁正常组织EVA1A的表达弱阳性及以上13例,两组组织中EVA1A的表达比较差异具有显著意义(χ2=19.29,P<0.001)。
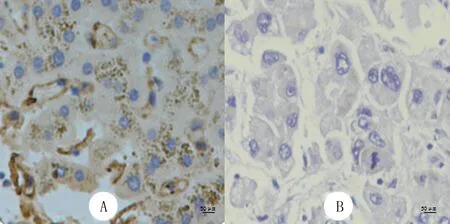
A:癌旁正常组织中EVA1A表达为阳性,细胞呈棕褐色;B:癌组织EVA1A表达为阴性,细胞不着色
2.2 Western blot方法检测L02以及Huh7细胞中EVA1A蛋白的表达水平
L02、Huh7细胞中EVA1A蛋白的表达水平分别为1.041±0.085、0.102±0.031,两者比较差异具有显著性(t=17.98,P<0.01)。
2.3 Huh7细胞转染EVA1A-Myc后EVA1A 蛋白的表达水平
Huh7细胞对照组和实验组中EVA1A蛋白的表达水平分别为0.154±0.051、1.021±0.109,两者比较差异具有显著性(t=12.47,P<0.01)。
2.4 过表达EVA1A的Huh7细胞增殖能力、迁移能力及细胞凋亡的情况
MTT法检测过表达EVA1A后Huh7细胞增殖能力显示,时间、组别、时间与组别交互作用均对Huh7细胞增殖有显著影响(F时间=369.41,F组别=260.26,F时间*组别=119.73,P<0.001)。单独效应结果显示,与第1天相比,实验组和对照组第2~4天Huh7细胞增殖水平明显提高(F=19.63~388.82,P<0.01)。与对照组第3、4天相比,实验组第3、4天Huh7细胞的增殖水平均明显降低(F=39.74、44.50,P<0.01)。见表2。细胞划痕实验结果显示,实验组和对照组的Huh7细胞划痕愈合率分别为0.108±0.022、0.389±0.065,两组比较差异具有显著性(t=7.09,P<0.05)。见图2。DAPI染色后,荧光显微镜观察过表达EVA1A后Huh7细胞的凋亡情况,结果显示,实验组中染色质固缩、出现颗粒物质以及核解体的现象明显增多,其相对凋亡率为2.104±0.054,对照组为1.017±0.101,两组比较差异有显著性(t=-16.43,P<0.05)。见图3。

图3 过表达EVA1A对Huh7细胞凋亡的影响

图2 过表达EVA1A对Huh7细胞迁移能力的影响

表2 过表达EVA1A对Huh7细胞增殖能力的影响
3 讨 论
近年来肝癌的治疗手段取得了显著进展,但我国肝癌患者的死亡率仍高居癌症相关死亡的第3位,复发和转移是死亡的主要原因[19-21]。研究普遍认为细胞凋亡受阻是肿瘤发生的原因之一,寻找肿瘤发生中的凋亡相关基因并进行靶向治疗,已成为肝癌治疗研究的新方向[22-23]。
EVA1A最早于2007年被鉴定为一种参与细胞凋亡的内质网相关蛋白[11],主要表达于内分泌组织,尤其是肝脏、胃、食管、肾上腺皮质和垂体,提示其在这些器官中具有重要的功能。此外,EVA1A诱导的自噬和凋亡也在脑缺血损伤后的细胞死亡中起重要作用[24-25]。同时EVA1A介导的自噬在胚胎
神经发生[26]、心脏重塑[27]、急性肝损伤[28]、内皮角膜营养不良[29]和控制乙型肝炎病毒的复制[30]中发挥重要作用,上述研究提示了其功能的多样性和复杂性。最近发现EVA1A在人胃癌BGC823细胞、人骨肉瘤U2OS细胞、人食管鳞癌KYSE150细胞以及神经母细胞瘤细胞中过表达,表现出抑癌作用[12,18],然而EVA1A在HCC中的表达模式、生物学功能和潜在机制尚不清楚。因此,本研究首先鉴定EVA1A在HCC中的表达情况,再进一步研究其对HCC是否具有抑制作用。首先本研究的RT-qPCR、免疫组化检测结果显示,HCC患者癌组织中EVA1AmRNA和蛋白的表达比癌旁正常组织明显降低,提示其对HCC可能有抑制作用。Western blot检测结果也显示,EVA1A蛋白在人HCC细胞系Huh7中表达水平显著低于正常肝细胞L02,与其在组织水平的表达结果一致。进一步以人HCC细胞系Huh7为细胞模型,通过过表达EVA1A观察细胞的生物学行为,即在肝癌细胞Huh7中过表达EVA1A模拟出正常肝细胞的EVA1A水平,通过MTT实验和细胞划痕实验观察对肝癌细胞增殖和迁移能力的影响,结果显示EVA1A过表达导致细胞增殖和迁移能力明显下降,说明EVA1A在肝细胞癌中发挥有效的抑癌作用。为了探讨EVA1A调控细胞增殖的分子机制,通过DAPI染色法检测EVA1A过表达对细胞凋亡的影响,结果显示过表达EVA1A使Huh7细胞相对凋亡率明显上升,提示其抑癌的作用可能是通过诱导细胞凋亡来实现的。有研究显示EVA1A在胶质母细胞瘤U87、U251、SHG44细胞系、非小细胞肺癌H1299细胞系和宫颈癌细胞HeLa细胞中均显著抑制肿瘤细胞的增殖[11,18,31],表现出较强的抗肿瘤活性,主要机制是诱导细胞凋亡,本研究与此结论相一致,提示EVA1A是一种有效的广谱抗癌蛋白。同时本研究首次发现EVA1A过表达使Huh7细胞的迁移能力也有明显下降,而上皮间质转化(EMT)对HCC细胞的迁移和侵袭至关重要[32],因此推测EMT可能是EVA1A参与调控肿瘤细胞迁移的作用靶点,但还有待进一步研究证实。关于EVA1A的抗肿瘤机制,本研究主要集中在促凋亡过程,但也不能排除EVA1A调控自噬的作用,比如在胃癌和胶质母细胞瘤中,EVA1A调控的自噬对其抑癌作用也有重要影响[18,24],自噬是否介导EVA1A在肝癌中的功能也有待于进一步研究。
综上所述,本研究结果显示,过表达EVA1A抑制了HCC细胞Huh7的增殖和迁移能力。EVA1A作为一种关键的抑癌蛋白,在正常肝脏中具有较高的表达水平,而在HCC中表达异常下调,可能有助于HCC细胞的生长和存活,是HCC发生发展的潜在机制。未来将对EVA1A的表达与HCC患者的临床进展和预后的相关性进一步分析,阐明HCC发生发展过程中EVA1A表达调控的机制,为进一步揭示HCC可能的发病机制和将来利用EVA1A为靶点研发HCC分子靶向药物提供支持。

