miR-21-3p靶向PTEN对深静脉血栓内皮祖细胞的增殖和凋亡的影响
姜炎杰,杜亚明,杜丙辉,张伟
(锦州医科大学附属第一医院,辽宁 锦州 121000)
深静脉血栓(deep vein thrombosis,DVT)是一种外周血管疾病,每年的发病率在0.1%~0.27%之间,约40%左右的患者会出现静脉性跛行,严重影响患者的生活质量[1]。DVT的发病主要与血管内皮细胞受损、血流速度变缓、血管狭窄和血液高凝密切相关。针对DVT的治疗包括改善症状、清除血栓、抗凝治疗和改善循环治疗等。目前DVT的发病机制尚未完全明确。最近研究显示miRNAs在DVT的发生发展中发挥着重要作用[2]。miRNAs是一类非编码的小RNA,长度只有20~24 nt,在生物体基因组中普遍存在。已有研究证实,虽然miRNAs只占所有RNA的1.0%左右,但它们参与了30%~50%的基因调控[3]。miRNAs通过靶向调控靶mRNA,参与细胞增殖、分化、凋亡等多种细胞生理过程[4]。研究显示miR-21-3p在小鼠DVT模型中显著低表达,并能够通过抑制FASLG参与DVT的形成[5]。然而miR-21-3p在DVT中的作用和机制还有待进一步探讨。因此采用RT-PCR检测DVT患者和健康受试者外周血中miR-21-3p和PTEN的表达水平;在DVT内皮祖细胞中转染miR-21-3p mimics和miR-21-3p inhibitors后检测细胞增殖和凋亡情况,以探讨miR-21-3p通过靶向调控PTEN参与DVT的形成。
1 材料和方法
1.1 组织标本
选取2018年4月至2019年5月期间在锦州医科大学附属第一医院住院的25名DVT患者和同期体检中健康受试者25名。患者平均年龄(56.9±10.3)岁,男性16例,女性9例。健康受试者平均年龄(55.3±12.6)岁,男性14例,女性11例。抽取两组患者外周血10 mL,离心后血清冻存于-80 ℃冰箱。所有患者均签署知情同意书,经过医院伦理委员会批准。
1.2 主要试剂
1.3 方法
1.3.1 细胞培养与转染
DVT内皮祖细胞的原代细胞分离使用密度梯度离心法,采用内皮祖细胞培养专用培养基EGM-2 MV在37 ℃、5%CO2平衡湿度培养箱中培养。取对数生长期细胞进行实验。采用INTERFERin转染试剂并按试剂说明书转染miR-21-3p mimics、miR-21-3p inhibitors、LV-PTEN 和si-PTEN。每组重复设置3个孔。
1.3.2 qRT-PCR
采用miRNeasy Mini Kit提取miRNA,使用TaqMan MicroRNA Assay试剂盒检测miR-21-3p的表达水平,并使用Applied Biosystem 7500进行qPCR,U6作为内参。采用TRIzol®试剂提取细胞中总RNA,使用NanoDrop 1000分光光度计测定RNA的浓度,储存于-80 ℃冰箱。根据RNA浓度进行计算取等质量的RNA,根据目的RNA的种类使用不同的试剂盒对RNA进行逆转录。以β-actin为内参,按2-ΔΔCt法进行相对表达量分析。
1.3.3 CCK-8方法检测细胞增殖
各组细胞在对数生长期进行收集,以2×103个密度接种到96孔培养板中,常规培养。各组细胞分别培养1、2、3和4 d后,加人10 μL的CCK-8溶液,孵育10 min,用酶标仪测定在405 nm波长的吸光度进行检测。
1.3.4 流式细胞仪(FCM)检测细胞周期和凋亡率
取对数生长期的细胞,以3×105个/孔接种于6孔板,胰酶消化收集转染24 h后细胞,PBS 洗涤后制备成细胞悬液,加入预冷的70%乙醇,4 ℃固定过夜。加入PBS洗涤2次后弃上清,加入PI工作液,室温下避光孵育30 min后,流式细胞仪检测细胞周期。用预冷的PBS洗涤2次,加入10 μL Annexin V-FITC和5 μL碘化丙啶染色液(0.25 mg/mL),轻轻混匀,室温避光孵育20 min,用流式细胞仪进行检测。
由此,要使一国自主走向法律趋同的道路,就需要一国的法律文化发生相应的变化。促使一国在法律制度上趋同于另一个国家的法律,首先需要一国在观念、原则、价值体系上与另一国家相接近,历史上具有相近文化背景的国家往往更容易走向自发地法律趋同道路。不过,全球化浪潮、“地球村”范围的扩大使得法律趋同只局限于具有相似法律文化背景的国家已经不现实,法律趋同必须扩大到具有不同法律文化背景的国家才能真正适应全球化带来的“地球村”经贸合作。而要使法律文化相异的国家自主地在国内法层面相互趋同法律,就只能通过推动两国在观念、原则、价值体系上相互接近的方式进行,对此,我们只能借助法律认同的方式实现。
1.3.5 双荧光素酶报告
将野生型或突变型PTEN克隆到pmirGLO质粒受体中,同时将miR-21-3p mimics或miR-NC导入293细胞中,共培养48 h后采用双荧光素酶受体分析系统测量双荧光素活性。
1.3.6 Westrn blot法
细胞在不同转染24 h后,常规提取细胞总蛋白,BCA试剂盒测定蛋白浓度,SDS-PAGE凝胶每孔加入40 μg的待测蛋白,110 V电泳,250 mA电转至PVDF膜,5%脱脂奶粉37 ℃封闭1 h,分别加入PTEN和β-actin一抗4 ℃孵育过夜,TBST洗膜3×10 min,二抗37 ℃ 孵育1 h,TBST洗膜3×30 min,ECL显影。运用Image J软件分析蛋白条带灰度值,以β-actin作内参,计算相对表达量。
1.4 统计学方法
采用SPSS 21.0统计学软件对数据进行统计学分析,计量资料以均数±标准差表示,两组间采用t检验,多组间比较采用方差分析和Dunnett-t检验,相关性分析采用Pearson相关系分析,P<0.05认为差异具有统计学意义。
2 结 果
2.1 miR-21-3p和PTEN在DVT患者中的表达水平
miR-21-3p在DVT患者外周血中的表达水平明显低于健康受试者,差异具有统计学意义(1.35±0.67 vs 3.72±1.53,t=7.12,P<0.05),见图1A;PTEN在DVT患者外周血中的表达水平明显高于健康受试者,差异具有统计学意义(4.60±2.21 vs 2.40±0.82,t=4.67,P<0.05),见图1B;同时miR-21-3p和PTEN在DVT患者外周血中的表达水平呈明显负相关(R=-2.61,P<0.05),见图1C;在DVT内皮祖细胞中转染miR-21-3p mimics后,miR-21-3p的表达水平明显升高(1.84±0.18 vs 1.01±0.13,t=6.38,P<0.05),转染miR-21-3p inhibitors后,miR-21-3p的表达水平明显降低(0.45±0.19 vs 1.01±0.13,t=4.21,P<0.05),见图1D。

A:DVT患者和健康受试者外周血中miR-21-3p的表达水平;B:DVT患者和健康受试者外周血中PTEN的表达水平;C:miR-21-3p和PTEN在DVT中表达水平相关性;D:DVT内皮祖细胞分别转染miR-NC、miR-21-3p mimics和miR-21-3p inhibitors。与对照组相比,*P<0.05
2.2 miR-21-3p对DVT内皮祖细胞增殖和凋亡的影响
在DVT内皮祖细胞中转染miR-21-3p mimics后培养4 d,结果显示内皮祖细胞的增殖能力较转染miR-NC组明显升高,差异均具有统计学意义(3.51±0.17 vs 2.44±0.14,t=6.84,P<0.05),见图2A;在DVT内皮祖细胞中转染miR-21-3p inhibitors后培养4 d,结果显示内皮祖细胞的增殖能力较转染miR-NC组明显降低,差异均具有统计学意义(1.73±0.15 vs 2.52±0.18,t=5.30,P<0.05),见图2B;在DVT内皮祖细胞中转染miR-21-3p mimics后,内皮祖细胞的凋亡率较转染miR-NC组明显降低,差异均具有统计学意义(3.46±0.51 vs 6.16±0.13,t=4.08,P<0.05),见图2C;在DVT内皮祖细胞中转染miR-21-3p inhibitors后,内皮祖细胞的凋亡率较转染miR-NC组明显升高,差异均具有统计学意义(13.61±2.07 vs 5.81±0.90,t=5.98,P<0.05),见图2D。
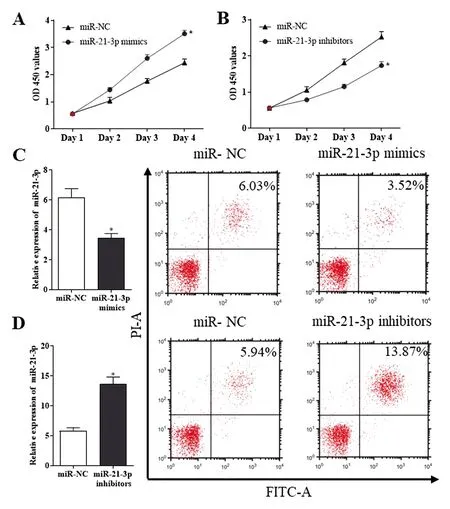
A:DVT内皮祖细胞转染miR-21-3p mimics对细胞增殖的影响;B: DVT内皮祖细胞转染miR-21-3p inhibitors对细胞增殖的影响;C:DVT内皮祖细胞转染miR-21-3p mimics对细胞凋亡的影响;D:DVT内皮祖细胞转染miR-21-3p inhibitors对细胞凋亡的影响。与miR-NC组相比,*P<0.05
2.3 miR-21-3p能够靶向结合PTEN
为分析miR-21-3p调控DVT内皮祖细胞增殖和凋亡的作用机制。见图3A为miR-21-3p和PTEN的结合位点情况,采用双荧光素酶报告验证显示PTEN-WT组中转染miR-21-3p mimics后双荧光素活性明显下降(0.45±0.04 vs 1.03±0.06,t=17.47,P<0.05,见图3B);在PTEN-MUT组中转染miR-21-3p mimics后双荧光素活性未见明显改变(1.03±0.05 vs 0.99±0.05,t=1.31,P>0.05),见图3B;同时在DVT内皮祖细胞中转染miR-21-3p mimics后,PTEN的表达水平明显降低(0. 37±0.06 vs 1.01±0.14,t=7.32,P<0.05),见图3C-D;在DVT内皮祖细胞中转染miR-21-3p inhibitors后,PTEN的表达水平明显升高(1.66±0.13 vs 1.01±0.14,t=6.02,P<0.05),见图3C-D;在进一步研究中,在DVT内皮祖细胞中转染LV-PTEN能够明显促进PTEN的表达水平(1.85±0.20 vs 1.02±0.12,t=6.31,P<0.05),见图3E;转染si-PTEN能够明显抑制PTEN的表达水平(0.39±0.11 vs 1.01±0.12,t=6.51,P<0.05),见图3F。
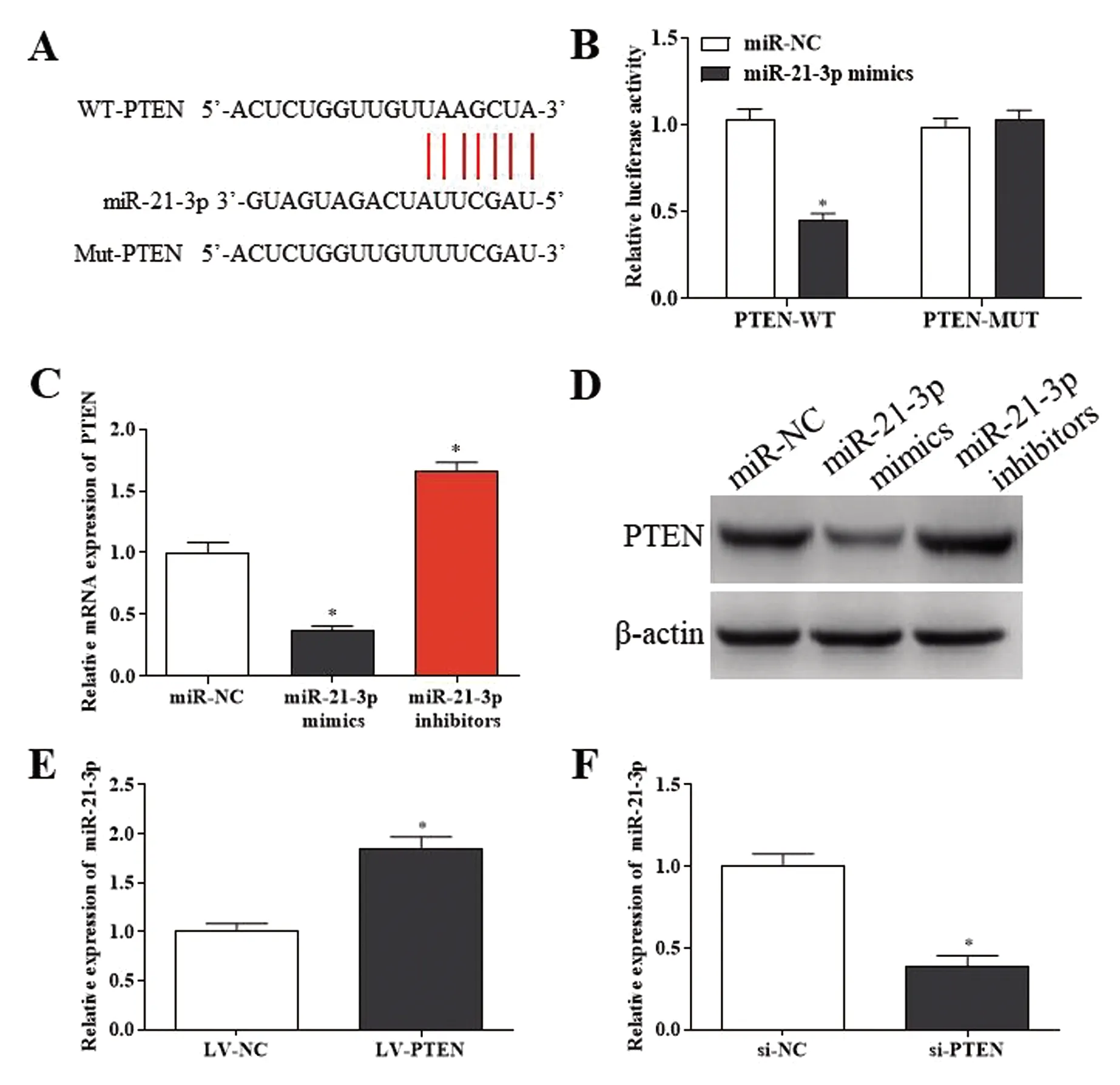
A:miR-21-3p和PTEN的结合位点;B:双荧光素酶报告验证miR-21-3p和PTEN的结合情况;C:DVT内皮祖细胞分别转染miR-21-3p mimics和miR-21-3p inhibitors对PTEN mRNA表达的影响;D:DVT内皮祖细胞分别转染miR-21-3p mimics和miR-21-3p inhibitors对PTEN蛋白表达的影响;E:DVT内皮祖细胞转染LV-PTEN后PTEN的表达水平;F:DVT内皮祖细胞转染si-PTEN后PTEN的表达水平。与对照组相比,*P<0.05
2.4 miR-21-3p调控PTEN参与DVT内皮祖细胞增殖和凋亡
为进一步验证miR-21-3p调控PTEN对DVT内皮祖细胞增殖和凋亡影响,结果显示在DVT内皮祖细胞中共转染miR-21-3p mimics和LV-PTEN后,能够反转单独转染miR-21-3p mimics对细胞增殖(2.70±0.16 vs 2.44±0.14,t=1.72,P>0.05,见图4A)和凋亡(5.88±0.92 vs 6.16±1.02,t=0.36,P>0.05),见图4;影响。在DVT内皮祖细胞中共转染miR-21-3p mimics和si-PTEN,结果显示内皮祖细胞的增殖能力较单独转染miR-21-3p mimics进一步升高(8.29±0.21 vs 3.46±0.10,t=4.99,P<0.05),见图4B;内皮祖细胞的凋亡率较单独转染miR-21-3p mimics进一步降低(1.79±0.31 vs 3.46±0.51,t=4.82,P<0.05),见图4D。
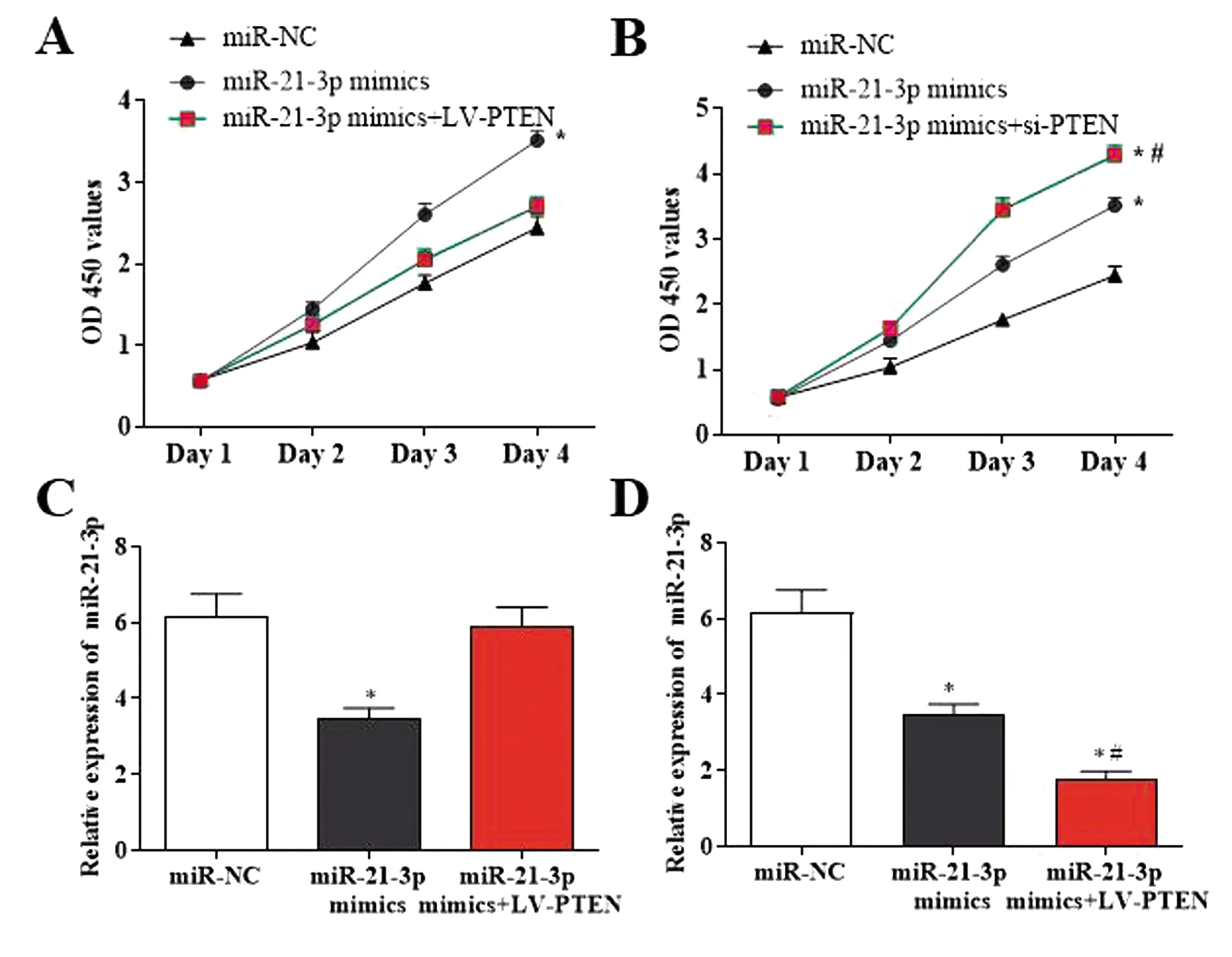
A:在DVT内皮祖细胞中共转染miR-21-3p mimics和LV-PTEN后对细胞增殖的影响;B:在DVT内皮祖细胞中共转染miR-21-3p mimics和si-PTEN后对细胞增殖的影响;C:在DVT内皮祖细胞中共转染miR-21-3p mimics和LV-PTEN后对细胞凋亡的影响 ;D:在DVT内皮祖细胞中共转染miR-21-3p mimics和si-PTEN后对细胞凋亡的影响。与miR-NC组相比,*P<0.05;与miR-21-3p mimics组相比,#P<0.05
3 讨 论
内皮祖细胞在DVT的形成中发挥着重要作用,内皮祖细胞动员后迁移至血管损伤或者血栓部位,并参与血管部位的新生血管形成,促进血栓再通[6]。目前研究显示内皮祖细胞作为一种干细胞,具有较强的增殖能力,能够分化为成熟内皮细胞参与血管修复[5,7]270。因此探讨DVT中内皮祖细胞的调控机制对DVT的防治具有重要作用。研究显示多种miRNAs在内皮祖细胞中存在异常表达,包括miR-377-5p、miR-214和miR-205等[8-9]。最近有研究显示内皮祖细胞来源的外泌体miR-21能够通过调控血小板反应蛋白参与血管内皮细胞的修复[10]。也有研究显示骨髓来源的内皮祖细胞中miR-21能够调控WWP1参与内皮祖细胞的增殖[11]。这提示miR-21可能通过调控内皮祖细胞的生物学行为参与DVT的形成。
在本研究中通过DVT患者和健康受试者外周血中miR-21-3p的表达水平,结果显示miR-21-3p在DVT患者外周血中的表达水平明显降低。进一步采用细胞实验验证miR-21-3p对DVT的影响,采用miR-21-3p mimics和miR-21-3p inhibitors转染至DVT内皮祖细胞,结果显示过表达miR-21-3p能够明显促进内皮祖细胞的增殖和抑制细胞的凋亡,同时低表达miR-21-3p能够明显抑制内皮祖细胞的增殖和促进细胞的凋亡。这提示miR-21-3p在DVT中能够调控内皮祖细胞的增殖和凋亡,对DVT的形成具有重要影响,然而其作用机制有待进一步明确。
PTEN是位于染色体10q23 上的磷酸酶,是一种抑癌分子,PTEN能够通过去磷酸化参与细胞增殖、侵袭、迁移和凋亡等多种细胞生理过程[12]。同时PTEN在转录和翻译中也受到多种因素的调控,包括早期生长反应蛋白、肿瘤抑制因子p53和活性转录因子等[13]。近年来有研究显示miRNAs能够调控PTEN的表达参与多种疾病的发生发展[14-15]。在本研究显示PTEN在DVT患者外周血中的表达水平明显升高,同时miR-21-3p和PTEN在DVT患者的表达水平呈明显负相关。这提示miR-21-3p可能通过调控PTEN参与DVT的进展。
在进一步研究中采用双荧光素酶报告证实miR-21-3p能够靶向调控PTEN,在过表达miR-21-3p后能够明显促进PTEN的表达,同时低表达miR-21-3p后能够明显抑制PTEN的表达。这提示了miR-21-3p对PTEN的调控。同时近期有研究显示miR-103a-3p在DVT中明显低表达,并通过靶向抑制PTEN参与内皮祖细胞的迁移和血管形成[16]。
在回复实验中验证miR-21-3p调控PTEN参与DVT内皮祖细胞增殖和凋亡,在DVT内皮祖细胞中共转染miR-21-3p mimics和LV-PTEN后,能够反转单独转染miR-21-3p mimics对细胞增殖和凋亡的影响,同时共转染miR-21-3p mimics和si-PTEN后能够进一步加强单独转染miR-21-3p mimics对细胞增殖和凋亡的影响。这进一步证实miR-21-3p能够通过靶向调控PTEN参与内皮祖细胞的增殖和凋亡。
总之,miR-21-3p在DVT中明显低表达,过表达miR-21-3p能够通过靶向调控PTEN促进内皮祖细胞增殖和抑制细胞凋亡,miR-21-3p可能成为DVT治疗的一个潜在作用靶点。

