金丝桃苷对类风湿性关节炎滑膜细胞的影响及机制
付强,金向楠,郜玉忠,王健,闫鹏
(1.锦州医科大学附属第一医院骨关节运动科;2.锦州医科大学附属第一医院风湿免疫科,辽宁 锦州 121000)
类风湿性关节炎(rheumatoid arthritis,RA)是以慢性炎症为特征的一种自身免疫性关节疾病,炎性免疫细胞侵润到滑膜液并造成软骨破坏[1]。异常过度增殖的成纤维样滑膜细胞(fibroblast-like synoviocytes,FLS)在这种炎症反应和关节破坏机制中起关键作用,它通过产生炎性介质,如肿瘤坏死因子(TNF-α),前列腺素E2(PGE2),一氧化氮(NO),白细胞介素(IL)-6等发挥作用,其中IL-1β也是较为重要的一种,高水平的IL-1β持续刺激滑膜细胞可以引起细胞内蛋白激酶的持续激活和信号通路的过度传导,从而使一氧化氮合酶(iNOS),环氧化酶(COX),基质金属蛋白酶(MMP)的表达水平上调[2]。这些蛋白酶表达量的多少决定着关节炎的严重程度,随着时间的延长产生进行性的关节破坏,甚至最终导致畸形和残疾。
丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)是细胞内重要的信号转导分子,MAPKs通路调控从胚胎生发,细胞分化到细胞增殖和细胞存活/凋亡的所有细胞功能。MAPKs可分类成三种类型:细胞外信号调节激酶1和2(ERK1/2),p38蛋白,和c-Jun N-末端激酶(JNK)[1]233-255。细胞因子IL-1β被证实能够诱导人的FLS通过p38途径使得NO和PEG2的产生增多[3]。
金丝桃苷(hyperin,Hyp)又名槲皮素-3-O-β-D-吡喃半乳糖苷,属黄酮醇苷类化合物,广泛存在于各种植物体内,如金丝桃科、蔷薇科、桔梗科、葵科、藤黄科、豆科等的果实与全草中,药理学发现其具有镇痛、抗炎、抗氧化,改善心血管循环功能等药物作用[4]。目前,一些研究证明Hyp通过抑制TNF-α,IL-6和NO等炎症因子的产生,有显著的抗炎作用,还有一些研究发现Hyp在体外可以显著抑制多种肿瘤细胞的增殖[5]。然而,对于Hyp是否能够抑制RA-FLS类肿瘤样的侵蚀特性,目前尚无研究报道,本实验就针对Hyp是否会对RA有抗炎和抑制软骨受侵蚀作用进行研究。
1 材 料
1.1 滑膜组织的来源
RA滑膜组织取自锦州附属大学第一医院2018年9月至12月行关节镜术的3例类风湿关节炎患者,RA患者均符合1987年美国风湿病学会制定的RA分类标准,所有患者均已签署知情同意书,符合伦理学要求并经伦理委员会批准。
1.2 主要药品与试剂
Ⅱ型胶原酶和胎牛血清购于GIbco公司;DMEM/F12培养基购于Hyclone公司;磷酸盐缓冲液(PBS)和胰蛋白酶购于碧云天生物技术研究所;金丝桃苷(Hyperin),黄色粉末,纯度>98%,购于南京春秋生物工程有限公司;白细胞介素(IL)1-β购于Sigma公司;SB203580阻断剂购于Abcam公司 ;iNOS 抗体、MMP3抗体、p38抗体、山羊抗兔二抗、 山羊抗鼠二抗、β-actin、BrdU Cell Proliferation Assay Kit均购于Cell Signaling公司;Transwell购于Corning公司。
2 方 法
2.1 滑膜细胞的培养
在无菌条件下,将手术中获取的滑膜组织,用眼科剪刀剪碎,移入含有终浓度为0.5 mg/mL的Ⅱ型胶原酶的培养基中,于37 ℃ 5%二氧化碳(CO2)培养箱中消化2 h,取出后用吸管反复吹打,并经70 μm孔径的纱网过滤后离心,沉淀重悬,移入培养瓶放置于37 ℃ 5%二氧化碳(CO2)培养箱中,每2~3 d换液1次,待细胞密度达到80%以上,即可进行传代培养,本实验使用FLS,纯度达到95%以上的3~7代细胞。
2.2 分组处理方法
本实验将细胞分为4种处理方法,正常对照组:细胞无需特殊处理,加入等量的培养基,诱导组:加入终浓度为10 ng/mL的IL-1β,诱导用药组:分别加入终浓度为10、50、100 μm/mL的Hyp+ IL-1β(10 ng/mL),诱导阻断剂组:加入终浓度为20 μm/mL 的SB203580+IL-1β(10 ng/mL),单独用药组:分别加入Hyp(10、50、100 μm/mL)。
2.3 Brdu细胞增殖实验
取对数生长期的FLS细胞,消化后以1×104/孔的密度均匀接种于96孔板中,隔天加药前给予饥饿处理,然后分别加入Hyp和SB203580(20 μm/mL),作用48 h,在药物和阻断剂作用24 h后诱导组给予加入IL-1β(10 ng/mL),对照组加入等量培养基。将Brdu原液1:500稀释在药物作用结束前8 h每孔加入20 μL,然后按照Brdu细胞增殖试剂盒说明书所示方法操作,用酶标仪在450 nm波长条件下测定各孔OD值。
2.4 细胞迁移实验
取对数生长期的FLS细胞,消化后用不含血清的DMEM/F12培养基制成密度为1×105/mL的细胞悬液,于每个transwell小室上室中加入100 μL细胞悬液,培养24 h。24 h后依照分组在上室中加入Hyp和SB203580,对照组加入等量培养基,下室中均加入含IL-1β的10%胎牛血清培养基600 μL,上室药物作用24 h。取出后用结晶紫染色放置于倒置显微镜下观察计数。
2.5 Western Blot检测细胞蛋白水平
将细胞接种于6孔板中培养,每组3复孔,待细胞密度达到80%以上,给予加药处理,分别加入Hyp(50、100 μm/mL)和SB203580(20 μm/mL)作用4 h,在药物和阻断剂作用结束前2 h诱导组给予加入IL-1β(10 ng/mL),对照组加入等量培养基,制样。用10% 聚丙烯酰胺凝胶 ( SDS-PAGE)电泳分离蛋白质,电泳后将PAGE凝胶中的蛋白质电转移至PVDF膜上。封闭 60 min,加入相应一抗,4 ℃过夜,洗去一抗后,加入辣根过氧化物酶偶联的二抗,最后用ECL化学发光法显色,结果用ImageJ软件进行灰度值分析,以目的蛋白条带灰度值与内参β-actin灰度值的比值作为目的蛋白的相对表达量[6]。
2.6 统计学分析
以上实验均重复至少3次,结果采用SPSS 17.0软件处理分析,计量资料以均数±标准差(mean±SD)表示,多组间比较应用单因素方差(One-Way ANOVA)分析,P<0.05认为差异有统计学意义。
3 结 果
3.1 Hyp对IL-1β诱导的人RA-FLS增殖能力的影响
分析酶标仪测得数据显示:IL-1β明显的诱导了RA-FLS的增殖,与正常对照组相比有显著的统计学差异(P<0.001)。诱导用药组与诱导组相比呈剂量依赖性的抑制了FLS的增殖,终浓度为50,100 μm/mL的Hyp诱导用药组与诱导组的统计学差异(P<0.001),诱导阻断剂组与诱导组相比也有显著的统计学差异(P<0.001),说明p38的阻断剂SB203580也明显抑制了LPS诱导的RA-FLS增殖能力,见图1。
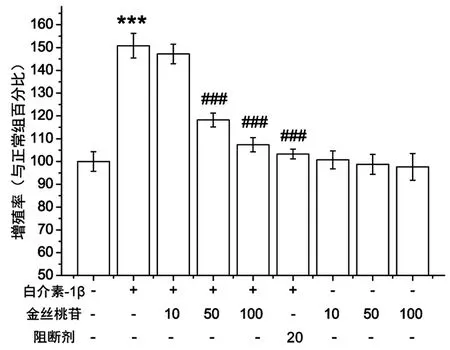
与正常对照组比***P<0.001,与IL-1β诱导组比###P<0.001
3.2 Hyp对IL-1β诱导的人RA-FLS迁移能力的影响
在倒置显微镜(×100)下将每个小室分为9个面积相等的视野,分别计数穿过的细胞数量,算出平均值统计分析。如图所示(见图2A),我们观察到50、100 μm/mL的Hyp成剂量依赖性的抑制了IL-1β诱导的FLS纵向的迁移能力,SB203580阻断剂组也同样有抑制迁移作用。分析结果显示,用药组和阻断剂组与正常对照组相比均有显著的统计学差异(P<0.001),见图2B。

A:a.正常对照组;b.金丝桃苷(50 μm/mL)-用药组;c.金丝桃苷(100 μm/mL)-用药组;d.SB203580(20 μm/mL)-阻断剂组
3.3 Western Blot测定Hyp对蛋白表达水平的影响
3.3.1 Hyp对iNOS蛋白表达水平的影响
Western Blot结果显示,IL-1β刺激RA-FLS使iNOS的蛋白表达量明显增加,与正常对照组相比有显著的统计学差异(P<0.001)。而应用p38阻断剂SB203580组iNOS的蛋白表达量相应的有所降低,用药组剂量为50、100 μm/mL的Hyp使得iNOS的蛋白表达量成剂量依赖性降低。统计学分析数据:诱导用药组和诱导阻断剂组与诱导组相比均有显著的统计学差异(P<0.001),见图3。
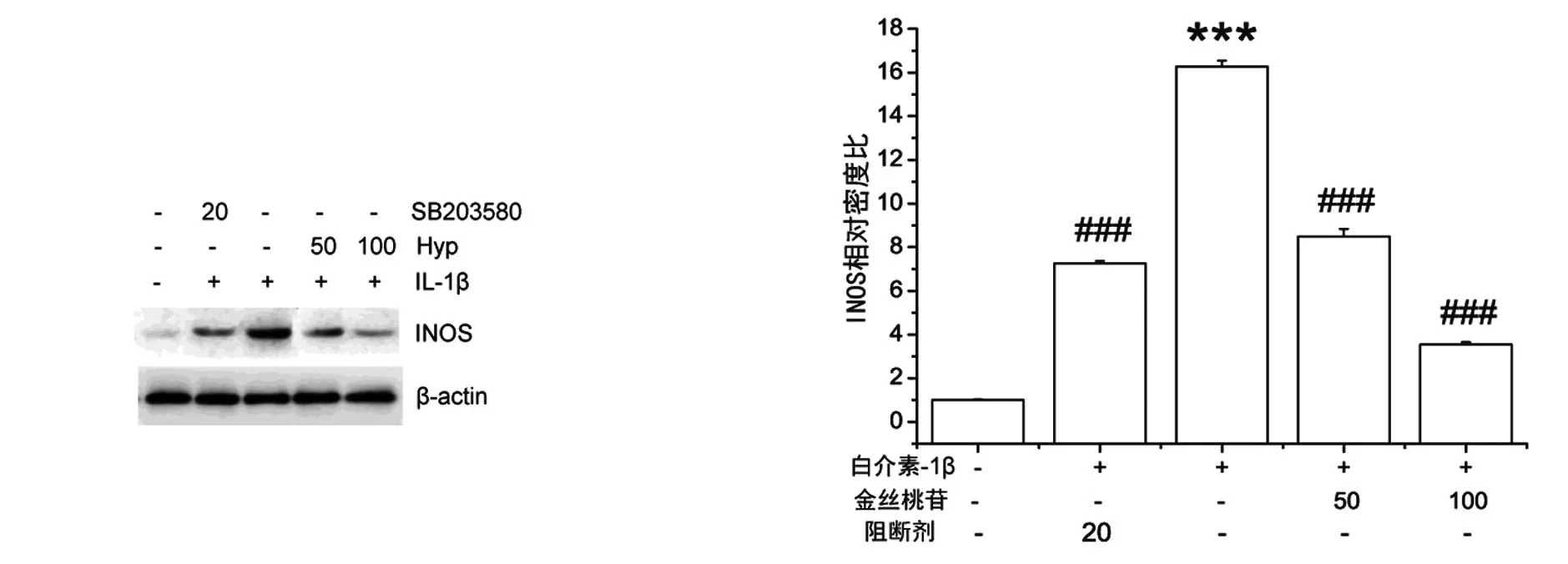
与正常对照组比***P<0.001,与IL-1β诱导组比###P<0.001
3.3.2 Hyp对MMP3蛋白表达水平的影响
Western Blot结果显示,IL-1β刺激RA-FLS使MMP3的蛋白表达量明显增加,与正常对照组相比有显著的统计学差异(P<0.001)。而应用p38阻断剂SB203580组MMP3的蛋白表达量相应的有所降低,用药组剂量为50、100 μm/mL的Hyp使得MMP3的蛋白表达量成剂量依赖性降低。统计学分析数据:诱导用药组和诱导阻断剂组与诱导组相比均有显著的统计学差异(P<0.001),见图4。

与正常对照组比***P<0.001,与IL-1β诱导组比###P<0.001
3.3.3 Hyp对p38蛋白表达水平的影响
Western Blot结果显示,IL-1β刺激RA-FLS使p38的蛋白表达量明显增加,与正常对照组相比有显著的统计学差异(P<0.001)。诱导用药组与诱导组相比呈剂量依赖性的抑制了p38蛋白的表达水平,终浓度为50、100 μm/mL的Hyp诱导用药组与诱导组有统计学差异(P<0.001),见图5。

与正常对照组比***P<0.001,与IL-1β诱导组比###P<0.001
4 讨 论
在RA中,最显著的特点之一是FLS的过度增殖,这种滑膜细胞参与着炎症和关节破坏,类肿瘤样生长使它具有不同寻常的增殖性及侵袭性,这种增殖性及侵袭性是多种因素决定的[7-8]。我们注意到RA滑膜中存在过量的细胞因子、受体及与其有相似性的癌基因产物,他们可以作用在滑膜细胞信号传导途径中的不同位置,导致持续的信号传导,从而引起RA滑膜细胞的异常增生。目前各种治疗RA方法发展迅速,以FLS侵袭为靶点的药物研究已成为近年来抗RA药物研究领域的一个热点,新药和新疗法层出不穷,极大地改善了病人的预后,但由于调控RA-FLS侵袭的复杂信号网络使靶向单一治疗束手无策,多种改善病情抗风湿药联合治疗给患者带来的药物副作用越来越多,临床上仍缺乏安全有效的治疗方法。金丝桃苷分子式为C21H20O12,相对分子量为464.3763,毒性极低,且已有研究表明它对心肌缺血、脑缺血、肝及胃粘膜有保护作用,还具有降血脂、解痉阵痛作用,为了探讨Hyp是否可以作为一种副作用小的中药同样应用于RA,我们研究了Hyp对IL-1β诱导的RA-FLS增殖与迁移能力的影响。
因脱离机体环境而体外培养的RA-FLS经几次传代后,其炎症因子的产生及迁移能力均会减弱,所以我们要对其进一步的诱导,IL-1β是多种RA诱导因子之一,有证据指出,IL-1β通过诱发FLS的增殖和炎性反应在RA滑膜炎和关节破坏发病机制中起着重要作用。Fonsa 等报道滑膜关节腔内注射IL-1β可以刺激滑膜细胞产生包括MMP在内的炎性介质,从而引发蛋白多糖、胶原的降解和软骨细胞的破坏。此外,IL-1β还能刺激中性蛋白酶和前列腺素E2的产生,增强关节的炎症反应,促进滑膜巨噬细胞进一步分化为破骨细胞,导致边缘骨质的破坏。我们通过Brdu细胞增殖实验及Transwell实验观察到IL-1β(10 ng/mL)明显诱导了RA-FLS的增殖及迁移,发现100 μm/mL的Hyp可以显著抑制IL-1β诱导的滑膜细胞增殖和迁移,意味着Hyp用于治疗RA是有效果的[9]。
在检测Hyp抑制FLS增殖和迁移能力的同时,本研究还在蛋白表达水平分别检测了药物对FLS产生iNOS及MMP3的影响。NO是IL-1β下游的重要炎性介质之一,通过调节软骨的合成和分解代谢维持软骨稳态的平衡,是导致RA关节破坏的重要因素[2]437-445。iNOS是NO产生的关键酶,在正常滑膜细胞中没有表达,但由IL-1β等细胞因子诱导的FLS可以使iNOS过度表达,炎性环境下iNOS的表达活性一旦被激活,便可持续性表达,从而产生大量的NO,高水平的NO介导广泛的毒性作用,一方面进一步促进炎性介质的释放,诱导iNOS的产生,形成一种恶性循环,导致RA的关节软骨处于一种持续性侵蚀状态,另一方面可以使MMPs高表达而导致FLS的迁移和侵袭性增加[10]。
MMPs是导致关节功能障碍的重要效应分子之一,几乎能够降解除了多糖以外全部的胶原、蛋白多糖等主要基质成分,通过直接迁移到细胞外基质(extracellular matrix,ECM)导致关节骨和软骨的破坏[11]。MMPs的活性调控包括多个方面,蛋白表达量的多少,酶原的活化以及与金属蛋白酶组织特异性抑制剂(tissue inhibitor of metalloproteinases,TIMPs)比例的不平衡。在众多的MMPs中,可以检测到RA患者的滑液中MMP1、2、3、8、9均是高水平表达的,并有研究发现RA-FLS中表达MMP1和MMP3迁移和侵袭能力更强[12-13]。我们的实验结果与此是相符的IL-1β诱导了FLS产生大量的iNOS和MMP3,其表达较正常对照组显著增高,而Hyp组使得iNOS和MMP3的蛋白表达量成剂量依赖性降低。
MAPKs是参与细胞功能的重要信号转导通路,在RA中,MAPK途径广泛的介导了滑膜细胞的增殖和炎性反应,他们或是可以激活其他的蛋白激酶,或是可以磷酸化细胞骨架,或是直接转位入核,磷酸化转录因子而调控下游基因的表达,如一方面,通过炎症因子激活的MAPK可以活化下游转录因子(如ATF-2、AP-1等),进一步上调炎症因子TNF-α、IL-1、IL-6等的表达,形成正反馈,它是RA患者局部和全身炎症持续存在的重要机制,另一方面,MAPK途径的下游的一些基因参与了RA的组织破坏,如JNL、p38是MMP表达的必须调节,特别是p38通过调节细胞因子网络对骨侵蚀有极大的影响[14]。在IL-1β的刺激下FLS表达p38的水平明显增高,p38的激活在转录水平上调控下游因子的表达,最终进一步上调了TNF、IL、iNOS、MMPs、COX2、PGE2等的表达水平,并形成一种正反馈,是RA为慢性持续性炎症疾病的重要机制[14-15]563-571。研究发现通过抑制p38激酶,可以打破这回恶性循环,本实验结果证实了这一发现,并通过研究药物对其及其下游因子表达的影响,为Hyp对p38激酶途径的抑制作用提供进一步的证明。
综上所述,本研究发现Hyp显著抑制了IL-1β诱导的FLS增殖及迁移能力,此外,在转录水平上还抑制了iNOS、MMP3和p38蛋白表达量,表明Hyp具有抑制增殖和控制关节和软骨受侵蚀的效果,可以作为RA治疗的一个理想的新药进行更多的研究。我们证明了Hyp能够抑制IL-1β诱导的FLS对 MMP3和iNOS的过度表达,还表明药物是通过阻断IL-1β激活的p38通路而发挥作用的,但这是否是Hyp作用于RA的主要机制,还需要更深一步的研究。

