败酱多糖提取工艺优化及其抗氧化活性研究
尉捷 王丹 王育林

摘要 目的:优化败酱多糖提取工艺,并评价其体外抗氧化活性。方法:在单因素考察的基础上设计正交试验,以提取时间、提取温度、料液比为考察因素,以多糖提取率为考察指标,优化败酱多糖的提取工艺;采用比色法考察其抗氧化活性。结果:最佳条件为提取时间3 h,提取温度100 ℃,提取次数3次,料液比1∶ 25,多糖提取率为(3.42±0.27)%。多糖对1,1-二苯基-2-吡啶酰肼(DPPH)自由基具有较高的清除活性,对超氧阴离子和羟基的自由基清除作用相对不明显。结论:该方法稳定可靠,可用于提取具有较强抗DPPH活性的败酱多糖。
关键词 败酱;多糖;提取条件;抗氧化活性
Extraction Optimization and Antioxidant Activity Estimation for Polysaccharides from Patrinia
WEI Jie1,2,WANG Dan2,WANG Yulin1
(1 Beijing University of Chinese Medicine,Beijing 100029,China; 2 Beijing City University,Beijing 100083,China)
Abstract Objective: To optimize the extraction process for polysaccharides from Patrinia and to estimate their in vitro antioxidant activity. Methods: An orthogonal experiment was designed on the basis of single factor investigation,extraction time,extraction temperature,material-to-liquid ratio was taken as investigation factors,polysaccharide extraction rate was taken as an investigation index,and the extraction process of polysaccharides from Patrinia was optimized; colorimetry was used to investigate its antioxidant activity. Results: The optimal conditions were determined to be 3 h for extraction time,100 ℃ for extraction temperature and 1:25 for solid-liquid ratio,the extraction rate was(3.42±0.27)%.Polysaccharides have high scavenging activity on 1,1-diphenyl-2-pyridine hydrazide(DPPH)free radicals,but relatively little scavenging activity on superoxide anion and hydroxyl radicals. Conclusion: This method is stable and reliable,and can be used to extract polysaccharides from Patrinia with strong anti-DPPH activity.
Keywords Patrinia; Polysaccharides; Extraction condition; Antioxidant activity
中圖分类号:R284.1 文献标识码:A doi: 10.3969/j.issn.1673-7202.2020.14.002
败酱草,又名胭脂麻,为败酱科植物黄花败酱( Patrinia scabiosaefolia Fisch.ex Trev)、白花败酱( Patrinia villosa Juss)的带根全草,始载于《神农本草经》。辛、苦,微寒,归胃、大肠、肝经,具有清热解毒、祛瘀止痛等功效,可用于治疗肠痈、肺痈、燥热便秘等证[1]。
败酱中的化学成分主要有黄酮类、皂苷类、环烯醚萜类、挥发油和多糖类等,比较复杂多样[2]。其药理作用也非常广泛,有抑菌、抗病毒、抗炎、镇静、抗肿瘤作用等。孟良玉等从败酱中提取的黄酮类化合物,发现其具有较强的抗氧化活性,沈德凤等发现白花败酱总皂苷通过提高抗氧化能力发挥抗肿瘤作用[3-4]。
从药用植物中提取的多糖因其独特的生物活性,近年来受到了越来越多的关注[5-6]。植物多糖具有较强的抗氧化和调节免疫作用,可以通过体外作为自由基清除剂用于预防多糖的氧化损伤。然而,迄今为止还没有关于败酱多糖(PSP)的抗氧化性的研究报道。因此,本实验采用L9(3)4正交设计试验优化了败酱多糖的提取,并评价了败酱多糖的抗氧化活性,为中药败酱草的开发和败酱多糖的利用提供参考[7-8]。
1 仪器与试药
1.1 仪器 电子天平(METTLER TOLEDO公司,瑞士,型号:PL203)、干燥箱(上海力辰科技有限公司,型号:101-0BS)、旋转蒸发仪(上海亚荣生化仪器厂,型号:RE-2010)、恒温水浴锅(郑州长城科工贸有限公司,型号:HH-S26)、数控超声波清洗仪(昆山市超声仪器有限公司,型号:KQ-500DB)、艾泽拉多功能粉碎机(浙江万基塑业有限公司,型号:2000c)、恒温恒湿箱(天津赛得利斯实验分析仪器制造厂,型号:HSP-250B)、精密pH计(赛多利斯公司,德国,型号:PB-10)。
1.2 试剂 D-无水-葡萄糖(中国食品药品鉴定研究院,批号:11508-201602),1,1-二苯基-2-吡啶酰肼(DPPH)(上海阿拉丁生化科技股份有限公司,批号:D1602005)
1.3 分析样品 败酱草于2016年5月采集于中国广西省玉林市,经北京城市学院李京生教授鉴定为败酱科植物黄花败酱 Patrinia scabiosaefolia Fisch.ex Trev的干燥全草,粉碎后过40目筛后备用。
2 方法与结果
2.1 药材预处理 根据参考文献[7]进行药材预处理,简述如下:称取败酱黄花药材粉末1 000 g,用石油醚(60~90 ℃)脱脂后,加入95%乙醇提取3次,得到药渣约246 g。
2.2 败酱多糖含量测定
2.2.1 线性关系考察 采用苯酚-硫酸法,按参考文献进行操作[9],葡萄糖做为对照品溶液,蒸馏水同法操作,作为空白对照,在波长492 nm下测吸光度值。以对照品葡萄糖浓度为横坐标(X),吸光度值为纵坐标(Y),进行回归,得方程为Y=0.015 6X-0.007 8(R2=0.998),在5~40 μg/mL范围内线性关系良好。
2.2.2 方法学考察 根据参考文献[7-9]进行方法学考察,可知仪器精密度良好,RSD为0.12%;方法重复性良好,RSD为2.07%;溶液在3 h内稳定,RSD为0.54%;方法准确度良好,平均加样回收率为97.63%,RSD为4.79%。
2.3 败酱多糖提取单因素试验
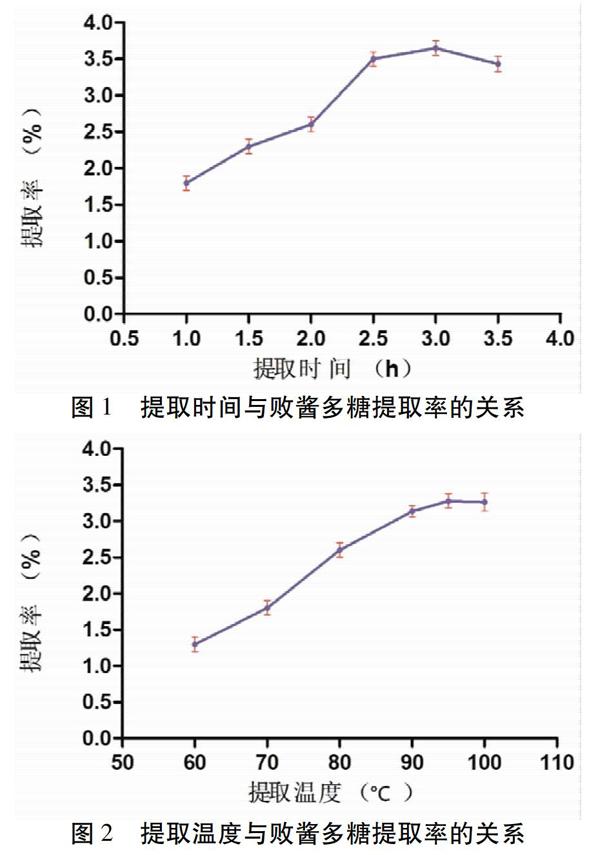
2.3.1 提取时间考察 取适量药渣(M1),精密称定,放置于150 mL具塞三角瓶中,加入1∶ 20的蒸馏水,于超声(40 kHz,200 W)提取1 h、1.5 h、2 h、2.5 h、3 h、3.5 h,每組平行3次。所得液体过滤并减压浓缩至约10 mL,按照Savage法除蛋白[10],减压干燥,得到精制多糖,精密称定其质量(M2),计算提取率(公式为:M2/M1×100%)。见图1。随着提取时间的增加,败酱多糖提取率逐渐增加,从1 h增加到3 h,提取率显著提高,提取时间为3 h达到最大值(3.46±0.10)%,而当提取时间超过3 h时,得率无明显增加,故选择2~3 h做进一步优化。
2.3.2 提取温度 取适量药渣,精密称定,放置于150 mL具塞三角瓶中,加入料液比为1:20的水,提取温度分别为60 ℃、70 ℃、80 ℃、90 ℃、95 ℃、100 ℃,超声处理120 min( n =3),按“2.3.1”项下方法核算败酱多糖提取率。见图2。由图2可知,当提取温度从60 ℃提高到100 ℃,提取率明显提高,在100 ℃时达到峰值(3.29±0.113)%;其中,提取温度在95~100 ℃范围内时,多糖产量没有明显增加,故选择80~100 ℃做下一步优化。
2.3.3 料液比 取适量药渣,精密称定,放置于150 mL具塞三角瓶中,加入蒸馏水,和物料的比例分别为1∶ 10、1∶ 15、1∶ 20、1∶ 25、1∶ 30的蒸馏水,加热温度均为100 ℃,超声处理120 min( n =3)。按“2.3.1”项下方法核算败酱多糖提取率。见图3。败酱多糖的提取率随着料液比增加而增加,在1∶ 25时达到最大值(3.28±0.09)%,然后随着水料比的进一步增加,产量没有再明显增加。将下一步试验料液比定为1∶ 20~1∶ 30。
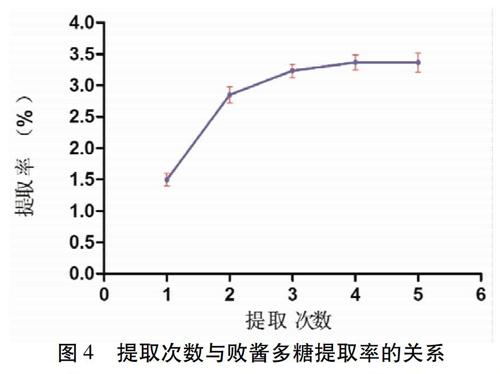
2.3.4 提取次数 取适量药渣,精密称定,放置于150 mL具塞三角瓶中,加蒸馏水,和物料的比例为1∶ 20,加热温度均为95 ℃,超声提取120 min,提取次数分别为1、2、3、4、5次( n =3),按“2.3.1”项下方法核算败酱多糖提取率。见图4。由图可知,增加提取次数,提取率明显提高,在3次时达到峰值(3.52±0.178)%,再增加提取次数至5次,败酱多糖产量并没有提高,故选择提取次数为3次。
2.4 正交试验 在上述试验的基础上,选择影响因素为提取温度(80 ℃、90 ℃、100 ℃)、提取时间(2 h、2.5 h、3 h)、料液比(1∶ 20、1∶ 25、1∶ 30),评价指标为败酱多糖提取率,L9(34)为正交表进行正交试验,每组平行3个。见表1。
由表1可知,正交试验3个因素影响大小为:提取温度>料液比>提取时间,所得最佳提取工艺为A3B3C2。由方差分析表2可知,在3个影响因素中,提取温度的影响较显著( P <0.05),其余2个因素无显著影响( P >0.05)。
2.5 正交验证试验 按照最优工艺提取败酱多糖,3次的提取率为3.47%、3.39%、3.40%,平均值3.42%,表示该提取工艺稳定性较好。
2.6 多糖精制及其光谱测定 采用Sevage法对败酱多糖溶液除蛋白[7-9]得精制多糖。将其配成100 μg/mL的溶液,在190~400 nm波长内扫描,得其在260 nm、280 nm处均无杂质吸收峰,表明精制的败酱多糖不含蛋白质和核酸。
2.7 败酱多糖体外活性测定
2.7.1 PSP还原力测定 根据DENG等[11]文献中的方法对PSP的还原力进行了评价。反应混合物中含:2.5 mL磷酸盐缓冲液(pH值6.6),2.5 mL铁氰化钾(1%)和PSP(100~2 000 mg/L)。在50 ℃条件下培养30 min后,取出后加入将2.5 mL三氯乙酸(10%),摇匀、离心(1 200× g)10 min。收集上清液2.5 mL于新试管中,加入2.5 mL去离子水和0.5 mL FeCl3(0.1%),溶液摇匀,室温培养15 min,测定700 nm吸光度值。以相同浓度的VC为阳性对照。见图5。由图可知,随败酱多糖浓度增加总还原力升高,但比相同浓度的Vc要低。总还原力可以反映潜在的抗氧化活性[12],由此可见,PSP的还原力较小。
2.7.2 DPPH自由基清除能力測定 参考Shimada等[13]的方法做DPPH自由基清除测定实验是,过程略作调整。向试管中加入2 mL DPPH(每95%乙醇中含0.1 μg/mol)和2 mL PSP(100~2 000 mg/L)。在25 ℃下培养15 min,以Vc作为阳性对照,在517 nm下测定其吸光度值。用95%乙醇代替样品作空白对照,记A0,用以下公式对PSP的抗氧化活性进行了评价:
清除率/%= A0-(Ai-Ai0) A0 ×100%
其中Ai为PSP/VC的吸光度,A0为DPPH溶液的吸光度。
DPPH是1,1-二苯基-2-吡啶酰肼,是一种稳定的自由基,能接受氢自由基或电子,成为一种稳定的抗磁分子,被广泛应用于自由基的测定[14-15]。同时,DPPH自由基稳定性好,最大吸收波长为517 nm,具有较好的抗氧化能力。PSP对自由基的清除作用结果见图6所示,在100~500 mg/L浓度范围内,PSP和VC对DPPH自由基均有明显的清除活性,浓度为500 mg/L时,PBP的清除率可达到88.4%,但在浓度为500 mg/L(500~2 000 mg/L)时,清除活性无明显提高。PSP对DPPH自由基清除活性的EC50值为105 mg/L,VC的EC50值为42 mg/L,得出多糖清除DPPH自由基的能力是Vc的40%。
2.7.3 羟自由基清除能力测定 羟自由基清除活性实验采用Winterburn CC等[16]的方法进行测定。反应混合物中含:1 mL 0.15 mol/L磷酸盐缓冲液(pH值7.4)、1 mL浓度为40 g/mL的琥珀酸钠、1 mL 0.945 mm的EDTA-Fe(Ⅱ)、1 mL 3%(v/v)的H2O2和0.5 mL的PSP(100~2 000 mg/L)。37 ℃培养30 min后,以VC为阳性对照在560 nm处测定吸光度。以蒸馏水代替样品,记A0,用以下公式计算PSP清除羟自由基的能力:清除率(%)=(A0- Ai)/A0×100%,公式中A0指空白的吸光度,Ai为PSP/VC的吸光度。羟基自由基很容易穿过细胞膜,容易与大多数生物分子(包括细胞中的碳水化合物、蛋白质、脂质和DNA)发生反应,从而造成组织损伤或细胞死亡,羟自由基的清除对于保护生命系统至关重要[17-18]。PSP对羟自由基的清除率结果见图7所示,样品浓度范围为0.1~1 mg/mL。在此基础上,随着样品浓度的增加,其清除活性迅速增加。PSP的EC50值为1 705 mg/L,VC的EC50值为490 mg/L,得出多糖清除羟基自由基的能力是Vc的28.74%。
2.7.4 超氧阴离子清除能力测定 采用了Wang CY等[19]的方法测定了超氧阴离子自由基清除活性程度。用4.5 mL的50 mmol Tris-HCl缓冲液(pH值8.2)与4.2 mL去离子水混合,在25 ℃的条件下培养20 min后,加入1 mL的PSP溶液和0.4 mL的焦性没食子酸。将所得混合物快速摇匀,在25 ℃的条件下培养5 min,立即在混合物中加入8 mmol盐酸终止反应,并在320 nm处测其吸光度值,用Vc作阳性对照。用以下公式计算清除能力:清除率(%)=(A0- Ai)/A0×100%,公式中A0指空白的吸光度,Ai为PSP/VC的吸光度。超氧阴离子作为单线态氧和羟基自由基的前驱体之一,间接引发脂质过氧化。此外,超氧阴离子的存在还会加重细胞的损伤,因为它会产生其他种类的自由基和氧化剂[20],超氧自由基清除试验的结果见图8所示。Vc对其的清除率与其浓度成正比。PSP对其的清除率随浓度的增加而增加,PSP的EC50值为1 705 mg/L,VC的EC50值为357 mg/L,得出多糖对超氧阴离子的清除能力是Vc的20.4%。
3 结论
本研究在单因素试验的基础上,通过正交试验的方法,对提取时间、提取温度、水料比等3个自变量的影响进行了评价,研究了败酱中水溶性多糖的提取。败酱多糖的最佳提取条件为:提取温度100 ℃,水料比25∶ 1,提取时间3 h,提取次数3次。此工艺下,PSP的得率为(3.42±0.27)%,得到了高产、优质的生物活性多糖。
败酱多糖具有抗氧化能力,由实验结果可知,PSP对DPPH自由基具有较高的自由基清除活性,对羟自由基和超氧阴离子有清除活性。
本研究通过正交试验,为大规模生产PSP提供了最佳的提取工艺,PSP可被作为一种新型和潜在的天然抗氧化剂,用于功能性食品或医药产业。
参考文献
[1] 张一芳.败酱草研究进展[J].中药材,2009,32(1):148-152.
[2]陈淑玲,韩亮.败酱草的现代研究进展[J].广东药科大学学报,2017,33(6):816-821.
[3]孟良玉,兰桃芳,卢佳琨,等.败酱草中黄酮类化合物的提取及其抗氧化活性[J].食品科学,2010,31(24):214-217.
[4]沈德凤,杨波,李进京.黄花败酱总皂苷提取物抗肿瘤作用的实验研究[J].黑龙江医药科学,2007,30(3):35.
[5]Li JE,Nie SP,Yang C,et al.Extraction optimization,characterization and bioactivity of crude polysaccharides from Herba Moslae[J].Carbohydr Polym,2011,83(3):1201-1206.
[6]Ananthi S,Raghavendran HR,Sunil AG,et al.In vitro antioxidant and in vivo anti-inflammatory potential of crude polysaccharide from Turbinaria ornata(Marine Brown Alga)[J].Food Chem Toxicol,2010,48(1):187-192.
[7]廖彭莹,李典鹏,扈芷怡,等.杨桃根多糖提取工艺优化及其体外活性[J].中成药,2019,41(9):2030-2034.
[8]苗永美,孙佳琦,徐荣华,等.广东石豆兰多糖的提取工艺及其抗氧化活性[J].天然产物研究与开发,2019,31(5):779-785.
[9]扈芷怡,廖彭莹,周忠玉,等.金毛狗脊多糖提取工艺的优化及其抗氧化活性[J].中成药,2018,40(3):733-736.
[10] 肖星辉,高海霞,李鸿辉,等.荒漠肉苁蓉多糖提取及纯化工艺优化[J].中国中药杂志,2019,44(3):475-481.
[11]Deng P,Zhang G,Zhou B,et al.Extraction and in vitro antioxidant activity of intracellular polysaccharide by Pholiota adiposa SX-02[J].J Biosci Bioeng,2011,111(1):50-54.
[12]Kallithraka S,Bakker J,Clifford MN.Correlations between saliva protein composition and some T-I parameters of astringency[J].Food Qual Prefer,2001,12(2):145-152.
[13]Shimada K,Fujikawa K,Yahara KT.Antioxidative properties of xanthan on the autoxidation of soybean oil in cyclodextrin emulsion[J].J.Agric Food Chem,1992,40(6):945-948.
[14]L.P Leong,G Shui.An investigation of antioxidant capacity of fruits in Singapore markets[J].Food Chem,2002,76(1):69-75.
[15]Chen R,Liu Z,Zhao J,et al.Antioxidant and immunobiological activity of water-soluble polysaccharide fractions purified from Acanthopanax senticosu[J].Food Chem,2011,127(2):434-40.
[16]Winterbourn CC,Sutton HC.Hydroxyl radical production from hydrogen peroxide and enzymatically generated paraquat radicals:catalytic requirements and oxygen dependence[J].Arch Biochem Biophys,1984,235(1):116-126.
[17]Cheng ZY,Ren J,Li YZ,et al.Study on the multiple mechanisms underlying the reaction between hydroxyl radical and phenolic compounds by qualitative structure and activity relationship[J].Bioorg Med Chem,2002,10(12):4067-4073.
[18]Zhong XK,Jin X,Lai FY,Lin QS,Jiang JG.Chemical analysis and antioxidant activities in vitro of polysaccharide extracted from Opuntia ficus indica Mill.cultivated in China[J].Carbohydr Polym,2010,82(3):722-727.
[19]Wang CY,Wang Y,Zhang J,et al.Optimization for the extraction of polysaccharides from Gentiana scabra Bunge and their antioxidant in vitro and anti-tumor activity in vivo[J].J Taiwan Inst Chem Eng,2014,45(4):1126-1132.
[20]Athukorala Y,Kim KN,Jeon YJ.Antiproliferative and antioxidant properties of an enzymatic hydrolysate from brown alga,Ecklonia cava[J].Food Chem Toxicol,2006,44(7):1065-1074.
(2019-12-10收稿 责任编辑:王明)
基金项目:国家自然科学基金项目(81303292)——五味子乙素对非酒精性脂肪肝的作用和分子机制研究作者简介:尉捷(1980.07—),女,博士,副教授,研究方向:中藥的活性成分研究,E-mail:xiaoxuyujie@163.com通信作者:王育林(1958.04—),男,博士,教授,研究方向:中医医史文献,Tel:(010)64799902,E-mail:lionw@vip.sina.com

