阿托伐他汀钙对缺血再灌注损伤内皮细胞的保护作用及对氧化应激的影响
李万奎,石春健
(1.河南圣德医院 神经内科,河南 信阳 464000;2.信阳职业技术学院 医学部,河南 信阳 464000)
脑卒中具有较高的致残率、死亡率及复发率,已成为我国居民第一位的死亡原因[1],其中缺血性脑血管疾病占脑卒中的60%~70%,严重危害人民身体健康。随着目前诊疗技术的提高,通过静脉或动脉溶栓及机械开通,已成为挽救缺血脑组织的重要措施之一,可在很大程度上促进缺血性脑血管疾病神经功能的恢复[2],但缺血再灌注损伤却是其不可避免的并发症。研究表明,缺血再灌注可引起血管内皮细胞损伤,导致其形态和功能发生变化[3],而内皮细胞功能损伤是心脑血管疾病的早期病理变化基础[4]。细胞受损后引发的氧化应激亦起重要作用,可触发一系列级联反应,最终导致神经细胞死亡和神经功能障碍[5]。
阿托伐他汀钙是临床治疗及预防缺血性脑血管疾病的一线药物,不仅能降低血脂,稳定斑块,而且能改善血管内皮功能和抗氧化应激[6]。本研究通过缺血再灌注制作人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)损伤模型,采用四甲基偶氮唑盐比色法(methyl thiazolyl tetrazoliun,MTT)及乳酸脱氢酶(lactate dehydrogenase,LDH)活力测定反应细胞的增殖活力及损伤程度,检测上清液丙二醛(malondialdehyde, MDA)水平、超氧化物歧化酶(superoxide dismutase,SOD)活性及总抗氧化能力(total antioxidant capacity,T-AOC)来分析各组HUVEC氧化应激状态,探讨阿托伐他汀钙对缺血再灌注诱导HUVEC损伤和氧化应激的影响。
1 资料与方法
1.1 实验资料
1.1.1药物 阿托伐他汀钙标准品购自中国药品生物制品检定所。
1.1.2试剂 DMEM培养基购自GIBCO公司,胰蛋白酶购自武汉普诺赛生命科技有限公司,胎牛血清购自杭州四季青生物工程材料有限公司,LDH、MDA、T-AOC、SOD试剂盒购自南京建成生物工程研究所。
1.1.3实验对象 健康成年Sprague-Dawley(SD)大鼠12只,雌雄不限,体质量为250~300 g,许可证号为SCXK(豫)2017-0001,由信阳职业技术学院实验动物中心提供,购自河南省实验动物中心。本研究方案由河南省实验动物中心实验动物伦理委员会审查和批准,所有试验均遵照GB 14925-2010《实验动物环境及设施》,遵守实验动物福利与伦理原则。脐带数根,来自河南圣德医院妇产科,所有脐带均经过孕妇及家属知情同意。
1.2 实验方法
1.2.1HUVEC的培养、鉴定及传代 依据文献方法[7]及本人前期研究,无菌条件下将健康产妇脐带的静脉内血液冲洗干净,注入提前预热37 ℃,2.5 g·L-1的胰蛋白酶,置于37 ℃环境孵育10 min,收集消化液与冲洗液,终止消化后离心,加入含20%胎牛血清的DMEM培养基,接种于100 mL培养瓶,置于体积分数为5%的CO2、37 ℃培养箱中培养。培养成功的HUVEC经Ⅷ因子相关抗原免疫组织化学鉴定证实培养的细胞为内皮细胞。将HUVEC进行传代,采用生长良好的3~4代细胞进行试验研究。
1.2.2含药血清制备 健康成年SD大鼠12只,以随机数表法分为阿托伐他汀钙高剂量组、阿托伐他汀钙低剂量组、缺氧模型组及空白对照组,每组3只。模拟人类用药方法及参考相关文献[8],阿托伐他汀钙高剂量组大鼠3只均以0.1 g·L-1阿托伐他汀钙溶液2 mL灌胃,阿托伐他汀钙低剂量组大鼠3只均以0.05 g·L-1阿托伐他汀钙溶液2 mL灌胃,缺氧模型组及空白对照组各3只以蒸馏水2 mL灌胃。所有大鼠均灌胃3 d,于最后一次给药后2 h无菌条件下取腹主动脉血,将同一组血液混合,离心分离血清,经56 ℃灭活30 min,用0.22 μm微孔滤膜过滤除菌,置-20 ℃冰箱保存备用。
1.2.3模拟缺血再灌注模型的制作 按照文献[9]的方法改进,制作模拟缺血再灌注模型,将培养液换成无糖DMEM培养基,置于缺氧环境(体积分数为5%的CO2和体积分数为95%的N2,37 ℃)30 min后,再换成普通培养基,恢复常氧环境(体积分数为5%的CO2和空气,37 ℃)培养4 h。
1.2.4实验分组及处理 取生长良好的传代培养的HUVEC,将细胞分为4组,分别为空白对照组、缺氧模型组、阿托伐他汀钙高剂量组、阿托伐他汀钙低剂量组。每组重复10个复孔。分别给予阿托伐他汀钙高低剂量组口服相应剂量药物大鼠血清的DMEM培养液,给予空白对照组和缺氧模型组未给药物大鼠血清的DMEM培养液,培养24 h。弃去培养基,除空白对照组外(给予DMEM培养液常氧培养),再给予各组无糖DMEM培养基缺氧培养30 min,换普通DMEM培养液再常氧培养4 h,进行相关指标检测。实验重复3次。
1.3 观察指标
1.3.1MTT法测定细胞增殖活力 处理完各组HUVEC后,加入MTT(5 g·L-1)20 μL,继续孵育4 h,终止培养后吸去孔内培养液,每孔加入二甲基亚砜150 μL,低速震荡10 min,在酶联免疫检测仪490 nm测量各孔吸光值,结果以光密度(optical density,OD)值表示。
1.3.2LDH外漏的测定 处理完各组HUVEC后,取出培养的细胞,吸取各组培养液,按LDH测定试剂盒说明书方法测定LDH的活性。
1.3.3氧化应激指标的检测 处理完各组HUVEC后,取出培养的细胞,吸取各组培养液,分别按MDA、SOD及T-AOC测定试剂盒说明书方法测定MDA水平、SOD的活性及T-AOC水平。
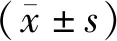
2 结果
2.1 对增殖活力及LDH外漏的影响缺氧模型组OD值低于空白对照组,差异有统计学意义(P<0.05),LDH外漏高于空白对照组,差异有统计学意义(P<0.05)。阿托伐他汀钙高、低剂量组OD值高于缺氧模型组,差异有统计学意义(均P<0.05),LDH外漏低于缺氧模型组,差异有统计学意义(均P<0.05)。见表1。

表1 阿托伐他汀钙对缺血再灌注诱导损伤的HUVEC增殖活力及LDH外漏的影响
2.2 对氧化应激指标的影响缺氧模型组MDA水平高于空白对照组,差异有统计学意义(P<0.05);SOD活性低于空白对照组,差异有统计学意义(P<0.05);T-AOC低于空白对照组,差异有统计学意义(P<0.05)。阿托伐他汀钙高、低剂量组MDA水平低于缺氧模型组,差异有统计学意义(均P<0.05);SOD活性高于缺氧模型组,差异有统计学意义(均P<0.05);T-AOC高于缺氧模型组,差异有统计学意义(均P<0.05)。见表2。

表2 阿托伐他汀钙对缺血再灌注诱导损伤的HUVEC氧化应激指标的影响
3 讨论
脑缺血再灌注后会损伤血管内皮细胞结构和功能,并可产生过多的氧自由基,进一步加重脑缺血病理改变。宋宁等[10]研究发现,缺血再灌注大鼠脑组织MDA水平升高,SOD活力降低,提示脑缺血再灌注可激活体内氧化应激反应,造成脑组织损伤。阿托伐他汀钙可较好地保护血管内皮细胞及抗氧化,有效地阻断氧化应激级联反应,减少分子和细胞的损伤[11]。阿托伐他汀钙对缺血性卒中具有调脂以外的抗氧化应激作用,对改善急性缺血性卒中患者的预后具有重要作用[12]。
研究表明,血管内皮细胞是缺血再灌注损伤中重要的靶细胞,是损伤的始发因素[13]。缺血再灌注后,氧自由基通过损伤内皮细胞膜,引起脂质过氧化和级联反应,蛋白质和核酸变性,细胞转运功能和酶的功能改变,引起内皮细胞损伤[14]。MTT法是检测细胞损伤程度的常用方法,作用于活细胞线粒体中的呼吸链,其OD值可反映细胞的增殖活力[15]。LDH是机体能量代谢中重要的酶,在细胞膜完整性破坏、通透性增加时,通过检测细胞培养液中LDH活性,可反映细胞膜损伤程度[16]。MDA是氧自由基攻击细胞膜中的多不饱和脂肪酸的最终产物,其水平可反映机体内脂质过氧化的程度[17]。T-AOC是机体内总抗氧化体系的总称,可分为酶促防御系统及非酶促防御系统[18]。SOD是酶促防御系统中最重要的一种,是生物体内专一清除超氧阴离子的特异性抗氧化酶[19]。因此,T-AOC及SOD活力的高低可反映机体抗氧化能力。
本研究发现,缺氧模型组HUVEC的OD值降低,LDH外漏升高,MDA水平升高,SOD活性降低,T-AOC降低,说明缺血再灌注损伤抑制了血管内皮细胞的增殖活力,增加了血管内皮细胞损伤程度,激活了体内氧化应激反应。王红芹等[20]研究发现,体外培养HUVEC缺氧复氧后,细胞活性下降,细胞内MDA、活性氧增多,LDH漏出率增高,与本研究一致。而阿托伐他汀钙高、低剂量组HUVEC的OD值升高,LDH外漏不同程度降低,MDA水平不同程度降低,SOD活性及T-AOC不同程度升高,上述作用随药物剂量增加呈增强趋势。这说明阿托伐他汀钙可改善缺血再灌注损伤细胞的增殖活力,减轻细胞的损伤程度,降低氧自由基的损伤,提高抗氧化能力,从而有效地保护缺血再灌注后内皮细胞结构和功能。

