猪传染性胃肠炎病毒ORF7 蛋白在ST 细胞中定位及其对病毒复制影响的研究
何 雷,董玲娟,张彦明,宋嘉兴,郁 川,余祖华,张春杰,丁 轲,赵战勤
(1. 河南科技大学 动物疫病与公共卫生重点实验室,河南 洛阳 471003;2. 西北农林科技大学 动物医学院,陕西 杨凌 712100; 3. 第四军医大学组织工程研发中心,陕西 西安 710000)
猪传染性胃肠炎(Transmissible gastroenteritis,TGE)是由TGE 病毒(TGEV)感染引起的一种高度传染性病毒性疾病[1-2]。TGEV 感染可导致仔猪严重腹泻、呕吐,一周龄以下仔猪死亡率极高,是危害养猪业的重要病原之一[3-4]。然而截至目前,TGEV 的致病机理目前还不十分清楚,其病毒蛋白(结构蛋白S、 E、 M、 N 和 非 结 构 蛋 白Rep1a、 Rep1b、ORF3a、ORF3b 及ORF7 蛋白)在病毒致病中的作用尚不十分明确,探究TGEV 各蛋白的功能将有助于寻找出新的抗病毒靶点为疫病的防控奠定基础。
已有研究表明,TGEV ORF7 蛋白基因靠近TGEV 基因组的3'端,约含78 个氨基酸[5-6]。ORF7 蛋白是TGEV 所在α冠状病毒属特有的一个非结构蛋白,而其它冠状病毒成员不编码ORF7 蛋白[7]。研究显示,在TGEV 感染的细胞中,ORF7 蛋白在体外合成过程中与微粒体、内质网(Endoplasmic reticulum,ER)和高尔基体等相关[5]。ORF7 蛋白是TGEV 复制的非必须蛋白,缺失ORF7 基因后,TGEV 仍然可以进行基因的复制和子代病毒的包装[7],和亲代病毒相比,缺失ORF7 的TGEV 感染的ST 细胞中病毒的滴度明显升高。由此可见,虽然TGEV ORF7 蛋白不是病毒复制必须蛋白。但其在宿主细胞内表达后可以负调控病毒的复制[8]。Song 等进一步的研究显示宿 主 细 胞 的microRNA 4311(miR-4331)和TGEV ORF7 蛋白存在相互作用,表明TGEV ORF7 蛋白的表达和宿主细胞的内环境相互影响[9]。综合这些研究结果表明,虽然ORF7 蛋白不直接参与病毒的复制和包装,但ORF7 蛋白和病毒的毒力、病毒复制及病毒对宿主细胞的影响等众多方面均相关。因此,明确ORF 7 蛋白功能对TGEV 致病机制的阐明具有重要意义。
本研究以TGEV ORF7 蛋白为研究对象,探究ORF7 蛋白在宿主细胞内的表达定位及过表达ORF7蛋白对病毒复制的影响,为研究该蛋白的功能和TGEV 的致病机理提供参考资料。
1 材料与方法
1.1 主要实验材料TGEV TH98 株由西北农林科技大学动物医学院兽医免疫学实验室穆杨老师惠赠;猪睾丸(ST)细胞、大肠埃希菌DH-5α感受态细胞、真核表达载体pEGFP-C1、pEGFP-N1 均由本实验室保存。
病毒RNA/DNA 快速纯化试剂盒、Hind Ⅲ、BamH I 限制性内切酶、T4 DNA 连接酶及HRP 化学发光底物均购自宝生物(大连)有限公司;DMEM 细胞培养基、脂质体Lipofetmiane 2000 购自Invitrogen公司;胎牛血清购自Hyclone 公司;2×Taq PCR Mix购自威格拉斯公司;细胞裂解液和Hoechst33342 染料购自碧云天生物技术公司;鼠抗GFP 单克隆抗体(MAb)和羊抗鼠HRP-IgG 购自金斯瑞生物科技股份有限公司。
1.2TGEV ORF7 基因的克隆根据Genbank 中TGEV TH98 株ORF7 基因序列(KU729220.1)设计扩增TGEV ORF7 全长基因序列的特异性引物,引物由北京华大基因生物技术有限公司合成,引物序列为:上游引物F1:5'-TAATGCTCGTCTTCCTCCATGC-3'/下 游 引 物R1: 5'-TACATTAATGTGACTAACAATC-3'。将TGEV 以100 TCID50的 量 感 染ST 细胞。48 h 后,吸取200 μL 的TGEV 病毒液,利用病毒RNA/DNA 快速纯化试剂盒提取病毒的总RNA,反转录获得cDNA 后以此为模板,采用引物F1/R1 进行TGEV ORF7 基因的PCR 扩增。PCR 产物经琼脂糖凝胶电泳之后回收目的片段。
1.3 TGEV ORF7 基因的载体构建与鉴定根据pEGFP-C1 和pEGFP-N1 的载体图谱设计扩增TGEV ORF7 基因的特异性引物。其中pEGFP-C1 的引物:上游引物F2:5'-TTAAAGCTTTAATGCTCGTCTTCCT CCATGC-3'/下游引物R2:5'-CCGGATCCTTACATT AATGTGACTAACAATC-3';pEGFP-N1 的 引 物:上 游引 物F3: 5'-TTAAAGCTTATGCTCGTCTTCCTCCATG C-3'/下 游 引 物R3: 5'-CCGGATCCGCTTACATTAA TGTGACTAACAATC-3'。以1.2 获得的TGEV cDNA 为模板,分别利用F2/R2 和F3/R3 扩增TGEV ORF7 基因,双酶切后分别与pEGFP-C1 和pEGFP-N1 相连接,构建的重组质粒经PCR 鉴定后,分别命名为pGFP-ORF7(GFP 融合在TGEV ORF7 的-NH2 端)和pORF7-GFP(GFP 融合在TGEV ORF7 的-COOH 端),阳性质粒由北京华大基因生物公司测序。
1.4 TGEV ORF7 与GFP 融合蛋白的western blot鉴定将ST 细胞接种于六孔细胞培养板后,当细胞的汇合度达到70%~80%时,利用脂质体法将pGFP-ORF7、pORF7-GFP 和空载体pEGFP-C1 分别转染ST 细胞,转染24 h 后置于荧光显微镜下观察绿色荧光蛋白的表达情况;转染48 h 后,收集转染细胞并加入细胞裂解液,于4 ℃以12 000 r/min 离心30 min,收集上清经SDS-PAGE 蛋白电泳。以鼠抗GFP MAb(2 μg/mL)(1∶1 000)为 一 抗,羊 抗 鼠HRP-IgG(1∶5 000)为二抗,经western blot 检测融合蛋白GFP-ORF7 和ORF7-GFP 的表达情况。
1.5 TGEV ORF7 蛋白的结构预测及亚细胞定位根据TGEV ORF7 的氨基酸序列,利用生物信息学软件(http://ipsort.hgc.jp/predict.cgi),对TGEV ORF7 蛋白结构进行预测。随后,将ST 细胞以适当密度接种于细胞培养皿内,按Lipofectamine 2000 说明将pGFP-ORF7、pORF7-GFP 和空载体pEGFP-C1 分别转染ST 细胞,36 h 后待细胞形态伸展,并且多数细胞呈单个存在的情况下,弃去细胞培养基,经Hanks 液洗去死细胞,加入10 ng/mL 的细胞核染料Hoechst33342,染色20 min 后弃去染料,用Hanks 液洗涤细胞3 次后,加入10 ng/mL 的特异内质网红色探针ER-Tracker 染色,25 min 后,加入细胞培养液,置于激光共聚焦显微镜下观察,选取细胞形态良好且有绿色荧光的阳性细胞采集照片。
1.6 过表达ORF7 蛋白的ST 细胞形态观察及TGEV 的荧光定量PCR 检测将pGFP-ORF7、pORF7-GFP、pEGFP-C1 按Lipofectamine 2000 说明转染六孔细胞培养板中的ST 细胞,转染24 h 后,以200 TCID50/孔接种TGEV 至上述细胞组,同时设正常的ST 细胞作为空白对照、转染脂质体的ST 细胞作为阴性对照,感染TGEV 的ST 细胞作为阳性对照。1 h 后弃液,补加2 mL 含2%胎牛血清的DMEM 培养基,37 ℃、5% CO2培 养12 h、24 h、36 h 及48 h时,置于普通倒置显微镜下观察ST 细胞的形态变化并拍照。
同时提取TGEV 感染48 h 后的各组ST 细胞的总RNA,反转录后利用本实验室前期建立的荧光定量PCR 方法检测TGEV N 基因的转录水平[5]。
2 结 果
2.1 重组质粒的构建与鉴定结果以TGEV 感染的ST 细胞的cDNA 为模板PCR 扩增其ORF7 基因,结果显示扩增了约250 bp 的目的条带,与预期一致(图1)。将其插入真核表达载体pEGFP-C1 和pEGFP-N1 中构建重组质粒pGFP-ORF7 和pORF7-GFP。PCR 鉴定结果显示,重组质粒均可以扩增出和ORF7基因大小近似的条带。进一步的测序结果显示,插入片段即为TGEV ORF7基因,其全长为234 bp,共编码78 个氨基酸,核苷酸与氨基酸序列与Genbank 中报道的TGEV TH98 株的ORF7 基因一致,表明重组质粒pGFP-ORF7 和pORF7-GFP 正确构建。

图1 TGEV ORF7 基因的PCR 扩增结果Fig.1 Amplification of TGEV ORF7 gene by RT-PCR
2.2 TGEV ORF7 蛋白表达的western blot 鉴定结果将各质粒转染ST 细胞24 h 后的观察结果显示,转染pGFP-ORF7、pORF7-GFP 和空载体pEGFP-C1 的细胞中均能观察到绿色荧光。表明标签蛋白GFP 无论 融 合 在TGEV ORF7 的-NH2 端 和-COOH 端,融 合蛋白均可以表达。同时,western blot 的鉴定结果显示,融合蛋白GFP-ORF7 和ORF7-GFP 分子质量均约为35 ku,GFP 蛋白的分子质量为27 ku,据此推算TGEV ORF7 蛋白的分子质量约为9 ku(图2)。上述结果表明TGEV ORF7 蛋白在ST 细胞中均得到正确表达。
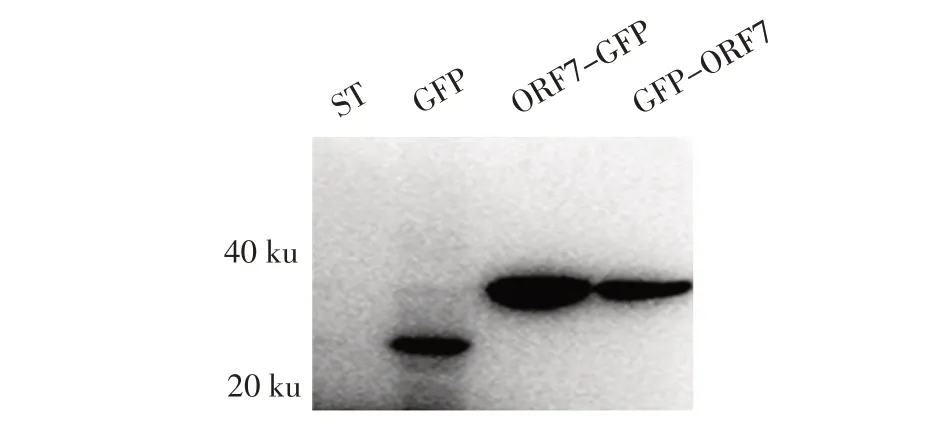
图2 ORF7 融合蛋白表达的western blot 鉴定结果Fig.2 Detection of ORF7 fusion protein expressed in ST cell line by western blot
2.3 TGEV ORF7 蛋白信号肽的生物信息学预测结果通过生物信息学软件(http://ipsort.hgc.jp/predict.cgi),对TGEV ORF7 蛋白结构进行生物信息学分析,肽段序列分析阈值为0.953,评分高于0.953 及以上的序列成为信号肽的可能性大。TGEV ORF7 蛋白分析结果显示,其N 端的第1~30 个氨基酸(MLVFL HAVFI TVLIL LLIGR LQLLE RLLLN)的信号肽序列区域预测值为2.1933,即图中红色肽段区域,远高于信号肽预测的阈值(图3)。初步表明TGEV ORF7蛋白的N 端1~30 个氨基酸具有信号肽序列特征。

图3 TGEV ORF7 蛋白信号肽结构预测结果Fig.3 The bioinformatic sprediction of protein signal peptide in TGEV ORF7 protein
2.4 TGEV ORF7 蛋白的亚细胞定位结果利用激光共聚焦显微镜观察TGEV ORF7 蛋白在ST 细胞中的定位情况。结果显示,融合蛋白ORF7-GFP 的绿色荧光和内质网的红色荧光完全重合,而融合蛋白GFP-ORF7 和转染pEGFP-C1 的对照细胞的绿色荧光则均匀地分布于细胞核和细胞质中(图4)。GFP 分别 位 于ORF7 蛋 白 的C 端(ORF7-GFP)和N 端(GFP-ORF7),但两个融合蛋白却在宿主细胞内的定位不一致。结合生物信息学分析的结果,推测融合蛋白ORF7-GFP 蛋白呈现了ORF7 蛋白的亚细胞定位特征,而融合蛋白GFP-ORF7 在表达的过程中,ORF7 蛋白的N 端信号肽结构受到GFP 蛋白的影响,因此失去了其原有定位功能,呈现和GFP 蛋白一致的定位特征。上述结果表明,TGEV ORF7 蛋白表达于宿主细胞的内质网中,并且该定位特征和其N 端的信号肽序列有关。

图4 TGEV ORF7 蛋白在ST 细胞中的亚细胞定位鉴定结果Fig.4 Subcellular localization of TGEV ORF7 expressed in ST cell lines
2.5 过表达ORF7 蛋白后对感染TGEV 的ST 细胞形态的影响分别将pGFP-ORF7、pORF7-GFP 和空载体pEGFP-C1 转染ST 细胞,转染24 h 后,接种TGEV 至各个细胞组。接种病毒12 h、24 h、36 h 及48 h 后观察ST 细胞的形态变化。结果显示,感染TGEV 36 h 后,未接种病毒的ST 细胞形态规则,大小均一(图5A);感染TGEV 的ST 细胞有明显的变圆、聚集和脱落现象,细胞之间出现明显的空隙,细胞病变(CPE)明显(图5B);转染脂质体和转染空载体pEGFP-C1 的细胞皱缩,部分细胞变圆脱落,CPE 明显(图5C、5D);相比之下,转染pORF7-GFP 和转染pORF7-GFP 仅有少许细胞出现变圆脱落(图5E、5F)。结果表明过表达TGEV ORF7 蛋白能够抑制TGEV 感染引起的宿主细胞的CPE 程度。
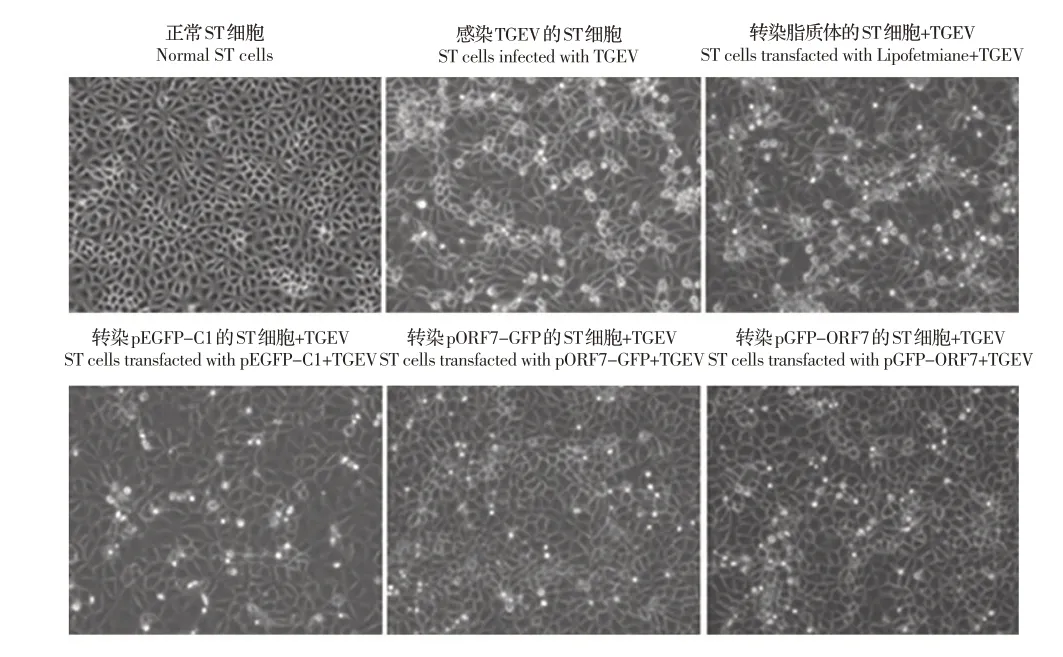
图5 TGEV 感染过表达ORF7 蛋白的细胞形态学观察(100×)Fig.5 Morphological changes of TGEV infected cells with ORF7 protein overexpression(100×)
2.6 过表达ORF7 蛋白后对TGEV 复制影响的检测结果利用TGEV 感染转染各个重组质粒的ST 细胞,24 h 后提取各转染细胞的总RNA 反转录为cDNA后,采用荧光定量PCR 检测TGEV N 基因mRNA 的转录水平。设定感染TGEV 的正常ST 细胞中TGEV N 基 因 的mRNA 量 为1.000,则 过 表 达ORF7 蛋 白 后感染TGEV 的ST 细胞(GFP-ORF7、ORF7-GFP)N 基因的mRNA 相对量分别为0.00098、0.0014,转染脂质体及转染pEGFP-C1 后感染TGEV 的细胞中N 基因的mRNA 相对量则分别为0.54 和0.573(图6)。经计算结果显示,与感染TGEV 的ST 细胞相比,过表达ORF7 蛋白的ST 细胞(GFP-ORF7、ORF7-GFP)N 基因的mRNA 转录水平分别降低99.9%和99.86%,表明ORF7 蛋白过表达后能够明显抑制TGEV N 基因mRNA 的转录水平,即显著抑制了TGEV 在细胞中的复制。转染脂质体及转染pEGFP-C1 后感染TGEV的ST 细胞中N 基因转录水平均下降了46%和42.7%,表明转染试验中使用的脂质体本身的毒性作用也影响了细胞的正常状态,从而也轻微抑制了病毒的复制。
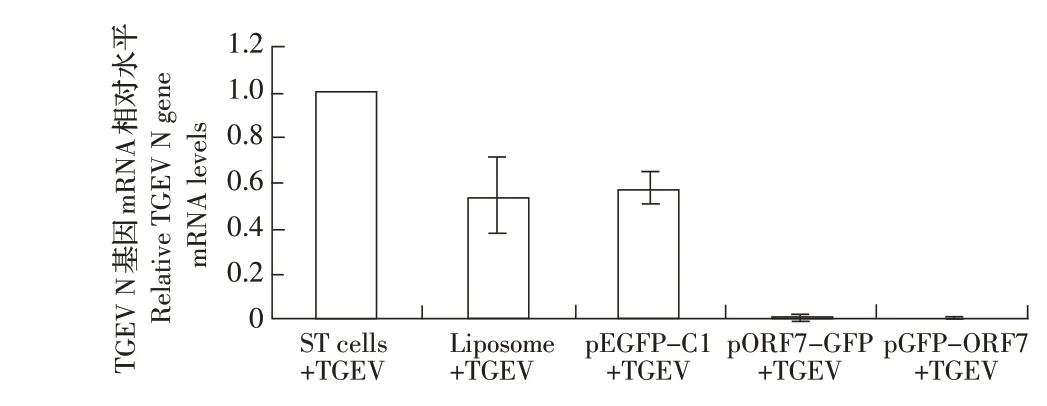
图6 TGEV 感染过表达ORF7 蛋白的ST 细胞后N 基因转录水平检测结果Fig.6 The mRNA transcription level analysis of TGEV N gene in TGEV infected ST cells with ORF7 protein overexpression
3 讨 论
虽然近年来TGE 发病率不高,但感染TGEV 的猪的免疫力降低,容易感染猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)、猪呼吸与繁殖综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)等其它病毒性疾病,而呈现混合感染,或者感染了PEDV、PRRSV 等疾病之后,也更容易感染TGEV[10]。因此,TGEV 的研究仍是研究者的关注点之一。目前国内外对TGEV 的研究大多集中在基因工程疫苗和诊断方法方面,因此对与诱导抗体产生的结构蛋白——S 蛋白和N 蛋白的研究相对较为深入[11-13],而关于ORF7 蛋白的研究却相对较少。
病毒蛋白的亚细胞定位与其特定的功能密切相关。鉴于此,本研究首先通过生物信息学软件预测了TGEV ORF7 蛋白的结构特征,结果显示,ORF7蛋白-NH2 端1~30 位肽段是信号肽序列,可能决定了其亚细胞定位特征。为了进一步明确ORF7 的亚细胞定位,本研究分别将GFP 连接至TGEV ORF7 蛋白的-COOH 和-NH2 端,以融合蛋白ORF7-GFP 和GFP-ORF7 两种形式分别在ST 细胞中表达。激光共聚焦结果显示,融合蛋白ORF7-GFP 定位于ST 细胞的内质网;而GFP-ORF7 则均匀的分布于细胞质和细胞核中。ORF7 蛋白的信号肽序列位于其-NH2端,因此,当GFP 蛋白融合到ORF7 蛋白的-NH2 端时信号肽序列在空间构象上受到GFP 蛋白的影响,不能发挥其细胞定位功能,使ORF7 非特异性地表达在细胞质和细胞核中。而当将GFP 蛋白融合到ORF7 蛋 白 的-COOH 端 时,GFP 对 其-NH2 端 的 信 号肽序列无影响,因此融合蛋白呈现了ORF7 蛋白的细胞定位特征。表明,TGEV ORF7 蛋白定位于宿主细胞的内质网中,并且这一特异性定位特征和其-NH2 端的30 个氨基酸的信号肽序列有关。
内质网作为蛋白质翻译和翻译后修饰的重要场所,是病毒复制和成熟的必要细胞器。研究表明,TGEV 所属的冠状病毒科成员的复制与细胞内质网密切相关[14-15]。为明确ORF7 蛋白是否影响TGEV 的复制,本研究检测了过表达TGEV ORF7 蛋白的ST细胞感染TGEV 后的CPE 情况和病毒复制水平。研究结果表明过表达TGEV ORF7 蛋白显著减轻TGEV感染引起的宿主细胞CPE 程度,仅有少量细胞出现变圆脱落;荧光定量PCR 检测结果表明在宿主细胞内过表达ORF7 蛋白后TGEV 的复制水平显著降低。表明TGEV 复制和其引起的CPE 密切相关:ORF7 蛋白的过表达降低了TGEV 的复制,从而减轻了TGEV感染引起的CPE 现象。然而,另有研究表明,TGEV ORF7 蛋白的表达和宿主细胞的胞内蛋白如异质核糖核蛋白家族蛋白(Heterogeneous nuclear ribonucleoproteins,hnRNPs)和微RNA(microRNA)等存在着广泛的相互作用[9,16],推测过表达TGEV ORF7 蛋白可能改变ST 细胞的胞内环境,从而使ST 细胞更能拮抗TGEV 引起的CPE。
总之,本研究表明TGEV ORF7 蛋白定位于宿主细胞内的内质网,其定位特征和ORF7 蛋白-NH2 端的信号肽序列有关。过表达TGEV ORF7 蛋白后宿主细胞的CPE 显著减少和TGEV 的复制水平明显降低。本研究为明确TGEV ORF7 蛋白的功能提研究供了参考依据。

