一株低致病力H5N3 亚型禽流感病毒的全基因组序列分析及其对小鼠的感染性研究
邢 鑫,崔鹏飞,崔嘉琦,谷文丽,张元成,范威峰,仲启鑫,邓国华,陈化兰
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/农业部动物流感重点开放实验室,黑龙江 哈尔滨 150069)
禽流感病毒(Avian influenza virus,AIV)属于正粘病毒科流感病毒属,其基因组为8 个节段的单股负链RNA。AIV 包含16 种HA 亚型和9 种NA 亚型,且其HA 与NA 亚型组合多样[1]。按照病毒对家禽的致病性可以将AIV 分为高致病性禽流感病毒(HPAIV)和低致病性禽流感病毒(LPAIV)[2]。其中,HPAIV 包含部分H5 和H7 亚型AIV,高致病性H5 亚型AIV 通常引起家禽的大规模死亡,从而造成巨大的经济损失[3]。常见的高致病性H5 亚型有H5N1、H5N6、H5N8 等组合,而H5N3 HPAIV 引起流感疫情的报道较少,仅在1961 年南非发生数千只燕鸥因感染H5N3 死亡[4]和中国台湾地区家禽感染高致病性H5N3 死 亡 的 报 道[5]。H5N3 亚 型AIV 在 家 禽 中 属 于 比较罕见的H5 亚型病毒组合之一,加上低致病力H5N3 亚型AIV 感染宿主后临床症状不明显,以至于人们对该类型病毒关注度较低。为了解我国H5N3亚型AIV 的部分生物学特性,本研究对2019 年我国广西省分离到的一株H5N3 亚型LPAIV 进行了全基因组序列分析、抗原性分析,及其对小鼠的感染性分析和受体结合特性分析。通过对该病毒株的生物学特性进行探究,有利于获得我国H5N3 亚型AIV的遗传演化、抗原性与致病性的变化规律,能够为疫情的预警预报、防控措施的调整提供数据支持。
1 材料与方法
1.1 病毒株及实验动物低致病力H5N3 亚型AIV由国家禽流感参考实验室分离并保存,其分离自2019 年春季广西省禽流感监测样品,病毒命名为DK/GX/S11453/2019(H5N3)(简称为DK/GX/S1453/19);10 日龄SPF 鸡胚购自中国农业科学院哈尔滨兽医研究所实验动物中心;6 周龄雌性BALB/c 小鼠购自北京维通利华实验动物有限公司。
1.2 主要试剂病毒RNA 提取试剂盒购自北京天根生化科技有限公司;M-MLV 反转录酶及RNA 酶抑制剂购自美国Promega 公司;EasyTaqDNA 聚合酶购自北京全式金生物技术有限公司;胶回收试剂盒购自美国OMEGA 公司;Big Dye Terminator 测序试剂盒3.1version 购自美国ABI 公司;受体试验所用α-2,3 和α-2,6 糖链由日本东京大学的Yasou Suzuki 博士惠赠;鸡H5 抗血清由国家禽流感参考实验室制备;山羊抗鸡IgG-HRP 购自Southernbiotech 公司。
1.3 病毒的全基因组序列测定及遗传演化分析
1.3.1 核酸的提取及RT-PCR 扩增利用病毒RNA提取试剂盒提取病毒RNA 后反转录为cDNA。根据GenBank 中H5 亚型AIV 同源性最高的序列区域设计所需扩增片段的引物,并进行PCR 扩增[6],扩增产物经1%琼脂糖凝胶电泳检测大小无误后,利用胶回收试剂盒进行纯化。
1.3.2 序列测定及遗传演化分析以纯化后的PCR产物为模板,使用测序反应试剂盒BigDye Terminator处理后于ABI 测序仪中进行基因序列测定。测序结果使用DNAStar 软件中的Seqman 程序拼接全基因组序列,利用NCBI 数据库进行BLAST 比对,选择与所测定基因序列核苷酸同源性相近的病毒株作为参考株基因序列。使用Megalign 同源性比对后应用MEGA7.0 软件绘制该病毒株表面基因的进化树,并分析其进化关系。
1.4 抗原性差异分析将该H5N3 亚型AIV 测定血凝价后配制成标准的四单位抗原,四单位抗原验证准确后按照标准的OIE HA-HI 方法进行交叉HA-HI试验[7],测定该病毒对不同分支H5 亚型AIV 血清的交叉血凝抑制效价。
1.5 小鼠感染性试验参照文献[8]测定该分离株鸡胚半数感染量(EID50)。利用干冰轻微麻醉小鼠后,使用106EID50/50 μL 的该病毒鼻腔感染8 只6 周龄的雌性BALB/c 小鼠,50 μL/只。另设5 只小鼠鼻腔接种50 μL PBS 作为空白对照。感染后第3 d 随机安乐死3 只感染组小鼠,分别无菌采集每只小鼠的脑、鼻甲、脾脏、肾脏和肺脏,置于1 mL 含有双抗的PBS离心管中,组织匀浆并离心后取上清液,接种10 日龄鸡胚进行组织病毒含量的滴定。剩余的小鼠连续观察14 d 并记录小鼠的体质量变化及死亡情况。
1.6 病毒的受体结合特性分析采用糖链固相结合ELISA 的方法分析DK/GX/S1453/19 病毒株的受体结合特性:将α-2, 3 和α-2, 6 糖链分别以初始浓度为100 ng/μL 二倍倍比稀释后以100 μL/孔的剂量包被ELISA 板,放入交联仪中使用紫外照射10 min,使用预冷的PBS 洗涤4 遍。将病毒配制为64 单位抗原,以100 μL/孔包被ELISA 板。4 ℃孵育过夜后使用 预 冷 的0.1%PBST 洗 涤4 遍,预 冷 的PBS 洗 涤 一遍。加入100 μL 10%的福尔马林室温作用30 min,以去除NA 的活性。使用相同的方法洗涤后加入100 μL 1∶400 稀释的鸡H5 抗血清,37 ℃作用1 h。洗涤后加入100 μL 1∶1 500 稀释的山羊抗鸡IgG-HRP,37 ℃作用1 h。洗涤后在避光条件下加入100 μL OPD显色液,显色5 min~10 min,根据其颜色变化及时加入50 μL 0.5 mol/L H2SO4。在 酶 标 仪 上 读 取OD490nm值。使用GraphPad Prism 5 软件进行数据分析并制图。
2 结 果
2.1 病毒的遗传演化分析结果将DK/GX/S1453/19病毒株各基因片段进行PCR 扩增,经琼脂糖凝胶电泳验证目的片段,胶回收后进行基因序列的测定,测定的基因序列使用Seqman 程序拼接全基因组序列。将病毒株的全基因组序列分别经NCBI BLAST 比对,绘制表面基因进化树并进行遗传演化分析。全基因组序列比对结果显示,DK/GX/S1453/19 病毒株HA、NA 两个表面基因片段均与我国2017 年于重庆分离到的一株鸭源A/duck/Chongqing/S4362/2017(H5N3)(登录号为MN171428.1)亲缘关系最近(图1、图2)。两株病毒的HA 与NA 基因的核苷酸序列同源性分别为98.41%和99.50%,表明两株病毒的表面基因可能来源相同。DK/GX/S1453/19 各基因节段与核苷酸同源性最高病毒株的同源性如表1 所示,除了与HA 与NA 基因的同源性最高病毒为同一病毒株,与其余基因片段PB2、PB1、PA、NP、M 与NS基因的核苷酸同源性最高病毒株均不相同,内部基因表现出明显的遗传多样性。该病毒株和当前优势流行株的亲缘关系较远,其基因来源具有野鸟源性,且进化来源较为原始。
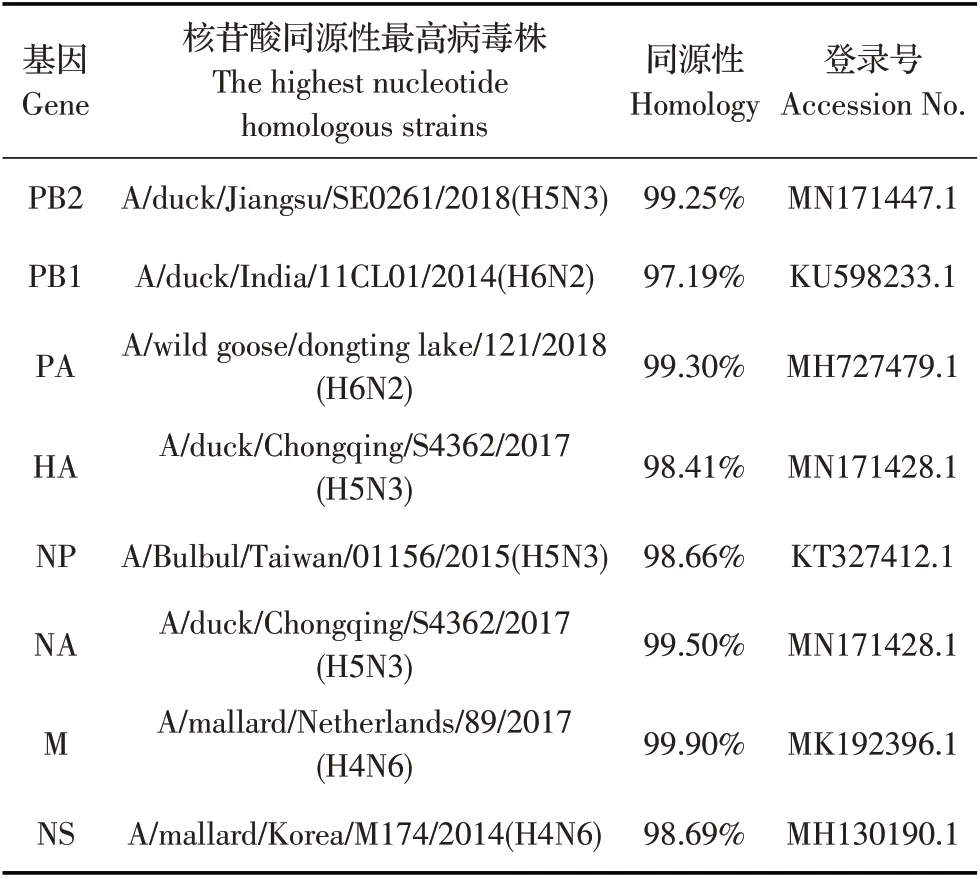
表1 与各基因节段核苷酸同源性最高的病毒株Table 1 The virus strains with the highest homology with each segment nucleotide
特殊位点的氨基酸序列分析显示,DK/GX/S1453/19 病毒株的HA 蛋白裂解位点处的序列为PQRETR/GLF,仅含有一个碱性氨基酸,符合LPAIV 的分子特征。HA 蛋白糖基化位点的变化与病毒的抗原性与致病性密切相关,本研究中的病毒株含有7 个潜在糖基化位点(以H3 亚型为标准),分别为20NNS22、21NST23、33NNT35、169NNT171、289NSS291、483NGT485、541NGS543。HA 蛋白的受体结合特性决定了流感病毒的宿主特异性,以H3 亚型HA 为模板分析影响HA受体结合位点氨基酸序列,结果显示该病毒株的aa138、aa226 和aa228 位为典型的禽型受体氨基酸特征,即为138A、226Q、228G。此外还存在160A 的人型受体氨基酸特征,至于133S 位点能否影响病毒的受体结合特性,还有待进一步研究。M1 蛋白存在N30D 和T215A可以增强H5N1 AIV对小鼠的致病力[9],该病毒的M1蛋白具有30D 和215A 的分子特征。同时NS1 蛋白未见80~84 位的颈部缺失现象,其aa42 位为S,已有文献报道NS1 蛋白P42S 可以增强H5 亚型AIV 对小鼠的致病力[10]。上述结果表明,DK/GX/S1453/19 病毒株为一株低致病力AIV,但其存在可能感染哺乳动物的风险。
2.2 抗原性差异分析结果将DK/GX/S1453/19 病毒株与实验室保存的H5 亚型的各分支参考病毒株的标准血清进行HA-HI 试验。抗原性分析结果具体见表2,表明该病毒株与近几年使用的各个H5 疫苗株的抗原差异性较大。
2.3 小鼠的感染性试验结果经Reed-Muench[6]法计 算,DK/GX/S1453/19 病 毒 株 为106.68EID50/100 μL。将该病毒株以106EID50/50 μL 的剂量鼻腔感染小鼠,3 d 后取样进行脏器滴定,结果显示,DK/GX/S1453/19 病毒株可在小鼠肺脏和鼻甲内有效复制,病毒滴度 分 别 为3.12 log10EID50/mL 和1.33 log10EID50/mL,但病毒不能在小鼠的脑、脾脏和肾脏内复制(图3)。其余小鼠连续观察14 d,结果显示,小鼠无明显的临床症状和体质量下降情况(图4)。以上结果表明DK/GX/S1453/19 病毒株对小鼠呈现低致病力。

图1 DK/GX/S11453/2019(H5N3)病毒株的HA 基因进化树Fig.1 The phylogenetic tree of the HA gene of DK/GX/S11453/2019(H5N3)

图2 DK/GX/S11453/2019(H5N3)病毒株的NA 基因进化树Fig.2 The phylogenetic tree of the NA gene of DK/GX/S11453/2019(H5N3)
2.4 H5N3 亚型AIV 的受体结合特性分析结果采用糖链固相结合ELISA 的方法分析DK/GX/S1453/19病毒株的受体结合特性,分析结果显示,该病毒株对α-2, 3 和α-2, 6 受体的结合能力均较弱,其中结合α-2,3 受体的能力要略强于α-2,6 受体(图5)。表明,DK/GX/S1453/19 病毒株同时具有结合人源受体和禽源受体的能力。
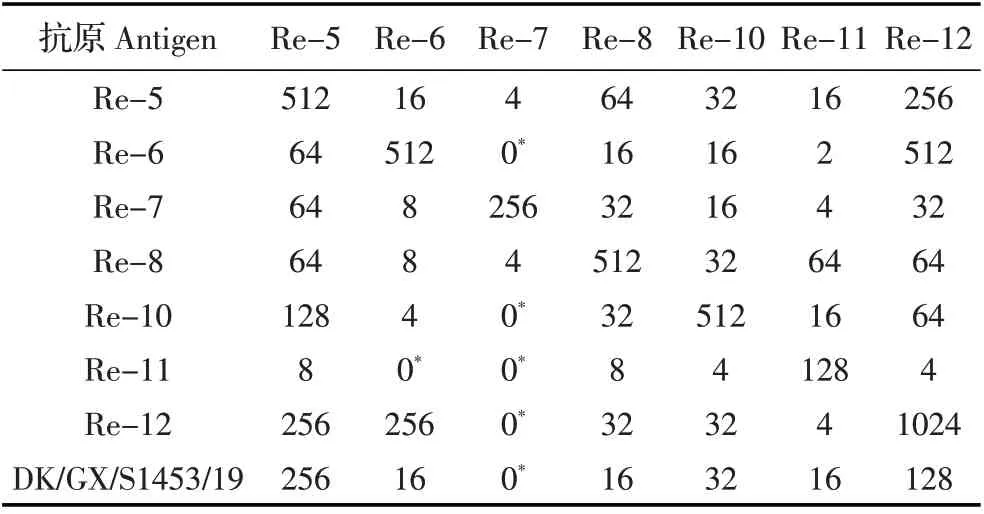
表2 DK/GX/S11453/2019(H5N3)病毒株的抗原差异分析结果Table 2 The results of antigenicity analysis of DK/GX/S11453/2019(H5N3)

图3 感染3 d 后小鼠脏器滴定结果Fig.3 Viral titers in the organs of mice at 3 d post-inoculation
图4 小鼠感染后体质量变化Fig.4 Weight change of mice post-inoculation
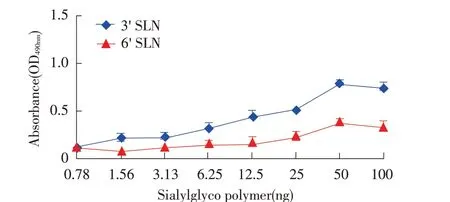
图5 DK/GX/S11453/2019(H5N3)病毒株的受体结合特异性分析Fig.5 Characterization of the receptor binding properties of DK/GX/S11453/2019(H5N3)
3 讨 论
本研究中DK/GX/S1453/19 病毒株是从我国广西壮族自治区分离得到,遗传演化分析表明HA 与NA片段均与2017 年来源于重庆的一株鸭源H5N3 核苷酸同源性最高,两株病毒的表面基因可能来源于同一祖先。分析与该病毒株表面基因同源性相近的几株国内H5N3 发现,这些H5N3 的HA 片段和蒙古国分离的一株H5N7 病毒株相近,而NA 片段也与蒙古国的一株H10N3 亲缘关系较近,说明国内近几年的H5N3 亚型AIV 有可能由野鸟传入。并且,这些病毒株内部基因均具有明显的遗传多样性,分别与不同来源的H5N3、H6N2、H4N6 等病毒亲缘关系密切。早期国外有学者在野鸟体内分离到H5N3 病毒株,其基因来源也呈现明显的遗传多样性[11-12]。另外有研究报道,2002 年以来,我国华南地区分离的H5N3 病毒株是由不同AIV 形成的重配病毒株[13]。以上研究均说明H5N3 病毒株的产生可能是由于不同病毒株在野鸟体内携带和传播过程中发生了基因重排现象。抗原性分析结果表明,该病毒株和各疫苗株之间的抗原差异性较大,与最早使用的Re-5 疫苗株抗原性类似,这样从病毒抗原性上来分析,新分离的H5N3 亚型病毒与我国早期出现的病毒抗原性相似,而与近几年家禽体内的优势病毒株差异明显。
HA 蛋白糖基化位点的数量和分布与其功能密切相关[14],已有研究报道,当在2009 年甲型H1N1流感病毒HA 蛋白上添加额外的糖基化位点后,突变病毒对小鼠和雪貂的致病性降低[15]。此外,H5N1亚型AIV 的HA 蛋白在158 位氨基酸残基发生糖基化修饰可以降低病毒对小鼠和雪貂的致病性[16-17]。本研究使用的病毒株HA 蛋白含有7 个潜在糖基化位点,并不包含已报道的158 位氨基酸残基糖基化位点,关于这些糖基化位点是否会影响病毒的抗原性与致病性还有待深入研究。受体结合位点分析表明本病毒株HA 蛋白在138A、226Q、228G 位点表现为典型禽型受体类型的特征,但160A 表现为人型受体分子特征,这一分子特征与受体结合试验结果一致,即为DK/GX/S1453/19 病毒株具有同时结合α-2, 3 和α-2,6 受体的能力。有研究报道H5 病毒株受体结合位点S133A 可增强病毒与α-2, 6 受体结合的能力[18],至于本研究中发现的133S 是否会影响受体结合能力,还有待于进一步探究。已有研究表明,M1 蛋白的N30D 和T215A 突变,以及NS1 蛋白的P42S 突变均会增强H5 亚型AIV 对小鼠致病力[9-10],本研究中的病毒株存在M1 蛋白的30D 和215A,NS1 蛋白的42S 这些分子特征,但该病毒株对小鼠并未表现出高致病力,说明该病毒株可能还存在其他会影响致病力的因素。虽然该病毒株对小鼠低致病力,但病毒可以在小鼠肺脏和鼻甲内有效复制,存在一定的感染哺乳动物及人类的风险。该H5N3 病毒株的出现也充分表明当前我国家禽面临的AIV 感染风险较高,应加大监测力度,密切关注这些新亚型病毒株在家禽中出现的频率和波及面,以及病毒抗原性差异,为我国禽流感的综合防控提供数据支持。

