自噬在肾缺血再灌注损伤中作用机制的研究进展
彭显月 梁国标
缺血再灌注损伤(ischemic reperfusion injury, IRI)是临床上常见且复杂的病理生理过程,是导致急性肾损伤(acute kidney injury, AKI)的主要原因之一。肾IRI临床常见于肾移植、休克后微循环再通、主要的血管外科手术以及体外循环等,其发病机制尚未完全阐明[1]。目前认为肾IRI与氧自由基生成、钙离子超载、ATP减少和凋亡等机制有关。近年来有研究表明,通过调节细胞自噬(autophagy)可以减轻肾IRI,提示自噬可能成为肾IRI治疗的新切入点[2]。
自噬是维持机体内环境平衡的重要生理过程,它是一个多方面、连续的过程,由一系列高度保守的细胞自噬相关蛋白(Atgs)参与并通过多种信号通路构成自噬的分子机制[3]。研究发现,自噬在肾IRI的发生、发展中发挥着重要的作用,一方面适度的自噬能抑制炎性因子的释放,另一方面过度的自噬能加重细胞损伤。因此对自噬的调节可能成为肾IRI治疗的新策略。
一、自噬的基本概述
自噬这一现象最早由比利时科学家Christian de Duve发现并提出,他在观察细胞时发现有一种新型的囊泡可运输细胞货物进入溶酶体进行降解,而这种新的囊泡被称为自噬体,Duve创造了自噬这个词来形容这一过程。2016年诺贝尔生理学或医学奖获得者大隅良典培育出因突变而缺乏液泡降解酶的酵母细胞,并通过饥饿来激发自噬。随后有研究者在此基础上进一步研究发现,细胞自噬通过对细胞部件的降解和回收利用参与了许多重要的生理功能(如脂质代谢、蛋白质聚集体降解和RNA降解等)。
自噬的标志是双层膜结构的自噬小体的形成,主要包括诱导、成核、延伸和完成4个步骤。根据自噬发生的分子机制、功能的不同可将自噬分为巨自噬、分子伴侣介导的自噬和微自噬。巨自噬指细胞在饥饿、缺氧等刺激诱导下,细胞质内产生双层囊泡结构包裹非特定蛋白形成自噬体,随后自噬体与溶酶体融合,最终将自噬体包裹的物质降解的过程。分子伴侣介导的自噬是指具有特定基序的蛋白质被分子伴侣识别后,与溶酶体膜上的特殊受体——溶酶体相关膜蛋白结合,进入溶酶体被降解的过程。微自噬是指溶酶体或液泡膜直接内陷包裹胞质物或者细胞器进行降解的过程。目前关于巨自噬的研究最为广泛,与肾IRI的发生、发展最为紧密。
二、自噬对肾缺血再灌注损伤的影响
自噬是维持肾脏固有细胞内稳定、细胞活力和生物学功能的重要生理机制。大量研究证实自噬参与了肾IRI的发生、发展,但其在肾小管细胞中的作用仍存在争议,特别是在急性肾损伤模型中[1,4]。IRI是AKI的主要原因,肾近端小管细胞对氧化应激非常敏感,是氧化应激介导的急性肾损伤的重要靶点,在缺血再灌注(IR)后常导致小管细胞坏死[5]。特别是在由IR引起的AKI等病理状态下,自噬在小管细胞维持其完整性的机制中发挥着不可替代的作用[6]。然而,一些研究者认为,IR后产生的过量自噬对肾细胞有害,并可能导致IR中的自噬性细胞死亡[7]。通过对近端小管细胞和体外小鼠肾IR模型的研究发现,自噬在缺血期不太明显,在再灌注期显著增强[8]。由此可知,自噬是一个动态过程,它在肾IRI中的作用受多种病理生理环境因素的影响并在肾IRI中发挥着重要作用。
三、肾缺血再灌注损伤中自噬的调控
近年来,自噬在缺血再灌注损伤领域的研究一直是一个热点,缺血再灌注损伤的机制如氧化应激、凋亡、炎症、内质网应激等均可诱导自噬的发生。自噬也在一定程度上参与IRI并发挥着一定的作用。
1.线粒体自噬的调控:目前调控线粒体自噬的通路主要有以下3条:①PINK1(PTEN-induced kinase1)/Parkin通路;②BNIP3/NIX(NIP3-like protein X)通路;③FUNDC1(FUN14 domain containing 1)通路。其中后两条通路主要是通过线粒体外膜蛋白直接与LC3相结合发挥作用。PINK1/Parkin通路主要参与哺乳动物线粒体自噬的调控,PINK1和Parkin分别是丝氨酸/苏氨酸激酶和E3泛素连接酶[8]。当线粒体功能正常时,PINK1通过线粒体膜上的转位酶转移到线粒体基质进行降解;当线粒体受损后,Parkin能被丝氨酸/苏氨酸激酶PINK1磷酸化,促使其由胞质转移到线粒体膜外,从而被选择性地募集到受损的线粒体,紧接着通过介导线粒体膜蛋白的泛素化而参与线粒体自噬[9]。哺乳动物雷帕霉素靶点(mammalian target of rapamycin, mTOR),是一种重要的线粒体自噬调控因子,它的激活可抑制细胞的线粒体自噬[10]。雷帕霉素能够抑制mTOR的功能,减弱mTOR对线粒体自噬的负性调节,并通过激活线粒体自噬减轻IR导致的肾损伤[3]。
2.内质网应激自噬的调控:内质网(endoplasmic reticulum, ER)应激诱导的自噬介导了一种适应性反应,可在体外保护机体免受氧化和ATP耗竭诱导的细胞毒性,并在体内改善IRI[11]。在ER腔中,新合成的蛋白质在离开ER之前折叠到细胞的不同区域和细胞外空间。当ER受到不利条件刺激时,蛋白质被错误地折叠,且过早错误折叠的蛋白质不能从ER腔中排出并在ER中累积,导致ER应激[12]。细胞通过激活高度保守的未折叠蛋白反应(unfolded protein response, UPR)促进ER应激,促进修复以重建正常的ER功能[13]。ER跨膜蛋白的UPR包括需肌醇酶1(lnositol-requiring kinase 1, IRE1)、蛋白激酶R样内质网激酶(protein kinase R-like ER kinase, PERK)和活化转录因子6(activating transcription factor 6, ATF6),可同时触发促生存和促死亡通路[14]。ER应激可诱导包括肾上皮细胞在内的哺乳动物细胞自噬[15]。在ER应激时,细胞通过激活诸如UPR和自噬信号转导通路进行调控,以确保细胞内环境稳定。UPR和相关的ER伴侣蛋白Grp78已被证明主要参与诱导自噬[16]。UPR相关的PERK通路可上调Atg12并将LC3-Ⅰ转化为LC3-Ⅱ;IRE1通路可从Bcl-2复合物中释放Beclin1以促进自噬诱导。此外,内质网是Ca2+储存库,其在应激期间可将大量的Ca2+释放到胞质中,从而抑制mTOR信号通路的活性,允许自噬体以Beclin1和Atg7依赖的形式大量产生,促进自噬[17]。自噬通过上述信号通路清除内质网应激反应产生的受损蛋白和细胞器等来减轻细胞损伤和肾IRI。
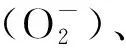
自噬在炎症损伤过程中可通过抑制炎性复合物或清除受损的蛋白质和细胞器减轻炎症损伤。有研究证实炎性介质IL-6、IL-10、HMGB1和TNF-α均参与了自噬在肾IR后的调控,可诱导自噬的产生。Chen等[22]的研究表明,在TLR(Toll-like report)介导的信号通路中,上调HMGB1可激活TLR4信号通路的调节,刺激炎症和免疫反应加剧肾IRI。然而,TLR又可通过促进MyD88或TRIF与Beclin1相互作用,抑制Beclin1-Bcl-2复合体形成从而促进自噬[23]。此外,NOD样受体(NOD-like receptor, NLR)介导的通路能参与炎性反应的正向调节,NOD样受体蛋白3(NOD-like receptor protein 3, NLRP3)是NLR家族成员之一,激活时可促进炎性因子如IL-1β、IL-18的释放[23]。NLRP3介导的炎性反应可激活小G蛋白RalB ,活化的RalB可同时与Exo84、ULK1-PI3KC3复合体结合形成一个多蛋白复合物来诱导自噬[23]。这样,自噬在氧化应激和炎性反应中被激活,吞噬受损的蛋白和细胞器,从而减轻机体损伤。
四、自噬对肾缺血再灌注损伤的双重作用
1.自噬减轻缺血再灌注引起的肾小管上皮细胞损伤:越来越多的证据支持自噬通过抑制细胞凋亡来预防肾小管细胞IRI。在这方面Jiang等[3]的研究表明,通过ptdlns3k抑制剂3-甲基腺嘌呤(3-MA)或小干扰RNA(siRNA)对Beclin1或Atg5转录体的自噬抑制,可增加缺氧/复氧条件下体外大鼠近端小管细胞的凋亡。在体内,3-MA和溶酶体抑制剂氯喹在30min的双侧肾缺血小鼠模型中加重了48h灌注后肾细胞的损伤。自噬缺陷(近端肾小管特异性Atg7敲除)小鼠双侧肾缺血25min后也观察到类似的结果。此外,两种不同的近端小管特异性Atg5敲除小鼠模型,在双侧肾缺血25min或35min后,也观察到肾脏损伤的加剧,细胞凋亡增加以及p62和泛素阳性包涵体的积累[5]。
2.自噬加剧缺血再灌注引起的肾小管上皮细胞损伤:尽管有充分的证据表明自噬有保护作用,但自噬在肾IRI过程中也有不利影响。Chien等[24]用单侧肾切除的大鼠模型,通过腺病毒传递Bcl-2家族蛋白Bcl-2和Bcl-xL,保护另一侧肾脏免受IRI(缺血45min),这一效应被认为是由这些蛋白的抗凋亡和抗自噬特性介导的。在过表达Bcl-2的转基因小鼠中,也观察到了Bcl-2的保护作用,当这些动物双侧肾缺血45min后,凋亡和自噬功能均下降。此外,在缺血和重复性缺氧预处理保护作用的研究中,观察到自噬在单侧肾缺血45min大鼠模型中的表达也是降低的。由此可见,在肾IRI中自噬的激活和过度激活受多种因素的影响并发挥着截然相反的作用。自噬在肾缺血再灌注损伤中的确切作用为什么难以确定可能与自噬本身的动态性、动物模型的缺血阶段、造模时间、动物模型年龄、药物种类及剂量等的不同有关,这将在今后的研究中进一步加以证实[3,5]。
五、展 望
自噬是细胞存活与死亡的核心因素之一,在肾IRI中发挥着重要作用。激活自噬既可以对受损肾小管上皮细胞起保护作用,又可能加重肾组织损伤,笔者认为这可能与自噬激活的方式、程度、缺血时间、阶段和个体差异等因素有关。虽然自噬与肾IRI相互作用关系仍存在着矛盾与争议,但自噬在肾IRI中的作用不可否认。从自噬的角度研究肾IRI的过程,深入了解该疾病的发病机制,发现潜在的药物治疗靶点是目前重要的研究方向。

