植物对缺磷和铝毒协同进化应答的分子生理机制
吴佩 李浩 早浩龙 王宇蕴 杨建立 汤利 范伟,3
(1. 云南农业大学资源与环境学院,昆明 650201;2. 浙江大学生命科学学院 植物生理学与生物化学国家重点实验室,杭州 310058;3. 云南农业大学西南中药材种质创新与利用国家地方联合工程研究中心 云南省药用植物生物学重点实验室,昆明 650201)
酸性土壤约占世界潜耕性土壤的50%,其存在诸多养分限制因子,如磷(P)、钾(K)、钙(Ca)、镁(Mg)的缺乏和铝(Al)、锰(Mn)的过量[1-2]。其中,缺P与Al毒通常相互关联,因而代表了酸性土壤上限制作物生产的两大营养逆境因子[3-4]。作为必需营养元素,P在植物生长发育中起重要作用,包括脂质和核酸等结构成分的形成,以及参与多条代谢酶促反应和信号转导途径。虽然总P在多数土壤中是丰富的,但可溶性P常常难以满足植物的需求,特别是在Fe、Al和Mn含量丰富的酸性土壤中,P容易被这些元素固定。另一方面,当土壤pH低于5.5时,难溶性的矿物态Al可转化为可溶性的离子态Al(以Al3+为主),导致植物根生长受抑制,阻碍对水分和养分的吸收[5]。虽然增施P肥可通过增加P的有效性和降低Al活度来提高酸性土壤中作物的产量和品质,但P肥的利用率非常低(当季利用率仅为10%-25%)。幸运的是,不同植物和同一植物不同基因型间存在巨大的遗传变异。因此,通过现代生物技术和分子辅助育种提高作物P营养和Al抗性是今后培育“智能”作物品种的有效途径。
在过去20多年间,关于缺P条件下植物P的吸收转运、分配利用以及信号调控研究已在拟南芥[Arabidopsis thaliana(L.)Heynh.]、水稻(Oryza sativL.)和白羽扇豆(Lupinus albusL.)等模式植物中取得较大进展[6-7]。同样,从水稻、小麦(Triticum aestivumL.)、 高 粱[Sorghum bicolor(L.)Moench.]和拟南芥中也筛选出一系列抗Al基因,建立了植物抗Al分子调控网络的最新模型[8-9]。然而,抗Al基因可能对P营养具有多效性影响,表明在多重胁迫共存的酸性土壤中存在抗Al基因的协同进化机制。为此,本文系统综述了酸性土壤中调控植物抗Al和P营养协同进化机制的研究进展,提出了抗Al基因应用于酸性土壤作物改良,以及通过改变根发育和根构型来维持酸性土壤中良好P状况和作物生产力的可能性。
1 有机酸在酸性土壤缺P和Al毒胁迫应答中的作用
根伸长抑制是植物Al毒最明显的原初症状,被广泛作为Al毒的衡量指标[9]。植物在长期适应Al毒时已进化出一系列内部耐受和外部排斥的抗Al机制。其中,诱导根尖有机酸释放,对Al进行外部螯合的解毒机制被认为是大多数植物最主要的耐Al机制(图1)[9]。如表1所示,虽然Al诱导不同植物分泌的有机酸种类不同,但主要为苹果酸、柠檬酸和草酸,而且大部分分泌部位都位于根尖。迄今为止,控制Al诱导苹果酸和柠檬酸分泌的基因在大部分物种中均被解析,但控制草酸分泌的基因仍未见报道。而且,除了小麦和大麦分泌的柠檬酸为组成型外,其他有机酸的分泌均受Al诱导。相对于Al,P在土壤中的扩散缓慢,植物大多通过扩大根系与土壤的接触面来提高对P的摄入。同时,根际释放的有机酸可增加螯合态P的释放和有效性(图1)。与Al胁迫相比,不同植物缺P条件下分泌的有机酸种类和部位更为复杂,除了大豆[Glycine max(L.)Merr.]、橙子(Citrus sinensisL.)和拟南芥中控制苹果酸分泌的基因被解析外,其他研究仍停留在生理层面(表1)。与此同时,越来越多研究证明,根系分泌有机酸越多,植物的抗Al性和P利用率越高。Tan等[49]发现外源添加P可减轻Al毒害,推测P能改善Al胁迫下植物的根形态发育和营养吸收。Pellet等[50]认为小麦根尖分泌磷酸盐可能是一种潜在的耐Al机制。Dong等[51]发现在低P条件下,P高效大豆基因型比P低效大豆基因型具有更强的耐Al性。Ligaba等[52]证明与P低效葡萄(Vitis viniferaL.)品种相比,P高效葡萄品种在Al胁迫下积累和分泌的有机酸更多。Liao等[53]证实大豆在Al胁迫时分泌柠檬酸,缺P时分泌草酸,而当两种胁迫组合时分泌苹果酸。Zheng等[54]研究也表明,抗Al荞麦(Fagopyrum esculentumMoench.)品种比Al敏感品种具有更高的P利用率。
有机酸不仅在根际解Al毒和活化P,而且可以在细胞内实现Al3+的区隔化和P的释放(图1)。吸收动力学发现,Al3+能快速进入根细胞内。在水稻中,天然抗性相关巨噬蛋白(Natural resistance associated macrophage protein,Nramp)家族成员 Nrat1首先将Al3+转运到细胞内,然后通过半型ABC转运蛋白(Half-size ABC transporter)ALS1区隔到液泡中,形成Al-有机酸复合体(图1)[55-56]。在拟南芥中,水通道蛋白(Aquaporin)NIP1;2具有Al-苹果酸双向转运活性,可介导Al-苹果酸从根细胞壁进入共质体中,并将Al装载到木质部中实现根向地上部的运输(图1)[57]。细胞内的螯合解毒不仅有效降低Al3+对根细胞的伤害,还可从Al-P沉淀中释放出更多的可溶性P供细胞代谢所需(图1)。另外,液泡中的有机酸还可作为配体取代与金属离子(如Ca2+和Fe2+)结合的P,从而促进P的释放以及向细胞质的转运。在水稻中,这一过程由2个定位于液泡膜的无机P转运蛋白(Vacuolar phosphate efflux transporter,VPE)OsVPE1和OsVPE2所介导(图 1)[58]。
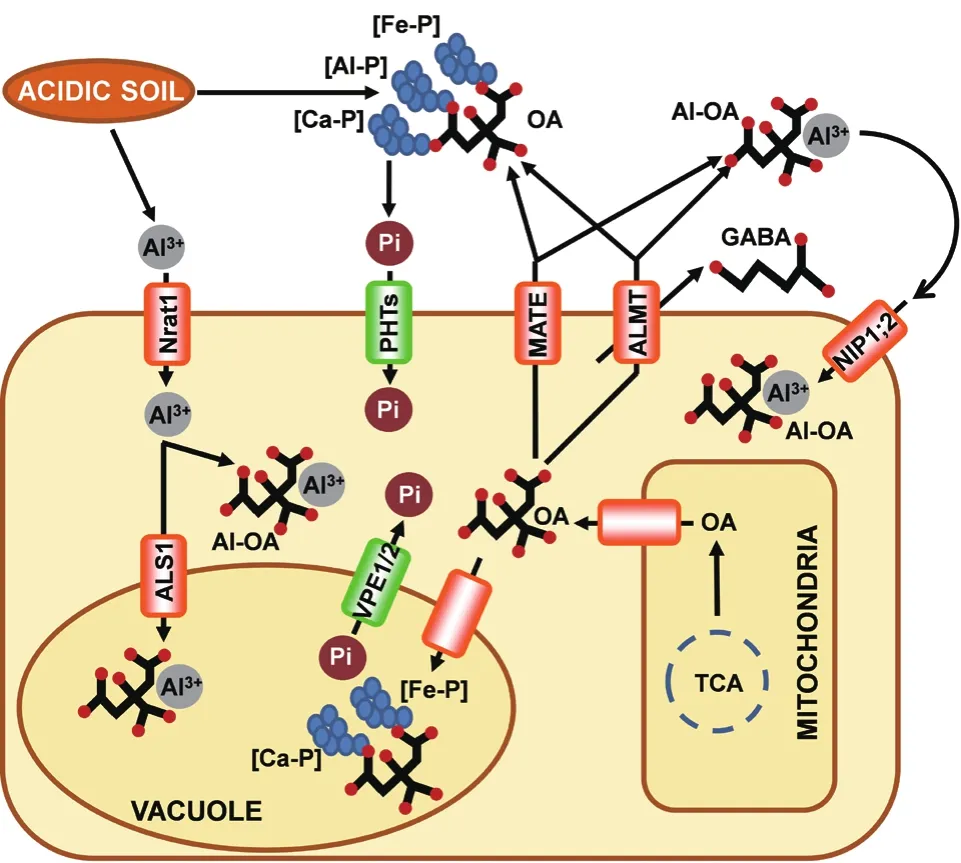
图1 有机酸在酸性土壤解Al毒和P活化中的作用(依据参考文献[10,30,55-58,63-64]绘制)
2 植物适应缺P和Al毒的分子机制
2.1 苹果酸和柠檬酸转运蛋白
小麦Al激活苹果酸转运蛋白(Aluminum-activated malate transporter,ALMT)基因TaALMT1是第一个被克隆的耐Al基因[10]。TaALMT1和AtALMT1(拟南芥直系同源基因)共同编码介导根尖苹果酸分泌的阴离子通道蛋白(图 1)[15,59-60]。虽然TaALMT1和AtALMT1在无Al3+情况下也具有转运活性,但经Al3+刺激能增强转运活性[15,59]。这种所谓的“Al激活”类似于配体-门控通道,Al与ALMT蛋白的结合有利于其开放状态的构象变化,从而促进苹果酸的转运。目前,虽然Al与ALMT结合的具体机制仍不清楚,但蛋白中存在的几个结构域可能与Al介导的ALMT活性增强有关[10,61-62]。有报道称,TaALMT1对氨基丁酸(Gamma-aminobutyric acid,GABA)也具有较高的渗透性(图1)。GABA不仅被TaALMT1运输而且可以调控TaALMT1的活性[63-64]。与ALMT1不同,Al诱导的柠檬酸分泌转运蛋白属于多种药物和毒性成分运出(Multidrug and toxic compound extrusion,MATE)家族亚组,最初通过图位克隆从高粱(SbMATE)[30]和大麦(Hordeum vulgareL.)(HvAACT1)[65]中被鉴定。随后在拟南芥(AtMATE1)[16]、玉米(Zea maysL.)(ZmMATE1)[26]、小麦(TaMATE)[11-12]、饭豆[Vigna umbellate(L.)Sweet.](VuMATE1 和 VuMATE2)[31-32]和水稻(Os-FRDL2和 OsFRDL4)[27,66]中发现同源蛋白。与ALMTs不同,MATEs介导pH依赖的柠檬酸转运,且不被 Al3+激活[26,30-32]。2007 年,Doshi等[67]在爪蟾和酵母细胞2套系统中证实,高粱SbMATE底物识别更加广泛,不仅可转运柠檬酸,还可以转运乙酰亚胺。
植物P利用率与ALMTs和MATEs表达的相关性已在大豆和小麦中被验证。在大豆P高效基因型HN89中,缺P诱导GmALMT1的上调表达可增加苹果酸的释放[36]。在大麦中过量表达小麦TaALMT1能提高酸性土壤作物的P吸收和籽粒产量[68],这在很大程度上归因于TaALMT1介导的抗Al性在酸性土壤中维持了根系的正常生长。同时,TaALMT1过表达大麦植株单位根系的P吸收量也增大,表明释放到根际的苹果酸推动了土壤P的活化和吸收[68]。进一步说明植物P有效性和抗Al性可能是通过ALMT的环境选择共进化的。随着研究的进一步深入,2种胁迫以调控根系发育为中心点的协同进化机制正被人们不断揭示。
2.2 STOP1/ALMT1的多效性调控
拟南芥C2H2锌指转录因子(Sensitive to proton rhizotoxicity,STOP1)AtSTOP1[69]和水稻直系同源蛋白(Al resistance transcription factor 1)OsART1[70]参与了转运蛋白基因的表达调控。其中,OsART1通过调控包括OsNrat1(Nramp aluminum transporter 1)、OsMGT1(Magnesium transporter 1)和OsFRDL4(Ferric redutase defective 4)在内的膜转运蛋白基因参与水稻的抗 Al性[27,55,71]。同样,AtSTOP1 通过调控AtALMT1、AtMATE1和AtALS3(一个推测的Al3+转运蛋白)的表达参与拟南芥对Al的抗性[16,69]。2017年,有研究发现,STOP1/ALMT1的作用并不仅局限于Al抗性上,还直接参与了缺P引起的根构型(Root system architecture,RSA)变化[47-48]。在缺P条件下,LPR1(Cell wall-targeted ferroxidase)/PDR2(P5-type ATPase)可诱导Fe3+和活性氧(reactive oxygen species,ROS)在根质外体中积累,进而导致胼胝质沉积和主根生长抑制(图2)[72]。进一步
研究表明,STOP1/ALMT1是缺P诱导主根伸长抑制所必需的[48]。缺P能上调ALMT1的表达,且外源添加苹果酸可回复almt1和stop1突变体根系缺P的不敏感表型[48]。在缺P条件下,STOP1通过调控ALMT1向根际分泌苹果酸,而LPR1将Fe2+氧化为Fe3+,苹果酸通过与Fe3+螯合促进Fe在根尖分生组织中积累,并激活ROS爆发(图2)[48]。积累的ROS可诱导细胞壁僵硬和增厚来抑制细胞伸长[48],也可诱导胼胝质沉积来阻碍SHORT-ROOT(SHR)转录因子的细胞间移动,最终导致根尖分生组织衰竭和主根生长抑制(图2)[48,72]。另外,苹果酸-Fe3+螯合物可在蓝光下发生光芬顿反应(Fenton reaction)产生游离的Fe2+,Fe2+进一步与质外体中受LPR1调控的过氧化氢(H2O2)结合产生羟基自由基(·OH)和Fe3+,从而抑制主根生长(图2)[73]。由于缺P诱导的侧根发生增强与主根生长抑制是同时发生的[74]。因此,ALMT1可通过增加总根表面积来扩大P向根表扩散,最终增加根系对P的吸收。
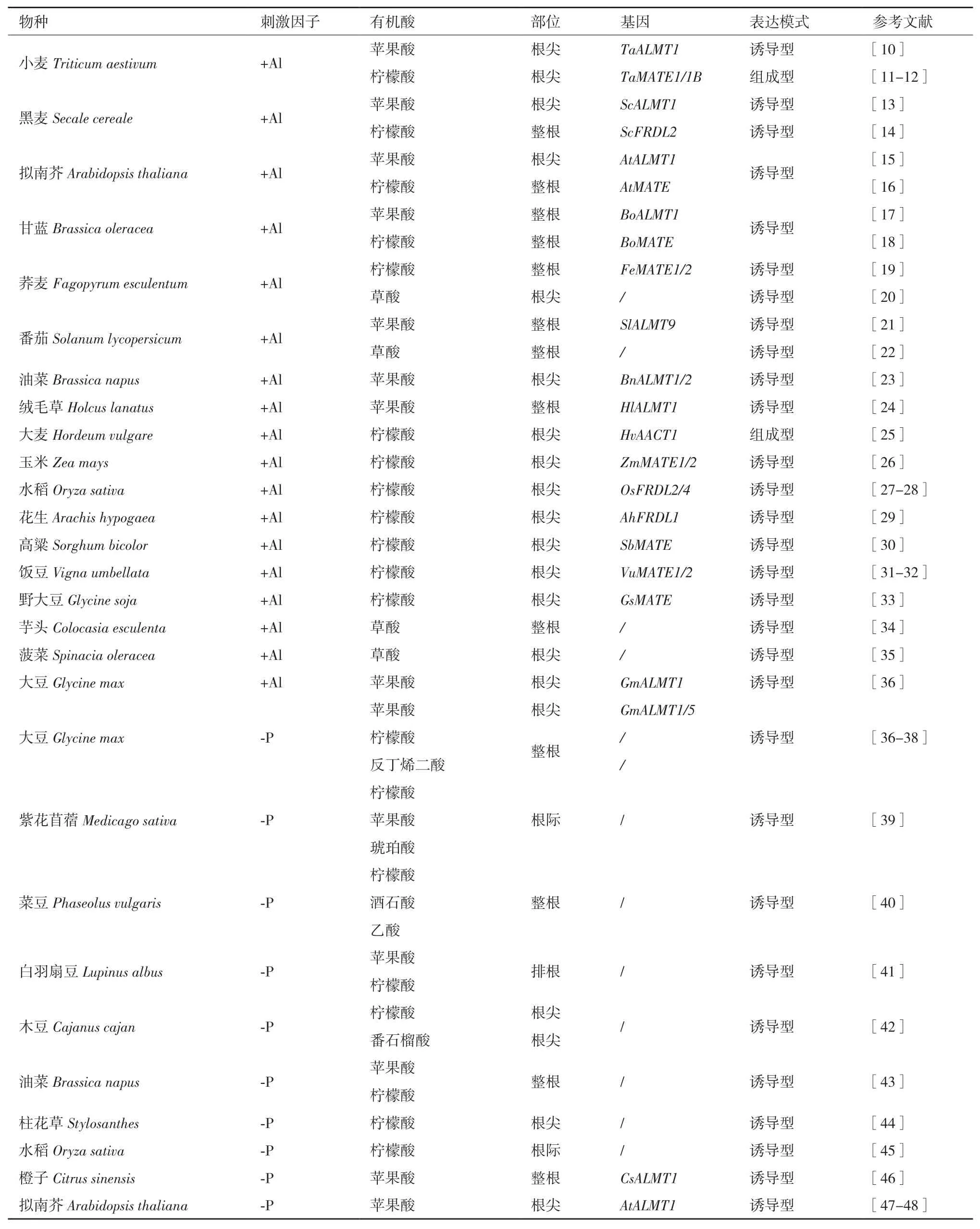
表1 不同物种应答Al胁迫和缺P的有机酸分泌模式
2.3 STAR1/ALS3的多效性调控
ALS3和 STAR1(Sensitive to Al rhizotoxicity1)是缺P反应导致根生长变化的另一组抗Al基因[75-76]。Larsen等[77]发现拟南芥als3突变体的Al敏感与Al吸收增强无关。图位克隆发现,ALS3是一个定位于根皮层、叶鞘和韧皮部细胞质膜的ABC转运蛋白[75],推测ALS3可能以一种特定的方式将Al从敏感组织移除,从而赋予了植株抗Al性。通常,ABC转运蛋白包含一个核苷酸(ATP)结合结构域和一个跨膜(TM)结构域,而ALS3和同源的细菌金属抗性蛋白ybbM都不具有ATP结合域(ABC转运活性所必需)。有意思的是,拟南芥另一个仅含ATP结构域而缺乏TM结构域的ABC转运子AtSTAR1也参与Al的抗性[76]。在水稻中,AtSTAR1的直系同源蛋白OsSTAR1(含有ATP结构域)与OsSTAR2(ALS3直系同源蛋白,含有TM结构域)被证实通过形成ABC转运复合体向细胞壁转运UDP-葡萄糖来修饰细胞壁从而赋予Al抗性[78]。推测拟南芥AtSTAR1也可能与ALS3(提供TM结构域)形成AtSTAR1/ALS3复合体来介导Al耐性[76]。然而,Dong等[79]研究却认为,AtSTAR1和ALS3的复合体定位于液泡膜上,且没有UDP-葡萄糖和P的转运活性。由于外源UDP-葡萄糖能够恢复缺P条件下atstar1和als3突变体的根生长。因此,仍然有理由相信ATSTAR1/ALS3可通过调节细胞壁代谢来介导缺P和抗Al响应。最近研究证实,荞麦FeSTAR1和FeSTAR2能发生互作,通过转运UDP-葡萄糖参与细胞壁多糖代谢来影响荞麦的抗Al性[80-81]。
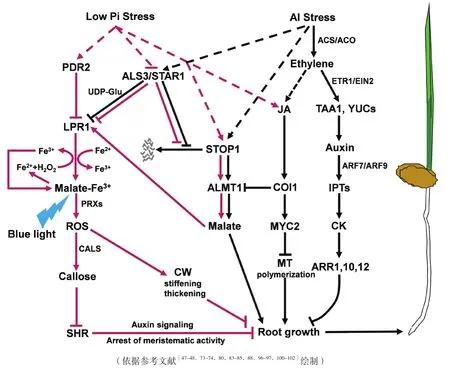
图2 缺P(紫线)和Al毒(黑线)诱导主根生长抑制机制模型
有意思的是,STOP1/ALMT1和STAR1/ALS3介导的多效性调节有明显的共性,即这两种途径都涉及缺P响应与Fe稳态间的信号交互。在缺P条件下,LPR突变体根中Fe积累减少,对缺P不敏感[48,72,79]。然而,由于 AtSTAR1/ALS3 通路中有UDP-葡萄糖,可逆转Fe的过度积累,从而回复缺P条件下als3突变体的短根表型(图2)[79]。与atmt1和stop1突变体不同,als3突变体在缺P条件下表现出主根生长抑制增强[79]。最新研究表明,ALS3/STAR1在STOP1/ALMT1和LPR1上游来控制缺P诱导的主根生长,而且ALS3/STAR1可以通过抑制STOP1蛋白在核中的积累来抑制STOP1/ALMT1途径(图2)[82]。进一步研究发现,这主要依赖于Fe能抑制缺P条件下RAE1(a F-box protein)介导的26S蛋白酶体对STOP1的降解(图2)[83]。另外,在缺P条件下,als3突变体中STOP1的过度积累依赖于Fe和Al3+,表明Fe2/3+和Al3+可以以类似的方式增加STOP1的稳定性及在细胞核中的积累,以激活ALMT1的表达[84]。结果表明,STAR1/ALS3介导的抗Al性与P吸收间可能存在拮抗作用。综上所述,ALMT1/STOP1和STAR1/ALS3诱导的根发育变化似乎是一个特异性的缺P反应,而以Fe稳态为中心的生理学机制可能是由ALMT1/STOP1和STAR1/ALS3介导不同的抗Al途径来调控缺P条件下根尖分生组织的重塑来实现的。
2.4 缺P和Al毒胁迫中的激素互作
研究报道生长素、乙烯、独脚金内脂和茉莉酸等植物激素在调控环境变化引起的根尖分生组织活性中发挥重要作用。研究表明,Al毒和P有效性可影响生长素的合成和运输,导致生长素分布和根系生长发生改变[85-87]。拟南芥lpr突变体主根对缺P响应的不敏感是通过生长素调控实现的[88-90]。而且,lpr1-1 lpr2-1双突变体也表现出在Al毒下增强主根的伸长[91],表明缺P和Al毒导致的主根生长变化可能由共同的生长素调控途径所介导[90]。同时,生长素受体(Transport inhibitor response 1,TIR1)和生长素响应因子(Auxin response factor,ARF)也参与缺P诱导的侧根的发生和形成调控[92]。随着Al浓度的增加,tir1-1单突变体和arf7-1 arf19-1双突变体对侧根密度刺激和主根生长的抑制减弱,表明缺P和Al胁迫介导的侧根发育也存在共同的生长素信号通路[92]。
乙烯参与缺P诱导的主根生长抑制、侧根伸长促进和根毛形成[93-94]。Al胁迫同样可激活主根的乙烯信号反应,如Al诱导的根抑制在乙烯信号突变体etr1-3和ein2-1中被减弱(图2)[87]。在拟南芥中,Al诱导主根生长素在根尖过渡区(分生区向伸长区的过渡区)的合成依赖于乙烯信号,并由两个参与色氨酸依赖的生长素合成关键酶家族基因YUCCA(YUC)和TAA所介导,最终导致主根生长抑制(图2)[95-96]。这些研究表明,依赖于乙烯信号的生长素合成在介导Al诱导的主根生长抑制中起着关键作用。然而,玉米生长素运出载体P-糖蛋白(Auxin efflux carrier P-glycoprotein,ZMPGP1)缺陷型突变体则显示较高的根尖过渡区生长素积累和Al抗性[97]。这一发现似乎与先前的结论相悖,生长素从过渡区向伸长区运输的减少是导致Al诱导玉米根伸长抑制的原因之一[85]。需要进一步试验证据来解释这种矛盾是由于物种或试验条件的差异,还是其他原因造成的。另外,在参与乙烯生物合成的12个ACS基因中,ACS2和ACS6均受到缺P和Al毒高度上调。同样,这两种胁迫也增强ACO1和ACO2的表达,表明ACS和ACO可能是导致拟南芥缺P和Al毒下乙烯爆发的原因之一[87,98]。
另一方面,Al胁迫诱导生长素在根尖过渡区的积累,会引起细胞分裂素的积累,导致主根生长抑制,表明生长素和细胞分裂素在这一过程中具有协同作用[99]。其中,细胞分裂素合成依赖于腺苷磷酸异戊烯转移酶(Isopentenyl transferase,IPT)。在生长素合成增强的yuc1D突变体中,Al诱导的IPT上调和细胞分裂素合成显著增强,而在arf7/19双突变体中这一过程则显著降低,表明这是一个生长素依赖的过程(图2)[99]。另外,茉莉酸也被报道与缺P相关[100]。在茉莉酸信号突变体coi1-34中,缺P诱导的主根抑制被部分解除。因此,COI1介导的茉莉酸信号参与缺P条件下下主根的生长抑制(图2)[100]。而在Al胁迫下,茉莉酸信号被乙烯所调控,并通过调控微管聚合和ALMT1介导的苹果酸分泌来抑制主根生长(图 2)[101]。
2.5 细胞壁相关激酶参与植物P吸收和Al耐性调控
细胞壁相关激酶(Wall-associated protein kinases,WAKs) 是 受 体 类 激 酶(Receptor-like kinases,RLKs)/Pelle超家族中的一个亚家族。WAKs家族蛋白通常由富含半胱氨酸(Cysteinerich,Cys-rich)的半乳糖醛酸结合域(Galacturonan binding domain,GUB_Wak)、表皮生长因子(Pidermal growth factor,EGF)重复序列、TM结构域,以及胞质丝氨酸/苏氨酸激酶域(Serine/threonine kinase domain)所构成,可跨越质膜并延伸至细胞壁[102]。Sivaguru等[103]发现Al能快速诱导拟南芥AtWAK1的表达,且过表达AtWAK1植株抗Al性增强。同样,在拟南芥中过表达饭豆NAC转录因子VuNAR1可正调控WAK1的表达来降低细胞壁果胶含量,从而提高抗Al性[104]。通过关联作图法,Hufnagel等[105]发现高粱中的水稻丝氨酸/苏氨酸受体激酶OsPSTOL1(Phosphorus-starvation tolerance 1)[106]直系同源蛋白SbPSTOL1参与了根表面积的增加,从而提高了低P土壤中高粱P的吸收和籽粒产量。SbPSTOL1和WAK蛋白(如AtWAK1)结构间的相似性表明它们的抗Al功能具有相关性[103,105]。最近的研究表明,GUB_Wak结构域中的氨基酸可与细胞壁中的果胶和低聚半乳糖醛酸共价结合[107-108]。因此,SbPSTOL1可能与WAKs一样,作为一种受体在细胞应答缺P的信号级联激活中发挥作用。考虑到SbPSTOL1在促进高粱根系生长和P吸收中均发挥作用,这类蛋白可能同时具有抗Al和增强P吸收的功能。
3 总结与展望
良好的根发育和根系构型是植物抵御酸性土壤Al毒和缺P胁迫所必需的。有机酸作为酸性土壤中植物抵御Al毒和缺P的关键物质,既在根际和细胞内螯合Al,又在根际和细胞内活化和释放P。因此,植物内外部机制在进化过程中协同促进了有机酸的合成和分泌(图1)。最近对STOP1/ALMT1和STAR1/ALS3介导的多效性调控研究从分子层面给我们提供了一些交互的实质信息,也证实了两种胁迫确实存在一些协同调控的中枢和检查点(如根发育)(图2)。然而,这些调控更多是基于对抗Al基因的认识拓展到缺P上的。已知的P信号途径,比如参与根系生长和P吸收转运的PHR、SPX、PHO和PHF等核心组分[7]是否也与参与耐Al调控(特别是有机酸分泌调控)还需进一步研究。
缺P和Al毒都可抑制主根生长并促进侧根生长。而植物激素,特别是生长素和乙烯在调节根系响应2种胁迫中有着重要作用(图2)。然而,由于不同物种间生长素转运蛋白基因的表达模式不同,且激素在促进或抑制根生长阈值上存在差异,导致不同物种间的根系发育变化在响应缺P和Al毒上也不尽相同。进一步研究激素是如何调节关键基因来提高抗Al性和P利用率就尤为重要。例如,水稻抗Al转录因子ART1调节至少30个与Al的内外解毒有关的基因[42]。但激素是否也参与ART1调控的Al信号途径中尚不清楚。此外,Al毒和缺P引发根系有机酸的分泌是二者之间共有的一种机制,激素是如何调节有机酸转运蛋白基因也缺乏了解。
在酸性土壤中,研究主要集中在抗Al基因对作物生产力的影响,但这些基因对作物P利用率的多效性影响应得进一步关注。此外,对缺P和Al毒互作调控的认识大多来自拟南芥,而将基础研究结果转化为在育种上来创制作物新品种的研究还比较少。通过作物品种内存在的遗传变异去鉴定抗Al基因,无疑是最适合培育酸性土壤中高产作物的分子工具。随着技术的进步,设计和培育出具有理想根系的“智能”作物将成为可能,实现酸性土壤中既能提高P利用率,又能抵抗Al毒,从根本上减少P肥消耗和实现农业的可持续发展。

