云南小叶种茶树叶片和茎段愈伤组织诱导及继代培养
亓 峥, 庞志强, 蓝增全*
(1.西南林业大学生态与环境学院,昆明 650224;2.中国科学院西双版纳热带植物园热带植物资源可持续利用重点试验室,昆明 650223;3.中国科学院大学,北京 100049)
云南是茶树的起源地之一,茶树品种资源丰富,尤其是野生资源。同时,云南也是中国产茶大省,茶叶生产在云南农业经济中占有重要的地位[1-3]。研究表明,相较于云南大叶种茶,云南小叶种茶中胡萝卜素和叶黄素的含量较高,可制出高香型茶,“十里香”即是典型的云南小叶种茶树[4]。
随着茶叶产业的发展,选育优良茶树品种的需求也越来越迫切。但茶树基因具有高度的杂合性,传统的育种方法在新品种选育中较为困难[5-7]。茶树组织培养具有培养时间短、繁殖系数大、后代可保持亲本优良性状的优点,能够利用较少的茶树材料、在短时间内产生较多的植株。在实际生产中具有重大的实践意义,对于优良品种快速繁殖、新品种推广种植、种植资源的保存具有重要的意义[8-10]。
茶树组培过程中仍存在愈伤组织诱导率低、易褐化、难以分化、基因不能按序表达等问题[11]。目前,茶树组织培养技术不够成熟,尤其是在无性快繁、保存种质资源,建立外源基因转化的受体系统等方面[12-13],且前人在茶树组织培养中多选用胚作为外植体材料,鲜见以茶树叶片及茎段为外植体诱导愈伤组织的报道。
为此,通过研究不同消毒方法对云南小叶种“十里香”成活率及消毒效果的影响,获得优质的无菌试管苗,并以无菌苗的叶片和茎段为外植体,探索不同培养基类型、激素种类及浓度配比对愈伤组织诱导的影响,以期建立稳定的愈伤快繁体系,为其他茶树良种的推广和繁育提供参考。
1 材料与方法
1.1 试验材料
原材料选用云南小叶种“十里香”,采自云南农业大学教学茶园。
1.2 试验方法
1.2.1 无菌试管苗萌发
将茶种剥去果皮和种皮,洗净,置于超净工作台中。通过4%次氯酸钠溶液和75%酒精组合消毒方式(表1)进行外植体消毒,统计污染率和发芽率。

表1 不同茶种消毒方法Table 1 Different disinfection methods for tea seeds
1.2.2 茶树叶片组织培养
将无菌试管茶苗叶片剪去叶边和叶缘,剪成0.5 cm×0.5 cm方片,在叶片上沿叶脉方向划出伤口,叶片正面向上,置于培养基上。每瓶培养基中接种5枚叶片,每种培养基处理接种20瓶(下同),重复3次。培养过程中每5 d观察1次,统计培养物的形态、颜色和生长情况,培养30 d,统计诱导率。通过正交试验(MS培养基、1/2MS培养基、B5培养基与4种激素配比)获得最适宜诱导茶树叶片愈伤组织的配方,叶片愈伤组织诱导培养基配方如表2所示。

表2 叶片愈伤组织诱导培养基配方Table 2 Formula of leaf callus induction medium
筛选出茶树叶片愈伤组织生长较好的培养基作为继代培养基(表3),将诱导出的愈伤组织用手术刀切下,置于叶片愈伤组织继代培养基中,继续增殖诱导,每5 d观察1次,培养20 d,统计叶片愈伤组织增长大小及状态。
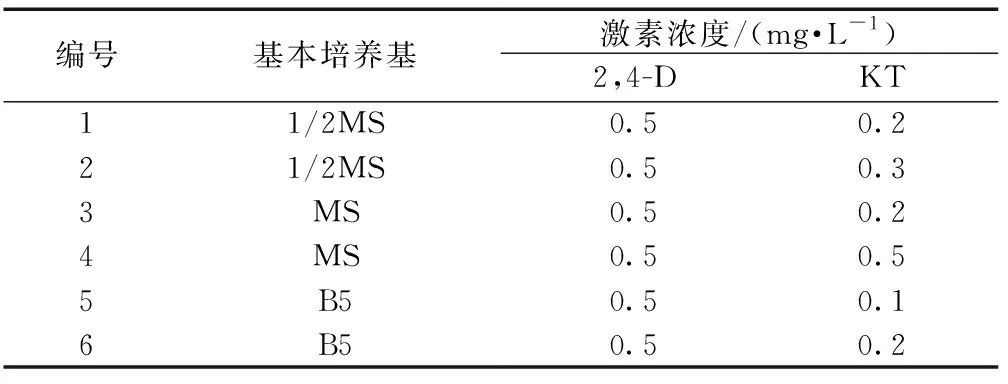
表3 叶片愈伤组织继代培养基配方Table 3 Formula of subculture medium for leaf callus
1.2.3 茶树茎段组织培养
将无菌苗不带腋芽的茎段用手术刀切成0.5 cm的小段,放置于茎段愈伤组织诱导培养基(表4)中,使有切口的两端接触培养基,每瓶培养基中接种5个茎段,每个处理接种20瓶(下同)。培养过程中每5 d观察1次,统计培养物的形态、颜色和生长情况,培养30 d,统计诱导率。通过正交试验(MS培养基、1/2 MS培养基、B5培养基与4种激素配比)获得适宜诱导茶树茎段愈伤组织的配方。
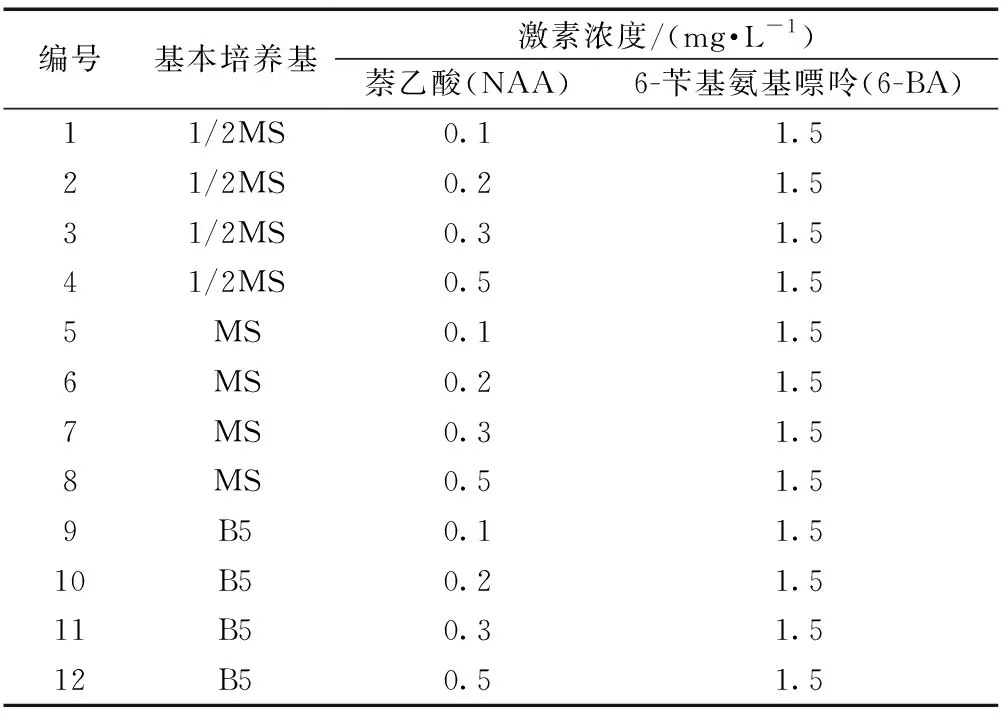
表4 茎段愈伤组织诱导培养基配方Table 4 Formula of callus induction medium for stem segment
筛选出茶树茎段愈伤组织生长较好的培养基作为继代培养基(表5),将诱导出的愈伤组织用手术刀切下,置于茎段愈伤组织继代培养基中,继续增殖诱导,每5 d观察1次,培养20 d,统计叶片愈伤组织增长大小及状态。
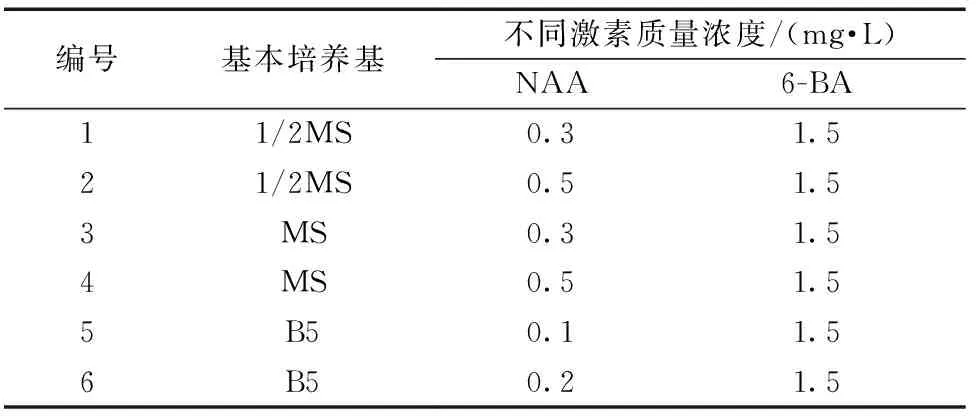
表5 茎段愈伤组织继代培养基配方Table 5 Formula of subculture medium for stem callus
1.2.4 培养条件
每升添加蔗糖30 g,琼脂7 g,pH为5.7。在无菌培养室中培养,环境条件为(25±2) ℃,相对湿度60%~70%,避光暗培养。
1.3 数据统计与分析
外植体按上述培养方式进行接种培养,每隔5 d对愈伤组织诱导情况、增殖情况及分化情况进行观察记载,及时清理污染的外植体,通过数据分析选择出适宜云南小叶种茶树叶片及茎段愈伤组织诱导的培养方案。
利用Microsoft Excel 2007处理试验数据;SPSS 24.0进行方差分析和Duncan多重对比。
试验主要统计指标:

(1)

(2)

(3)
2 结果与分析
2.1 不同消毒方法对种子萌发的影响
通过筛选,具体筛选方法见表6,确定茶树种子适宜消毒方式,降低污染率,有利于后续试验的进行。结果表明,使用单一消毒剂比酒精和次氯酸钠结合使用消毒效果差。综合污染率、成活率及时间成本,茶种最佳消毒方法为次氯酸钠消毒10 min、酒精消毒30 s。

表6 不同消毒方法对种子萌发的影响Table 6 Effects of different disinfection methods on seed germination
当消毒试剂只有4%次氯酸钠时,污染率随着次氯酸钠消毒时间的增加而降低,同时,成活率也随着次氯酸钠消毒时间增加而降低,说明在4%次氯酸钠溶液中浸泡时间过长会对植物材料产生毒害作用,从而影响种子的萌发率和成活率。当添加75%酒精时,污染率呈下降的趋势,说明75%酒精对污染控制有明显作用,但75%酒精消毒时间对成活率并无明显影响。
在试管苗萌发过程中,观察到部分茶苗出现变异现象,变异形态各异,如图1所示,具体变异原因还有待进一步考证。

图1 种子萌发的不同状态Fig.1 Different state of seed germination
2.2 叶片愈伤组织诱导及继代培养
叶片愈伤组织诱导试验使用12种培养基,在含有不同植物生长调节剂的1/2MS、MS和B5培养基上培养30 d,统计愈伤组织诱导率,有8种培养基可使叶片愈伤组织诱导率达到50%以上。在9号、10号、11号、12号培养基中,叶片愈伤组织诱导率达到85%以上。综合出愈率、生长状况以及方差分析结果,得出适宜诱导叶片愈伤组织培养基的配方是 B5+0.5 mg/L 2,4-二氯苯氧乙酸(2,4-D)+0.1 mg/L 激动素(KT),诱导率达到97.67%。由表7可知,B5培养基对叶片愈伤组织的诱导影响显著,以B5培养基为基本培养基的愈伤组织诱导率均在85%以上。而以1/2MS培养基为基本培养基的愈伤组织诱导率不理想,诱导率最低时仅为24.33%。
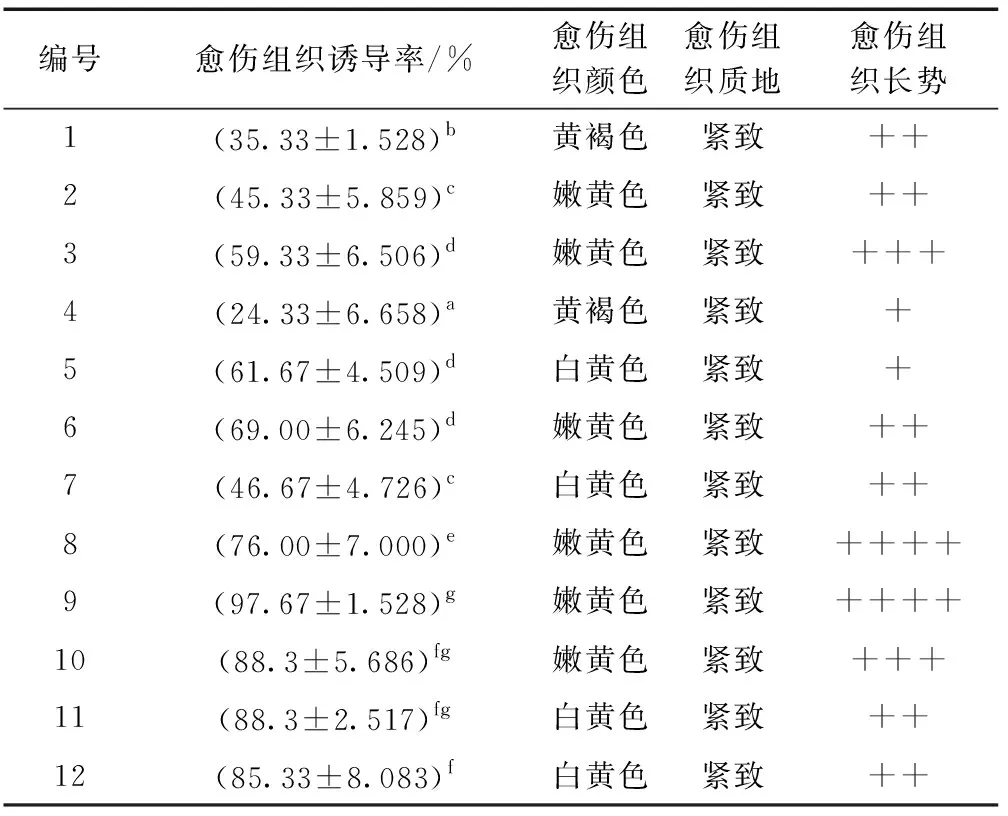
表7 叶片愈伤组织诱导结果分析Table 7 Analysis of callus induction from leaves
不同激素浓度配比也会影响出愈率和愈伤组织的生长状况。在1/2MS培养基中,愈伤组织诱导率随着KT浓度的升高呈先升高后降低的趋势,KT浓度为0.1 mg/L和0.5 mg/L时,愈伤组织呈现黄褐色,生长状况不佳且出愈率较低,仅为20%~30%;MS基本培养基中,愈伤组织生长状况明显优于1/2MS培养基,愈伤组织诱导率随着KT浓度的变化不规律,其中,0.5 mg/L激动素(KT)出愈率最高,且愈伤组织色泽嫩黄,质量较好(表7),生长状况如图2所示。B5培养基中质0.1 mg/L激动素(KT)的叶片出愈率最高,随着KT浓度的升高,愈伤组织诱导率逐渐下降,死亡率上升。

图2 不同培养基诱导叶片愈伤组织生长状况Fig. 2 Growth of leaf callus induced by different mediums
叶片愈伤组织继代培养试验采用6种培养基,在含有不同植物生长调节剂的1/2MS、MS和B5培养基上培养20 d后进行统计。由表8可知,3种基本培养基均可使愈伤组织增殖,但增殖效果有差别。统计结果表明,长势最好的培养基为5号培养基,色泽嫩黄,质地疏松,呈颗粒状,长势较好。长势最差的是2号培养基,颜色呈黄褐色,质地紧实,长势较差。生长状况如图3所示。综合增殖率和愈伤组织生长状况,故适宜云南小叶种茶叶片愈伤组织继代培养基的配方是B5+0.5 mg/L 2,4-D+0.1 mg/L激动素(KT),与上述适宜诱导叶片愈伤组织的培养基配方相同。同时,综合分析试验数据发现,在3种基本培养基中,KT浓度为0.5 mg/L时,愈伤组织增殖率较低,且增殖愈伤组织质地紧实,生长状态相对较差。
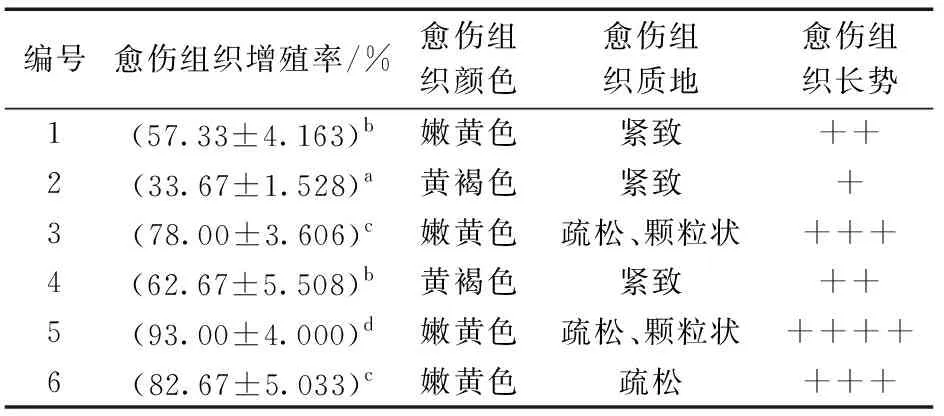
表8 叶片愈伤组织继代培养结果分析Table 8 Analysis of subculture result of leaf callus

图3 不同培养基继代叶片愈伤组织生长状况Fig.3 Growth of callus in leaves subcultured on different mediums
2.3 茎段愈伤组织诱导及继代培养
茎段愈伤组织诱导试验使用12种培养基,在含有不同植物生长调节剂的1/2MS、MS和B5培养基上培养30 d,统计愈伤组织诱导率,有4种培养基可使茎段愈伤组织诱导率达到80%以上。在其中8号中,茎段愈伤组织诱导率达到了93%。综合出愈率、生长状况以及方差分析结果,得出适宜诱导茎段愈伤组织的培养基配方是MS+1.5 mg/L 6-苄基氨基嘌呤(6-Benzylaminopurine,6-BA)+0.2 mg/L萘乙酸(1-naphthaleneacetic acid,NAA),且诱导出的愈伤组织质地疏松,呈现嫩绿色,增殖速度较快。
由表9可知,在1/2MS培养基中,愈伤组织诱导率出现随着NAA浓度的升高而升高的趋势,NAA浓度为0.1 mg/L时,愈伤组织呈现嫩白色(图4),生长状况不佳且出愈率较低,仅为35%;MS基本培养基中,愈伤组织生长状况优于1/2MS和B5培养基,随着NAA浓度的增加,愈伤组织诱导率逐渐升高,NAA浓度为0.5 mg/L时出愈率最高,且愈伤组织色泽嫩绿,质量较好;B5培养基中,KT浓度为0.1 mg/L时叶片的出愈率最高,随着KT浓度的升高,愈伤组织诱导率呈下降的趋势。

表9 茎段愈伤组织诱导结果分析Table 9 Analysis of Callus Induction from Stem Segment

图4 不同培养基诱导茎段愈伤组织生长状况Fig. 4 Growth of callus in stem segments induced by different media
茎段愈伤组织继代培养试验使用6种培养基,在含有不同植物生长调节剂的1/2MS、MS和B5培养基上培养20 d后进行统计。3种基本培养基均可使愈伤组织增殖,但增殖效果有差别。统计结果(表10)表明,长势最好的培养基为4号培养基,色泽嫩绿,质地疏松,呈颗粒状,长势较好。长势最差的是1号培养基,颜色呈嫩白色,质地紧实,长势较差。由此分析可知,云南小叶种茶茎段愈伤组织继代培养基最佳配方为MS+1.5 mg/L 6-BA+0.2mg/L NAA,与上述适宜诱导茎段愈伤组织的培养基配方也相同。
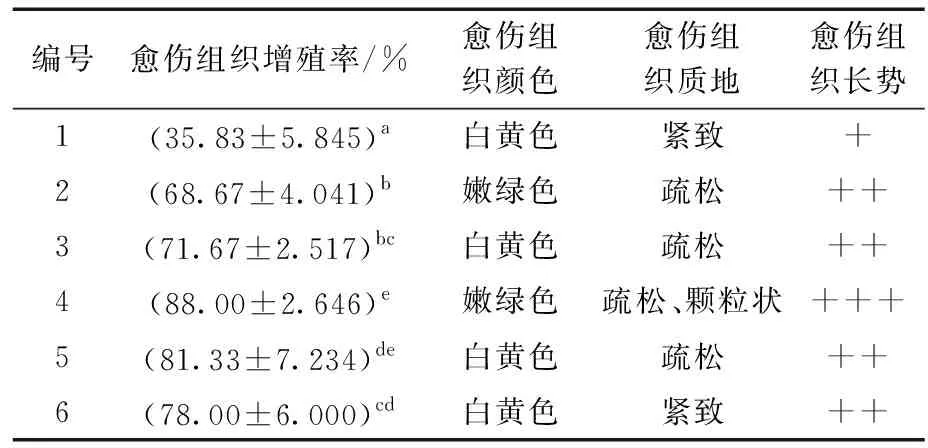
表10 茎段愈伤组织继代培养结果分析Table 10 Analysis of subculture result of stem callus
3 讨论
培养无菌苗是实现遗传转化方面分子生物学育种的基础,通过种子萌发培育试管苗是常用的技术路线。外植体表面污物和内生菌、消毒方法不当、外植体取材时间和部位等均可引起污染[14-15]。目前,常用的消毒剂有75%酒精、0.1%升汞、次氯酸钠(2%~5%)和抗生素类杀菌剂等,且使用联合消毒剂能有效降低污染率。但部分消毒剂如升汞,在消毒中会有残留,对植物材料有毒害作用,且会污染环境。研究发现在花梨木茎段消毒[16]和苹果叶片消毒[17]中,使用次氯酸钠消毒的褐化率较升汞低,且成活率较高。研究结果表明,适宜用于云南小叶种茶树“十里香”种子消毒的组合为4%次氯酸钠消毒10 min+75%酒精消毒30 s。次氯酸钠消毒时间长,主要是由于种子较硬且表面污物较多。
培养基种类、激素种类及配比对愈伤组织诱导影响很大,在使用中需要具体探讨[18-21]。研究发现在叶片愈伤组织诱导试验中,在接种15 d后叶片开始膨大,叶缘隆起,叶片周围开始出现黄白色愈伤组织,25 d后愈伤组织逐渐膨大,30 d后不同培养基上外植体的出愈率以及愈伤组织的生长状况出现了明显差别,以B5为基本培养基诱导出的愈伤组织比以1/2MS、MS为基本培养基诱导出的质量好,愈伤组织呈现嫩黄色、质地紧实,且出愈率达到97.67%。B5+0.5 mg/L 2,4-D+0.1 mg/L KT适宜作为云南小叶种茶树叶片的诱导培养基,诱导出的愈伤组织嫩黄致密,且不易褐化。在茎段愈伤组织诱导试验中,适宜的配方是MS+1.5 mg/L 6-BA+0.2 mg/L NAA。研究发现,相较于1/2MS和B5培养基,MS基本培养基更适宜于茶树茎段愈伤组织的诱导。适宜叶片愈伤组织诱导的基本培养基是B5,而适宜茎段愈伤组织诱导的基本培养基是MS,这可能是与MS和B5培养基成分不同有关,MS培养的无机盐离子浓度较高,而B5培养基无机盐浓度较低。相对于MS培养基,B5培养基铵的浓度更低,而铵可能对有些培养基有抑制生长的作用[22-24]。也可能因为叶片和茎段的内源激素水平不同,对外源激素的敏感度不同,培养结果也不同[25-26]。同时,在对比相同基本培养基、不同激素配比的愈伤组织诱导情况发现,适宜激素质量浓度对愈伤组织诱导效果较好,过低或过高质量浓度都会使出愈率下降,且愈伤组织长势较差,后期易褐化。这与白芝兰等[27]的研究结果相似。在今后试验中可以尝试对不同种类和质量浓度生长素和细胞分裂素进行组合,研究其对云南小叶种茶树愈伤组织增殖和分化的影响。
不同生长素和细胞分裂素配比、不同基本培养基都会对愈伤组织的增殖产生直接影响[28-29]。适宜叶片愈伤组织增殖的继代培养基配方与叶片诱导培养基的配方一致:B5+0.5 mg/L 2,4-D+0.1 mg/L激动素(KT);同样,在茎段愈伤组织继代试验中发现,适宜增殖的继代培养基配方也与茎段愈伤组织诱导培养基配方相同:MS+1.5 mg/L 6-BA+0.2 mg/L NAA。不同细胞分裂素对愈伤组织增殖的影响也不同,叶片继代培养基使用KT,愈伤组织呈现嫩黄色,质地疏松;茎段继代培养基使用6-BA,愈伤组织呈嫩绿色,质地致密。试验中还发现,经过转瓶后,部分愈伤组织容易褐化,在后续试验中,可以研究不同抗褐化剂对愈伤组织褐化的抑制作用。同时,对比茶树叶片和茎段的愈伤组织生长状况发现,叶片愈伤组织生长状态更佳,且质地疏松,因此茶树叶片更适宜作为建立茶树细胞悬浮系的外植体。而关于云南小叶种茶树叶片和茎段愈伤组织分化,还有待进一步研究。
4 结论
以云南小叶种茶树“十里香”种子为外植体,经消毒处理后培育出无菌试管苗。基于无菌试管苗的叶片和茎段进行愈伤组织的诱导和增殖,以期为云南小叶种茶树组织培养及遗传转化体系的建立提供参考,也为云南小叶种茶树的进一步研究奠定了基础。试验成功诱导出质量较优且生长状态良好的愈伤组织,但在后续试验中,要继续研究如何克服培养中后期褐化问题,诱导愈伤组织分化不定芽以及不定芽生根和移栽需要进行试验研究。

