肺结核患者短程督导治疗期死亡概率预测模型建立与评价
谢祎,韩晶,于维莉,侯志丽,吴琦△
自2007年以来,结核病一直位居单一传染性疾病死因之首,是全球前10位死因之一[1],仍是目前需重点关注的重大公共卫生问题。2018 年全球新发结核病患者约1 000万例,全球估算结核病死亡人数约124 万例,死亡率为16/10 万[1]。我国每年新发结核病患者约90万例,在全球30个结核病高负担国家中位列第3位[2]。我国自1992年以来在全国范围内推行现代结核病控制策略(DOTS)并取得成效,但在我国传染病疫情网络报告系统中,肺结核报告发病数仍位居甲、乙类传染病第2位,死亡在主要传染病死因顺位中排第3 位[3]。有相关研究表明超过半数的结核病患者死亡发生在结核病治疗的前2个月[4]。为提高临床医师与结核病防治人员对结核病治疗期死亡风险的预判能力,进而降低肺结核病死率,本研究采用回顾性队列研究,对2014—2017年于本院确诊登记的肺结核患者调查分析,建立肺结核患者短程督导治疗期死亡风险预测模型,并对其预测效果进行评价。
1 资料与方法
1.1 资料来源 2014年1月1日—2017年12月31日在天津市市级结核病定点医院确诊并登记的Ⅲ型肺结核患者共7 163 例,均来自天津市以及河北省的常住人口。肺结核诊断按照WS288-2008《肺结核诊断标准》[5]及中华医学会结核病分会2000年制定的《肺结核诊断和治疗指南》[6],并结合患者病史、临床表现和实验室检查结果确诊。排除确诊后拒绝抗结核治疗、诊断当天死亡、诊断变更及随访期失访者共131例,最终纳入7 032例为研究对象。
1.2 方法 通过国家“结核病管理信息系统”及医院信息系统(HIS)收集所纳入研究的肺结核患者的基本信息、疾病特征和督导期治疗转归,主要包括性别、年龄、民族、治疗分类(初复治)、首次痰菌结果、症状出现至就诊时间、就诊至确诊时间、胸部影像检查是否有肺部空洞[5]、人类免疫缺陷病毒(HIV)检测结果、对一线抗结核药物的耐药情况、抗结核治疗方案、抗结核治疗期转归等资料。其中,患者出现肺结核临床症状至首次到医疗机构就诊的时间间隔>14 d 为就诊延误,从首次就诊至被确诊为肺结核的时间间隔>14 d为确诊延误[7]。对确诊的肺结核患者,依据《传染病防治法》及《中国结核病防治规划实施工作指南》[8](简称《指南》)的要求及时进行传染病网络直报、治疗和管理,由结核病防治人员实施督导化疗和随访管理。随访通过电话或家访联系患者,患者按指南要求定期至结核病定点医院进行随访检查,包括痰涂片、痰培养、胸部影像检查、血常规、肝肾功能等,研究结局为随访期死亡,包括全死因死亡。《指南》规定的督导治疗期:(1)初治肺结核患者一般督导治疗6个月,新涂阳肺结核患者治疗到2 个月末痰菌检查仍为阳性,则应延长1 个月的强化期治疗,督导治疗7个月。(2)复治肺结核患者一般督导治疗8 个月;因故不能用链霉素的患者,延长1 个月的强化期,督导治疗9 个月;如复治涂阳肺结核患者治疗到第2 个月末痰菌仍阳性,使用链霉素方案治疗的患者则应延长1个月的复治强化期方案治疗,督导治疗9个月;未使用链霉素方案的患者则应再延长1个月的强化期,继续期治疗方案不变,督导治疗10个月。随访截止时间为2018年12月31日。
1.3 统计学方法 采用SPSS 19.0 软件对数据进行统计分析,符合正态分布的计量资料以均数±标准差()表示,2组间比较采用独立样本t 检验;非正态分布的计量资料以M(P25,P75)表示,组间比较采用Mann-Whitney U检验。计数资料以例(%)表示,组间比较采用χ2检验;以肺结核患者短程督导治疗期内死亡作为患者预后的结局变量,通过多因素非条件Logistic 回归模型筛选死亡有关的独立危险因素,建立死亡风险预测模型。采用Hosmer-Lemeshow(H-L)检验评价死亡预测模型的拟合优度[9]。绘制受试者工作特征(ROC)曲线并计算曲线下面积(AUC)评价死亡预测模型的效能,0.5≤AUC<0.7表示诊断价值较低,0.7≤AUC<0.9表示诊断价值中等,AUC≥0.9 表示诊断价值较高[10]。检验水准为双侧α=0.05。
2 结果
2.1 患者临床资料 7 032 例肺结核患者中,男4 921 例(69.98%),女2 111 例(30.02%);年龄12~101 岁,平 均(50.12±19.99)岁;汉 族6 920 例(98.41%),少数民族112 例(1.59%);初治5 638 例(80.18%),复治1 394 例(19.82%);首次痰菌结果阳性3 302 例(46.96%),首次痰菌结果阴性及未查痰3 730例(53.04%);就诊延误1 988例(28.27%),未延误5 044 例(71.73%);确诊延误1 763 例(25.07%),未延误5 269 例(74.93%);肺部有空洞1 476 例(20.99%),肺部无空洞5 556 例(79.01%);HIV 阳性19 例(0.27%),阴性7 013 例(99.73%);药敏结果显示耐多药者902 例(12.83%),非耐药及未查药敏者6 130 例(87.17%);短程督导治疗期内存活6 711 例(95.44%,生存组),死亡321 例(4.56%,死亡组),其中有50.47%(162/321)的死亡患者出现在抗结核治疗期间前2个月的强化期。
2.2 生存组与死亡组患者基本情况比较 死亡组年龄高于生存组,男性、复治、首次痰菌结果阳性、就诊延误、HIV阳性所占比例高于生存组(P<0.05);2组患者汉族、确诊延误、肺部空洞、耐药所占比例比较差异无统计学意义(P>0.05),见表1。
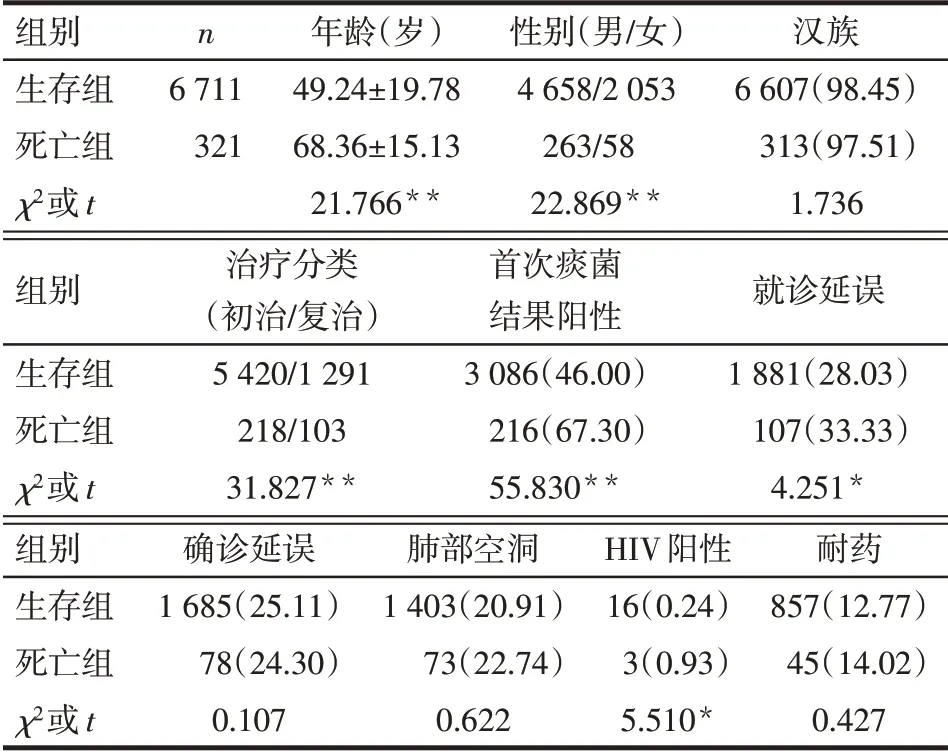
Tab.1 Comparison of basic data between survival group and death group表1 生存组与死亡组患者基本资料的比较
2.3 肺结核患者短程督导治疗期死亡风险预测模型的建立 以肺结核患者短程督导治疗期内是否死亡为因变量,以表1中的指标作为自变量,变量赋值见表2,进行多因素非条件Logistic回归分析,结果显示,男性、高龄、复治肺结核、首次痰菌结果阳性、就诊延误、HIV 阳性是肺结核患者死亡的独立危险因素。建立Logistic 回归方程为:Logit(P)=ln[P/(1-P)]=0.653X1+0.061X2+0.431X4+0.661X5+0.337X6+1.424X9-9.191,P为死亡概率预测值,建立死亡概率预 测 值 回 归 方 程[11]:P=1/[1+e-(0.653X1+0.061X2+0.431X4+0.661X5+0.337X6+1.424X9-9.191)],见表3。
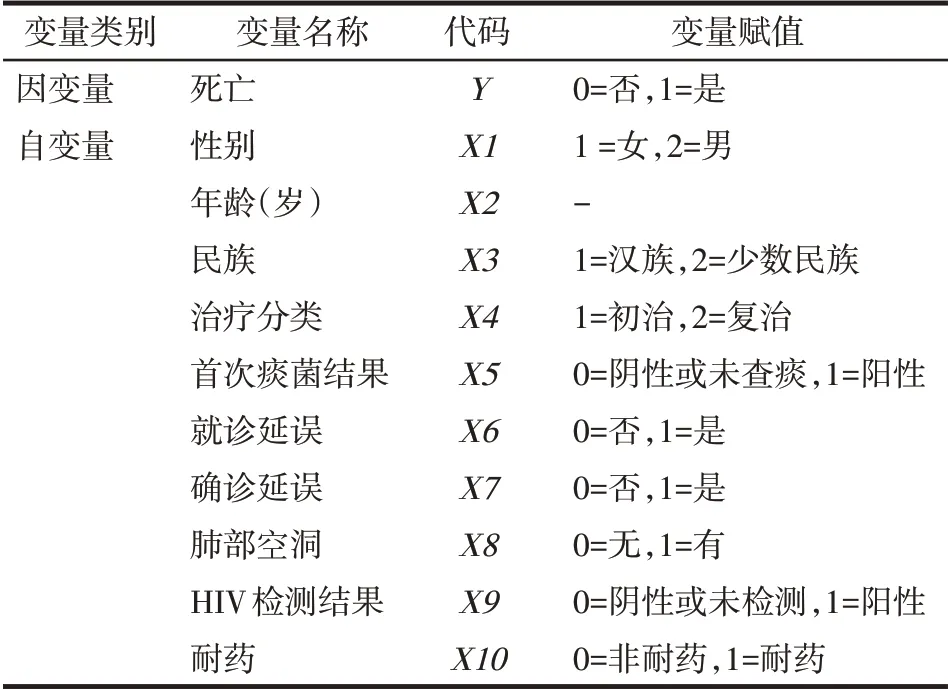
Tab.2 Variable assignment table of Logistic stepwise regression analysis表2 多因素Logistic回归分析变量赋值表
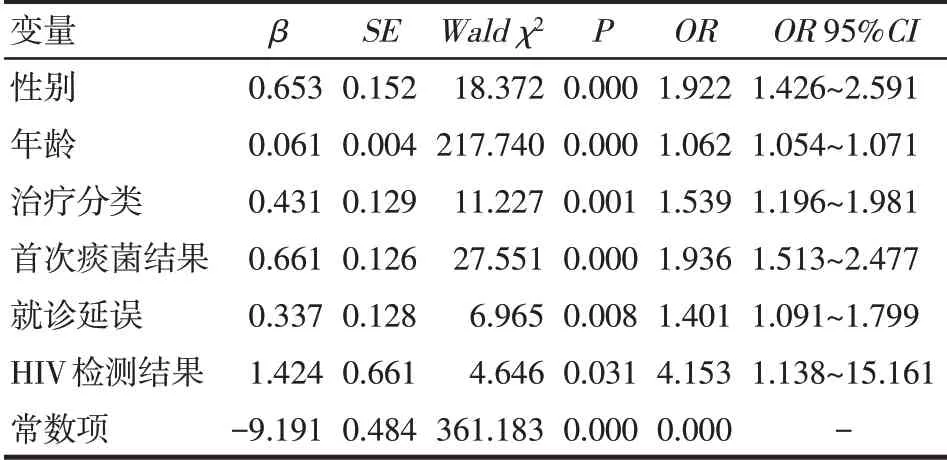
Tab.3 The multivariate unconditional Logistic regression analysis of risk factors of mortality in pulmonary tuberculosis patients during directly observed treatment short-course表3 肺结核患者短程督导治疗期死亡危险因素多因素非条件Logistic回归分析
2.4 风险预测模型的评价 通过分析Logistc 回归模型的拟合优度和预测效能来检验模型预测能力。采用H-L 检验评价Logistc 回归模型的拟合优度,结果显示,该模型的拟合度较好(χ2=5.770,df=8,P=0.673)。计算患者的死亡概率预测值P,绘制ROC曲线评价Logistc 回归模型的预测效能(图1),结果显示,其曲线下面积(AUC)为0.806(95%CI:0.784~0.828),最佳临界值为0.054,敏感度为76.36%、特异度为81.58%,假阳性率18.42%、假阴性率23.64%,阳性预测值36.54%,阴性预测值98.63%,阳性似然比为4.145,阴性似然比为0.289。
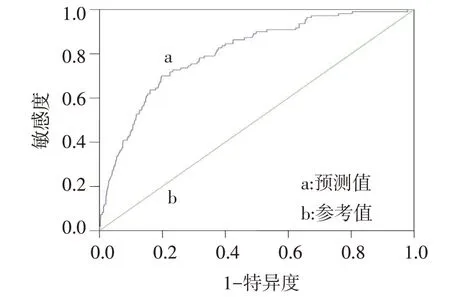
Fig.1 The ROC curves of death risk prediction model图1 死亡风险预测模型的ROC曲线
3 讨论
本研究对2014—2017年天津市7 032例肺结核患者短程督导治疗期的随访资料进行回顾性分析发现,督导治疗期内死亡321 例(4.56%),与国内外其他研究相比,高于广州2.8%[12]、凯里市2.1%[13]、纽约2%[14];但 低 于 尼 日 利 亚16.6%[15]、埃 塞 俄 比 亚12.71%[16]、印度6%[17],处于中等水平。有50.47%(162/321)的死亡患者出现在抗结核治疗期间前2个月的强化期,与其他研究结果相一致[4]。
非条件Logistic 回归分析近年来已经广泛应用于疾病的危险因素研究和相关风险预测模型建立,并被证实在慢性乙型肝炎、甲型流感等疾病的预后研究中具有较好的评估价值[18-20]。1992 年以来,我国逐步推行DOTS 策略对肺结核患者进行治疗管理,将强化期末痰菌阴转率和患者治愈率、治疗成功率作为化疗效果的主要考核指标,未考虑多因素对于DOTS策略及患者死亡的影响。蒋莉等[21]构建了适用于初治涂阳肺结核患者化疗结局的Logistic 预测模型,伍小英等[22]采用前瞻性追踪研究方法建立初治涂阳肺结核治愈后近期复发的Logistic 回归模型,其预测效果均较好。关于肺结核患者短程督导治疗期内死亡的危险因素分析和模型建立少见报道,对患者死亡的危险因素分析和建立相应的预测模型将有利于肺结核患者督导治疗期管理水平的提高,降低病死率,改善患者预后。
本研究结果显示,男性患者死亡风险为女性的1.922 倍,与以往研究结果一致[23]。WHO 报告也指出,男性结核病发病数及死亡数均高于女性,57%新发患者为成年男性,死亡风险高,其原因可能是男性工作和社会压力大、吸烟饮酒、生活无规律、抵抗力相对较差,而女性拥有较强的健康意识[1]。但也有研究显示不同性别肺结核患者之间的生存率无显著差异[16]。另外,有研究表明年龄也是影响肺结核患者生存的重要因素[16-17,24-25]。本研究结果显示,高龄是肺结核患者死亡的危险因素,患者年龄每增加1岁,死亡风险增加0.062 倍,其原因可能是随着年龄增长,身体各脏器功能和机体免疫力会逐渐下降,尤其老年患者合并症多,症状不典型,不易被发现。也可因药物不良反应等原因导致中断治疗,故而加大死亡风险。
此外,复治肺结核和首次痰菌结果阳性也是肺结核患者死亡的独立危险因素。复治肺结核患者的死亡风险是初治患者的1.539倍,复治肺结核患者多由不合理化疗引起,病情相比初治患者复杂严重,治疗困难,故死亡风险也更大。首次痰菌结果阳性的患者死亡风险是阴性及无痰患者的1.936倍,痰菌阳性患者较阴性患者排菌量大、传染性强,病情严重,故死亡风险也较高。
结核病/艾滋病(TB/HIV)双重感染是一组相互促进病变进展、恶化,迅速导致死亡的伴发病,且其中1/4 的艾滋病患者死于结核病。多项研究结果均显示HIV/TB 双重感染患者的死亡风险较HIV 阴性结核病患者高[16,26]。本研究结果显示,HIV 阳性患者死亡的风险是阴性患者的4.153 倍,提示HIV/TB双重感染会加速降低机体免疫细胞的抵抗力,HIV进入机体快速复制增殖,增加了结核病的发病和死亡风险。有研究表明,早期发现HIV/TB双重感染患者并尽早给予抗结核治疗可提升抗病毒治疗效果,从而降低病死率[27]。
本研究显示,就诊延误是肺结核死亡的危险因素,就诊延误患者死亡的风险是非延误患者的1.401倍。就诊延误是因为患者对结核病的可疑症状未引起足够重视而导致的推迟就医,其直接后果是易致病变扩散、病情加重,不仅增加疾病负担而且影响患者预后。张懿行[25]研究显示,就诊延误者的死亡危险性是非就诊延误者的1.3倍,肺结核防治工作提倡早发现、早治疗,才能改善患者预后,提高生存质量。
本研究采用回顾性队列分析资料,由于检测方法、经济条件的限制,未将患者抗结核治疗前营养风险状况、经济水平、社会支持情况、肝肾功能、结核感染T 细胞斑点试验(T-SPOT.TB)与gene-xpert 等因素纳入观察指标,观察的结局变量为全死因死亡,未区分结核病导致的死亡与其他原因导致的巧合死亡。今后期望开展多中心的前瞻性研究,并充分考虑相关影响因素,建立更为稳定的预测模型。

