巨噬细胞极化对心肌成纤维细胞活化的影响
吴惠娟,张盛昔,杨潇,胡因铭,王乐旬△,郭姣
《中国心血管病报告2018》显示我国心血管病现患人数约为2.9 亿,其中90%以上与心脏有关[1]。心肌纤维化是众多心脏疾病的共同病理改变,其持续进展会严重影响患者的生存和预后[2]。预防和逆转心肌纤维化是心血管疾病防治的主要目标,但目前临床上仍缺乏有效防治心肌纤维化的药物[3]。心肌成纤维细胞的异常活化是心肌纤维化的核心环节[4]。巨噬细胞在不同条件刺激下可极化为经典活化的巨噬细胞(M1 型)或选择性活化的巨噬细胞(M2 型)[5]。研究显示不同型别的巨噬细胞在心肌纤维化发生发展中的作用并不一致,可表现为抑制[6-7]和促进[8-10]心肌纤维化的双重作用。本研究通过体外实验以明确不同型别巨噬细胞在原代心肌成纤维细胞活化中的作用。
1 材料与方法
1.1 材料 SPF 级SD 雄性大鼠10 只,体质量150 g 左右,购自广东省医学实验动物中心。重组大鼠巨噬细胞集落刺激因子(M-CSF)、白细胞介素(IL)-4和干扰素(INF)-γ购自美国PeproTech 公司,血小板衍生生长因子受体(PDGFR)α、磷酸化(p)-PDGFRα(Tyr720)、PDGFRβ、p-PDGFRβ(Tyr751)、胶原蛋白1(Col1a1)和平滑肌肌动蛋白(α-SMA)抗体购自英国Abcam 公司,结缔组织生长因子2(CCN2)抗体购自美国Santa Cruz Biotechnology 公 司,GAPDH 抗 体 购 自 美 国ProteinTech 公司,Smad2 和p-Smad2(Ser465/Ser467)抗体购自美国Cell Signaling Technology。Leica DMi8 倒置荧光显微镜购自德国Leica公司,PikoReal实时荧光定量逆转录聚合酶链反应(qPCR)仪和NanoDrop 2000 核酸浓度测定仪购自美国Thermo Fisher Scientific 公司,Mithras LB-940 酶标仪购自德国Berthold公司。
1.2 方法
1.2.1 不同型别巨噬细胞的诱导及鉴定 断颈处死大鼠后,收集股骨和胫骨。用注射器吸取含1%双抗的RPMI-1640培养基,插入骨髓腔冲洗,收集冲洗液以提取骨髓细胞。1 000 r/min 室温离心5 min,弃上清后加入红细胞裂解液,静置3~5 min后离心。用含1%双抗、10%胎牛血清(FBS)以及10 μg/L M-CSF的RPMI-1640培养基重悬细胞,于37 ℃、5%CO2培养箱中培养,隔天换成含10 μg/L M-CSF 和10%FBS 的DMEM培养基。M-CSF 诱导7 d 后,用2 g/L 的乙二胺四乙酸(EDTA)消化细胞,1 000 r/min 离心5 min,加入不含血清的DMEM 培养基重悬细胞并计数。按1.0×106细胞/孔进行接种,6~8 h细胞贴壁后,按照巨噬细胞体外诱导的方法加入刺激因子[5]。M0(无刺激因子)、M1[加入100 μg/L 脂多糖(LPS)+10 μg/L INF-γ]、M2(加入20 μg/L IL-4)。继续培养12 h后收集培养上清并提取细胞mRNA,用于后续实验。通过qPCR 鉴定不同型别巨噬细胞表型特征分子的表达,其中诱导型一氧化氮合酶(iNOS)和IL-12为M1型巨噬细胞的特异性标志物[11],精氨酸酶1(Arg1)和甘露糖受体(CD206)为M2型巨噬细胞的特异性标志物[5]。
1.2.2 心肌成纤维细胞的分离和培养 参照文献[12],10只大鼠断颈处死后,在无菌环境下取出心脏。用含1%双抗的PBS冲洗3~5次,去掉心房及多余组织,将心脏剪碎成1 mm×1 mm×1 mm 小块,用PBS 洗3次。将心脏组织吸入无菌锥形瓶中,加入0.1%的胶原酶Ⅱ于37 ℃恒温水浴中搅拌10~15 min,重复5~8次至消化完全。收集消化后的悬液过滤至15 mL离心管中,1 000 r/min离心5 min,PBS清洗1次。加入红细胞裂解液5 mL,混匀,静置3 min 后离心,用含20%FBS 的DMEM 重悬细胞,差速贴壁法培养1.5 h后换液,保留贴壁细胞(即心肌成纤维细胞)。取3~5代的细胞用于实验。
1.2.3 细胞共培养及分组 共培养处理:按照每种细胞1.0×105/孔将巨噬细胞和心肌成纤维细胞分别接种在上方的共培养小室和下方的培养孔中,分别设空白对照组(NT 组,心肌成纤维细胞)、M0组(M0型巨噬细胞与心肌成纤维细胞)、M1组(M1型巨噬细胞与心肌成纤维细胞)、M2组(M2型巨噬细胞与心肌成纤维细胞)。上清处理:将收集到的巨噬细胞上清加入心肌成纤维细胞的培养孔中,每孔1.5 mL,细胞分组与共培养处理一致。培养12 h 后收集心肌成纤维细胞提取mRNA和蛋白,用于后续检测。
1.2.4 mRNA提取及qPCR检测巨噬细胞和成纤维细胞特征分子的表达 使用RNAiso Plus提取细胞总RNA[13]。按照逆转录试剂盒说明书逆转录成cDNA。qPCR 反应程序如下:95 ℃3 min;95 ℃30 s,60 ℃15 s,40个循环。GAPDH作为内参,将所得Ct 值按2-ΔΔCt法进行数据处理。引物由上海Invitrogen公司合成,序列见表1。
1.2.5 Western blot 检测各组细胞纤维化相关蛋白的表达 收集处理过的细胞,加入蛋白裂解液提取蛋白质,并用BCA 法进行蛋白定量。取30 mg 蛋白进行电泳,经湿转法将凝胶中的蛋白转至硝酸纤维素膜上,用5%BSA封闭1 h,4 ℃孵 育 α -SMA、CCN2、PDGFRα、p-PDGFRα(Tyr720)、PDGFRβ、p-PDGFRβ(Tyr751)、Smad2、p-Smad2 和GAPDH一抗(均为1∶1 000稀释)孵育过夜,洗膜5 min×3次。室温孵育HRP标记的二抗(1∶10 000稀释)1 h,洗膜4次后用ECL发光液检测信号并计算各目的蛋白的相对表达量。

Tab.1 Primer sequences for qPCR表1 qPCR引物序列
1.2.6 细胞免疫荧光 将已制备好的细胞爬片用PBS浸洗3次,用4%多聚甲醛固定15 min,0.5%的Triton X-100 室温通透20 min,PBS浸洗后滴加山羊血清封闭30 min。弃去PBS,滴加Col1a1 和α-SMA 一抗(1∶100 稀释)并放入湿盒中,4 ℃孵育过夜。PBS浸洗爬片3次,每次3 min,滴加荧光二抗(1∶1 000稀释),37 ℃孵育1 h。PBS浸洗爬片3次,滴加DAPI避光孵育5 min,PBS清洗后用吸水纸吸干液体。加入抗荧光淬灭剂封片,在荧光显微镜下采集图像,观察Col1a1和α-SMA的表达。
1.3 统计学方法 采用GraphPad Prism 5.0软件进行统计分析,符合正态分布的计量资料以均数±标准差()表示,组间比较采用单因素方差分析(ANOVA),组间多重比较采用LSD-t法,P<0.05为差异有统计学意义。
2 结果
2.1 不同型别巨噬细胞的诱导及鉴定结果 与M0型相比,M1型巨噬细胞iNOS和IL-12的mRNA水平显著升高,M2 型中Arg1 和CD206 的mRNA 水平显著升高(P<0.05),提示M1型和M2型巨噬细胞诱导成功,见表2。
Tab.2 Determination of different subtypes of macrophages表2 不同型别巨噬细胞的鉴定(n=3)
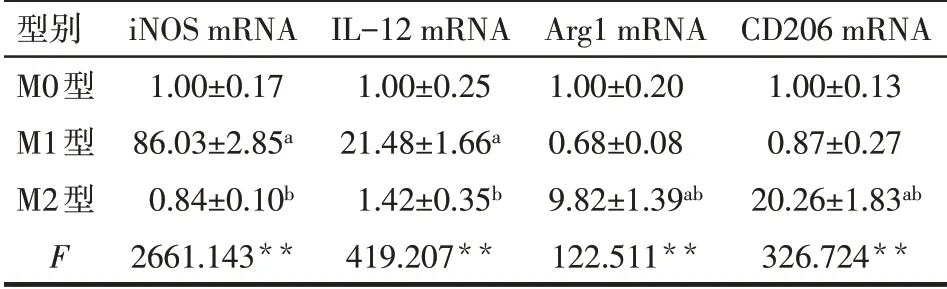
Tab.2 Determination of different subtypes of macrophages表2 不同型别巨噬细胞的鉴定(n=3)
**P<0.01;a与M0型相比,b与M1型相比,P<0.05
型别M0型M1型M2型F iNOS mRNA 1.00±0.17 86.03±2.85a 0.84±0.10b 2661.143**IL-12 mRNA 1.00±0.25 21.48±1.66a 1.42±0.35b 419.207**Arg1 mRNA 1.00±0.20 0.68±0.08 9.82±1.39ab 122.511**CD206 mRNA 1.00±0.13 0.87±0.27 20.26±1.83ab 326.724**
2.2 巨噬细胞共培养后心肌成纤维细胞Col1a1 和α-SMA 的表达变化 荧光显微镜下可见,与NT 组相比,M0 组Col1a1 和α-SMA 表达增多;而与M0 组相比,M1 组中Col1a1 和α-SMA 少量表达;而M2 型巨噬细胞共培养的心肌成纤维细胞中Col1a1 和α-SMA大量表达,见图1。
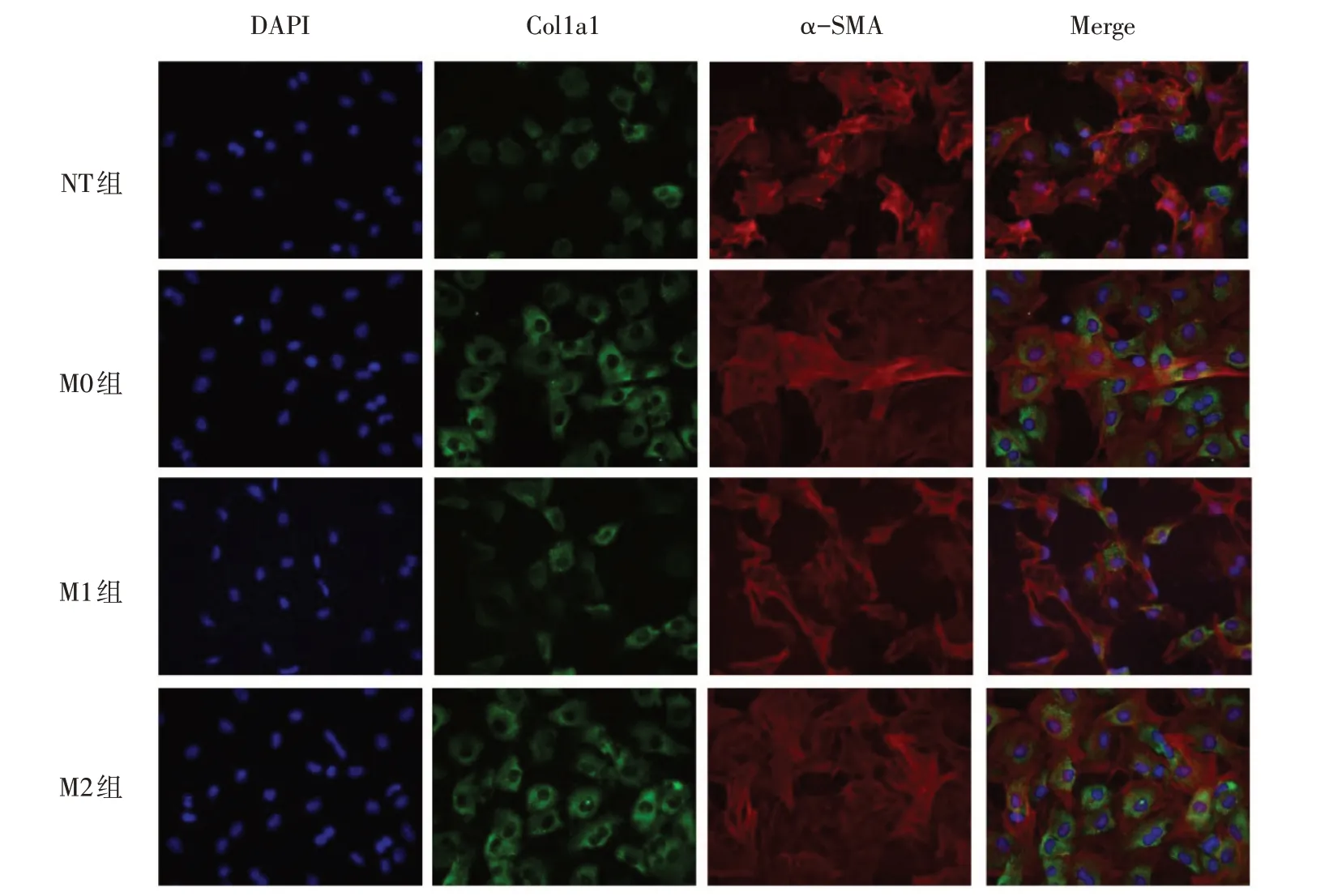
Fig.1 The activation of cardiac fibroblastsco-cultured with macrophages(immunofluorescence,×200)图1 巨噬细胞共培养对心肌成纤维细胞活化的影响(免疫荧光,×200)
2.3 不同型别巨噬细胞培养上清对心肌成纤维细胞的影响 巨噬细胞上清处理后心肌成纤维细胞显示了和巨噬细胞共培养类似的情况。与NT组和M0组相比,M1 组中Col1a1 和α-SMA 少量表达,而M2组中Col1a1和α-SMA大量表达,见图2。
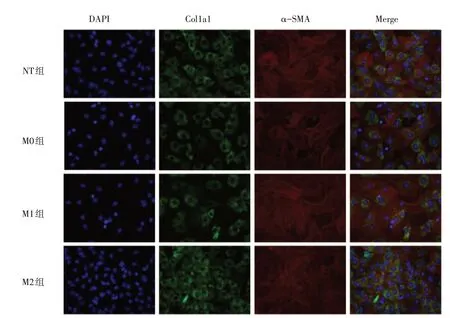
Fig.2 Effects of macrophage supernatant on cardiac fibroblasts(immunofluorescence,×200)图2 巨噬细胞上清对心肌成纤维细胞的影响(免疫荧光,×200)
2.4 不同型别巨噬细胞上清对心肌成纤维细胞纤维化相关基因表达的影响 与M0 组相比,M1 组Col1a1 和Col3a1 的mRNA 水平显著降低(P<0.05),而在M2 组中则显著升高(P<0.05),见表3。与M0组相比,M1 组中α-SMA 蛋白表达水平显著降低(P<0.05),而M2 组中α-SMA 和CCN2 蛋白表达水平明显升高(P<0.05),见表3、图3。
Tab.3 Effects of macrophage supernatants on fibrotic genes in cardiac fibroblasts表3 巨噬细胞上清对心肌成纤维细胞纤维化相关基因表达的影响 (n=3)
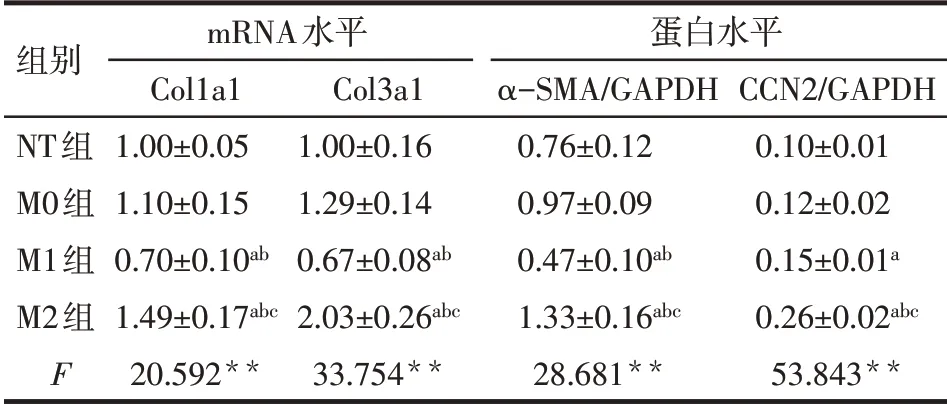
Tab.3 Effects of macrophage supernatants on fibrotic genes in cardiac fibroblasts表3 巨噬细胞上清对心肌成纤维细胞纤维化相关基因表达的影响 (n=3)
**P<0.01;a与NT组相比,b与M0组相比,c与M1组相比,P<0.05
组别NT组M0组M1组M2组F蛋白水平α-SMA/GAPDH CCN2/GAPDH 0.10±0.01 0.12±0.02 0.15±0.01a 0.26±0.02abc 53.843**mRNA水平Col1a1 1.00±0.05 1.10±0.15 0.70±0.10ab 1.49±0.17abc 20.592**Col3a1 1.00±0.16 1.29±0.14 0.67±0.08ab 2.03±0.26abc 33.754**0.76±0.12 0.97±0.09 0.47±0.10ab 1.33±0.16abc 28.681**
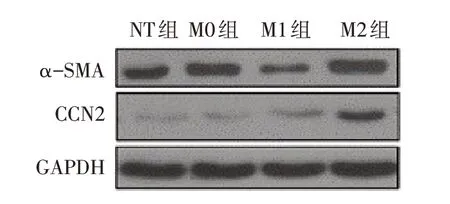
Fig.3 Effects of macrophage supernatants on fibrotic genes in cardiac fibroblasts图3 巨噬细胞上清对心肌成纤维细胞纤维化相关基因表达的影响
2.5 不同型别巨噬细胞上清对心肌纤维化相关通路分子表达的影响 4 组细胞TGFβRⅡ和PDGFRα的mRNA 水平比较差异无统计学意义,PDGFRα 和TGFβRⅡ通路关键分子Smad2的总蛋白及磷酸化水平没有明显改变。与NT 组和M0 组相比,M1 组PDGFRβ 的mRNA 和蛋白磷酸化水平显著降低,而其蛋白磷酸化水平在M2 组中则明显升高(P<0.05),见图4、表4。
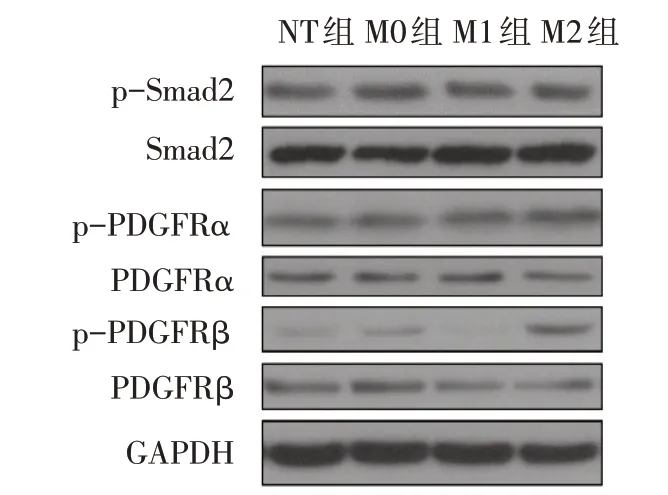
Fig.4 Effects of macrophage supernatants on fibrotic signaling pathways in cardiac fibroblasts图4 巨噬细胞上清对心肌成纤维细胞纤维化通路的影响
Tab.4 Effects of macrophage supernatants on fibrotic signaling pathways in cardiac fibroblasts表4 巨噬细胞上清对心肌成纤维细胞纤维化通路的影响(n=3)
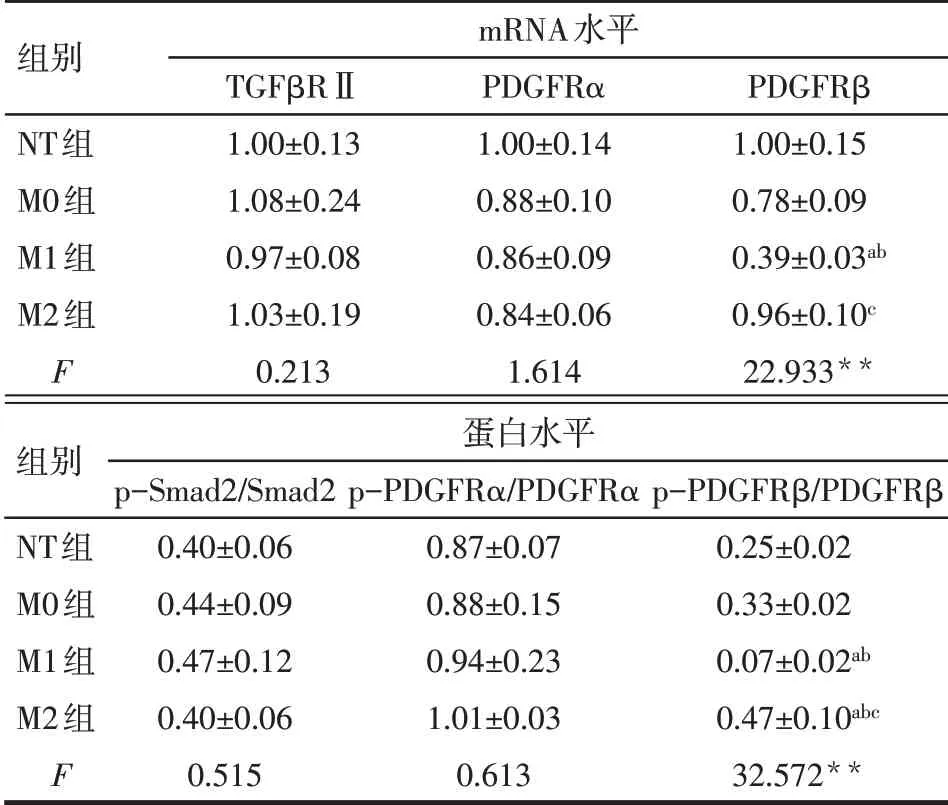
Tab.4 Effects of macrophage supernatants on fibrotic signaling pathways in cardiac fibroblasts表4 巨噬细胞上清对心肌成纤维细胞纤维化通路的影响(n=3)
**P<0.01;a与NT组相比,b与M0组相比,c与M1组相比,P<0.05
3 讨论
心肌纤维化几乎与所有的心脏疾病都有关联,心肌梗死、心脏外科手术、高血压、心肌病、毒性因子(乙醇和蒽环类药物)、代谢紊乱(糖尿病和肥胖)以及高龄等都能促进心肌纤维化的发生和发展[14],因此至今仍缺乏有效的防治措施阻止和逆转心肌纤维化。在本研究中,笔者通过体外的细胞实验证实不同型别巨噬细胞对心肌成纤维细胞的活化有不同的影响,其中M1型巨噬细胞上清能够抑制心肌成纤维细胞的活化,而M2型上清能够促进其活化。
目前不同型别巨噬细胞的区别在于:一是刺激物的不同,M1 型巨噬细胞的刺激因子是LPS,M2 型巨噬细胞的刺激因子是IL-4;二是表达的蛋白因子不同,M1型巨噬细胞特异性表达CXC类趋化因子配体9(CXCL9)、iNOS、IL-12、CD80和TNF-α,M2型细胞可特异性表达CD206、Arg1、TGF-β和IL-10等[5]。笔者选择了iNOS 和IL-12 作为M1 型的标记,选择CD206 和Arg1 作为M2 型巨噬细胞的标记,证实这些标记能够反映各自的型别,表明M1 和M2 型巨噬细胞诱导成功。
目前不同型别巨噬细胞的具体作用仍有分歧。有研究显示M2 型巨噬细胞的浸润能够促进心肌纤维化的发生和发展,在血管紧张素Ⅱ诱导的心肌纤维化动物模型中,M2型巨噬细胞在纤维化的心脏组织中聚集,促进成纤维细胞的活化和胶原的合成与分泌[16]。在基质金属蛋白酶-9(MMP-9)敲除的小鼠心肌梗死模型以及衰老的小鼠模型中也证实了类似的结果[10]。在IL-13 敲除的小鼠心肌梗死模型中,M2 型巨噬细胞在损伤的心脏组织中减少,心肌纤维化程度增加,心功能恶化[8]。在清道夫受体A(SR-A)敲除的心肌梗死模型、主动脉缩窄所致的心肌纤维化模型以及糖尿病心肌病模型中也观察到类似的结果[7,17-18]。同样,M1型巨噬细胞也有和M2类似的报道,即有些研究显示M1型巨噬细胞能够促进心肌纤维化的发生[9],而有些报道认为M1型能够抑制心肌纤维化的发生发展[6-7]。M1型巨噬细胞出现在损伤的早期,主要起到诱导炎症发生发展的作用,而M2型巨噬细胞的高峰出现在损伤的后期,主要发挥组织修复的作用[19]。笔者推测在这些动物模型中,并不是单一型别的巨噬细胞,而是M1和M2型巨噬细胞所占比例不同所致。
纤维化的发生过程中,TGF-β1 介导的TGFβRs通路和PDGFs介导的PDGFRs通路发挥了重要的作用[20-21]。本研究发现TGFβR 通路下游Smad2 和PDGFRs 通路中PDGFRα 蛋白活性变化不明显,而是显著影响了PDGFRβ的转录、翻译及磷酸化水平,提示不同型别巨噬细胞对纤维化的影响主要是通过PDGFRβ 信号通路来发挥作用的。值得注意的是,体外分离培养的心肌成纤维细胞在培养的过程中会发生活化,这可能和培养环境与在体环境不同有关[22]。因此,本研究并没有设置纤维化阳性组对照(比如利用TGF-β1或PDGFs进行处理)以及在阳性处理的基础上利用不同型别巨噬细胞上清处理。
综上所述,本研究的结果表明不同型别巨噬细胞对心肌成纤维细胞的活化有不同的影响,M2型巨噬细胞的上清能够促进心肌成纤维细胞的活化,而M1型上清则能抑制其活化,这可能与调控PDGFRβ通路的活化有关。本研究只是在体外对巨噬细胞影响心肌成纤维细胞的活化进行了探讨,并没有明确上清的具体成分以及探讨不同型别巨噬细胞在动物体内对心肌纤维化的影响,这是今后的研究方向。

