头颈部腺样囊性癌中S100的表达及其预后关系的研究
莫华倩 姜燕慧 马爽 钟慧敏 刘宜敏
头颈部腺样囊性癌(adenoid cystic carcinoma of the head and neck,ACCHN)最常见于小唾液腺,发病率约占头颈部所有恶性肿瘤的1%,涎腺肿瘤的10%[1]。ACCHN 生长缓慢,但具有高度的局部侵袭性和易侵袭神经的特性。研究表明,ACCHN患者的5 年总生存率约为68%[2]。目前,ACCHN的治疗以手术联合术后放射治疗为主。然而,由于ACCHN 患者复发率较高,部分患者因局部复发而影响其长期生存[3]。而由于肿瘤生长缓慢,化学治疗对ACCHN 的作用效果并不明显,多数患者并不能从化疗中获益。对于具有高危因素的ACCHN 晚期患者,化疗可作为姑息性治疗。因此,若能在早期筛选出临床更高危患者,便可通过采取积极治疗方法及干预措施进而使患者获得更好的远期生存。
S100 位于人类第21 号染色体上的1q21 区,其编码的S100 蛋白是一种相对分子质量为21000 的钙结合蛋白,最早是由牛脑浸液分离得出,是主要存在胶质细胞和神经膜细胞的具有高度保守氨基酸序列的蛋白,常被用作神经分化的标志物,在多种肿瘤中异常表达,并与各种肿瘤的发生发展密切相关[4,5]。研究证实多种因素均可影响ACCHN患者预后,而S100 在多种肿瘤中表达异常,具有诊断及评估预后等价值,且与卵巢癌、结直肠癌等肿瘤预后差相关[6,7]。但目前尚无关于S100 表达对ACCHN 患者预后的研究报道。因此。本研究旨在探讨头颈部腺样囊性癌患者中S100 的表达情况对其预后的影响。
1 临床资料
1.1 一般资料选取2006 年1 月至2016 年12 月期间在我院收治的43 例头颈部腺样囊性癌患者资料。本研究所纳入病例均征得患者知情同意且签署了书面知情同意书。研究获得中山大学孙逸仙纪念医院伦理委员会审批同意。临床分期按照2010 年第7 版美国癌症联合委员会头颈部肿瘤分类标准进行TNM 分期。(1)纳入标准:①经病理证实的头颈部腺样囊性癌;②均已行手术治疗;③肝肾功能正常;④术后组织临床免疫组化检查结果包括S100 表达情况。(2)排除标准:①并发其他恶性肿瘤;②非肿瘤原因导致死亡;③随访不全或已失访。
1.2 方法所有患者随访信息均通过门诊或电话获得。随访至死亡或最后一次随访日期2019 年5 月1 日。随访数据包括肿瘤复发、远处转移和患者治疗后生存状态。无进展生存(disease-free survival,DFS)定义为从诊断时间开始到复发或转移时间。总生存率(overall survival,OS)定义为从诊断时间到死亡时间或随访终止时间。在这项研究中,随访主要终点是OS 和DFS。
1.3 统计学分析采用SPSS 20.0 统计软件完成。组间比较采用卡方检验或Fisher 精确检验。采用Cox 比例风险回归模型进行多因素生存分析。GraphPad Prism 5 评估并绘制生存曲线。P<0.05,定义为差异有统计学意义。
2 结 果
2.1 43 例ACCHN 患者随访结果及各临床病理资料数据统计见表1。
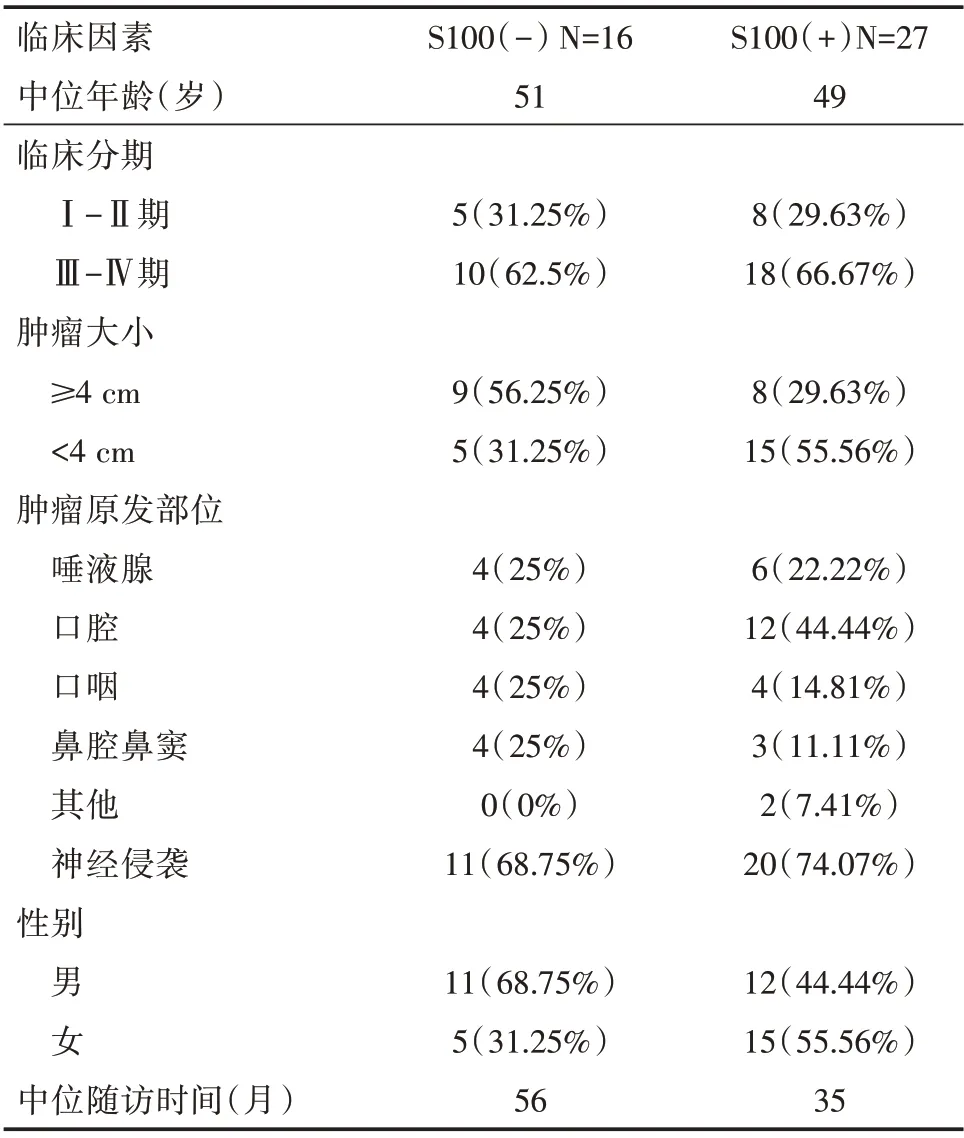
表1 43 例腺样囊性癌患者的临床基线信息参数统计
2.2 S100 的表达情况与ACCHN 患者预后的关系截至末次随访,中位随访时间为40 个月(8-160 个月),复发17 例(17/43,39.53%),远处转移7例(7/43,16.28%),死亡11 例(11/43,25.58%),均为ACCHN 导致死亡。S100 表达阴性的ACCHN 患者3 年、5 年总生存率分别为75%、70%,而阳性患者3 年、5 年总生存率分别为74.07%、70%,二者之间并无明显统计学差异(图1A,表2)。有意义的是S100 表达阴性的ACCHN 患者3 年、5 年无进展生存率分别为56.15%、50%,而S100 表达阳性的患者的3 年、5 年无进展生存率分别为44.44%、20%,S100 阳性患者无进展生存率较阴性患者明显降低,且有统计学差异(P<0.05)(图1B,表2)。然而进一步分层分析显示,在早期(Ⅰ-Ⅱ期)和晚期(Ⅲ-Ⅳ期)ACCHN 患者中,S100 的表达并不能很好的区分出DFS 预后的差异(图2A,Ⅰ-Ⅱ期:P>0.05,图2B,Ⅲ-Ⅳ期:P>0.05)。
2.3 ACCHN 总生存和无进展生存的多因素分析见表3。
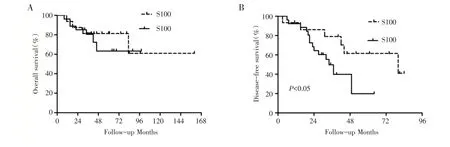
图1 43 例ACCHN 患者手术组织中,S100 表达阳性组和阴性组的总生存率(A)和无进展生存(B)分析。(A)S100 阳性表达的患者总生存率与S100 阴性表达的患者相比无显著性差异(P>0.05)。(B)S100 阳性表达的患者无进展生存率较S100阴性表达的患者明显降低,差异有统计学意义(P<0.05)。
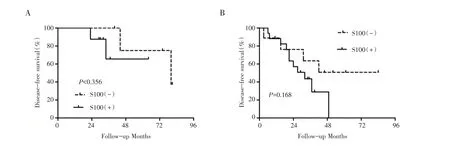
图2 不同临床分期(Ⅰ-Ⅱ期、Ⅲ-Ⅳ期)ACCHN 患者中,S100 表达阳性组和阴性组的无进展生存(A、B)分析。(A)在Ⅰ-Ⅱ期ACCHN 患者中,S100 阳性表达患者者的无病生存率与S100 阴性表达患者的无病生存率无显著性差异(P>0.05)。(B)在Ⅲ-Ⅳ期ACCHN 患者中,S100 阳性表达的患者无病生存率与S100 阴性表达的患者相比无显著性差异(P>0.05)。

表2 S100 表达与ACCHN 患者的总生存及无进展生存分析
3 讨 论
ACCHN 发生发展复杂,具有高度的局部侵袭性和易侵袭神经的特性。目前ACCHN 的主要治疗方法是根治性手术,辅以术后放射治疗,但常因局部复发而影响其长期生存。而化疗在晚期ACCHN 中的治疗效果有限。近年来,许多研究发现S100 与ACC 嗜神经侵袭相关[8,9],而腺样囊性癌易发生嗜神经侵袭,严重影响患者术后生存质量,但目前尚无S100 对ACCHN 患者临床预后作用的研究。因此,本研究回顾性分析43 例ACCHN 患者,探讨S100 的表达情况与患者预后的关系,为早期积极干预及个体化治疗提供依据。

表3 影响43 例腺样囊性癌OS 和DFS 的多因素分析
研究发现,S100 在卵巢癌、乳腺癌患者中高表达且与患者总生存率差显著相关[6,10],且S100 高表达者,ACCHN 嗜神经侵袭发生率较高[9]。然而,与上述研究结果不同,本研究发现S100 阳性的ACCHN 患者PNI 发生率为74.07%,比阴性患者(68.75%)高,但差异没有统计学意义。而与S100表达阴性患者相比,S100 表达阳性的患者3 年、5年总生存率并无明显差别,这可能与纳入本研究患者例数较少相关,尚需扩大样本量以减弱两组患者样本量间的失衡,进而进一步验证S100 表达对ACCHN 患者PNI 及总生存预后的关系。但是,与S100 表 达 阴 性 的ACCHN 患 者 相 比,S100 表 达阳性患者的3 年和5 年无进展生存率均显著较低。此项研究结果与卵巢癌及结直肠癌等其他肿瘤既往研究结果相似[11,12]。而王等发现在涎腺腺样囊性癌中,S100 高表达者远处转移发生率高[8],但其表达与无进展生存的关系尚不清楚。排除混杂因素影响后,进一步多因素Cox 回归分析发现肿瘤复发状态及S100 是否表达是影响无进展生存的独立危险因素,提示S100 的表达对ACCHN 患者具有潜在的临床应用及预后预测价值,目前越来越多研究表明S100 的阳性表达对多种肿瘤发生发展起重要作用,S100 有望成为肿瘤治疗及预后判断的潜在靶点。因此,缩短随访时间,增加随访次数,积极采用化疗或靶向治疗等干预措施,有望可预防S100 表达阳性ACCHN 患者的局部复发及远处转移,从而延长患者的无进展生存时间,便于临床上采取个体化诊疗及干预措施。
本研究存在以下几点不足:(1)本研究为回顾性研究,存在一定局限性。(2)纳入病例数较少,特别是早期(Ⅰ-Ⅱ期)患者较少,因此尚需扩大样本量以进一步验证S100 的表达对早期ACCHN 患者的预后价值。
综上所述,与S100 阴性患者相比,S100 阳性表达对ACCHN 患者总生存率无明显影响,但可使患者无进展生存时间缩短,是ACCHN 患者无进展生存的独立危险因素,可作为ACCHN 患者不良预后的评估指标,为ACCHN 的个体化诊治及干预提供良好的思路。

