在心内三维超声指导下经皮心内膜室间隔射频消融术治疗肥厚型梗阻性心肌病
华伟,楚建民,唐闽,姚焰,欧阳非凡,张澍
肥厚型梗阻性心肌病(HOCM)是一类因编码肌小节或肌原纤维的基因突变引发的以室间隔或心尖部心肌非对称性肥厚为主要表现的常染色体显性遗传性疾病;其发病率约为0.2%,实际发病率可能高于这个数值;室间隔肥厚可伴或不伴二尖瓣前叶收缩期前向运动(SAM),使左心室射血受阻,从而在左心室流出道(主动脉瓣下)形成跨瓣压差,即左心室流出道压差(LVOTPG)。一般将静息或诱发时经超声多普勒测算的LVOTPG ≥30 mmHg(1 mmHg=0.133 kPa)定义为梗阻[1]。大约只有20%~30%的患者静息状态下LVOTPG升高达标,70%的患者是在运动或药物诱发下才会出现LVOTPG 升高[2],其中蹲起的诱发敏感性高于硝酸酯类药物。
1 肥厚型梗阻性心肌病的非药物治疗方法及各自特点
目前HOCM 的非药物治疗方法包括:(1)外科开胸直视下肥厚心肌切除术;(2)经导管冠状动脉室间隔酒精消融术(transcatheter alcohol septal ablation,TASA);(3)房室顺序心脏起搏法:(4)经皮心肌内室间隔射频消融术(percutaneous intramyocardial septal radiofrequency ablation,PIMSRA);(5)经皮心内膜室间隔射频消融术(percutanous endocardial septum radiofrequency ablation,PESA),即在心内三维超声指导下经导管射频消融梗阻区的肥厚室间隔。
外科肥厚心肌切除术应用于HOCM 的治疗已有半个世纪[3],至今仍是经典的治疗方式,患者远期功能改善最肯定[4],但手术创伤较大,术后有19%~47%的患者并发左束支阻滞,约12%的患者需植入永久心脏起搏器[5]。
1995年以后,逐渐开展的TASA 为顾虑外科手术的患者提供了一个有效的微创治疗方法,且得到了很好的推广,但有5%~15%的患者因冠状动脉解剖限制不适合行TASA,还有部分患者消融后有再发梗阻需转行外科手术。另外,TASA 术后有37%~70%的患者会发生右束支阻滞,15%的患者需植入永久心脏起搏器,5%~6%的患者因为顽固的不可消融性室性心动过速需植入埋藏式心脏复律除颤器[6]。研究认为,TASA 术后的整体心血管事件发生率高于外科手术[6-7]。
房室顺序起搏法一般选择合并房室阻滞伴晕厥的患者,目前未见为单纯晕厥的肥厚型心肌病患者植入心脏起搏器的报道。实际上,右心室心尖部起搏确实可以导致肥厚室间隔收缩滞后,从而在一定程度上解除左心室流出道梗阻。中国医学科学院阜外医院贾玉和等[8]20年前曾调查过一组这样的患者,随访3年,LVOTPG 显著降低,晕厥完全消除,胸痛部分缓解。
PIMSRA 是由我国学者独创的一种术式,采用射频能量消融,其消融部位是心内膜下的心肌层,范围是不加选择性的全室间隔消融。据报道,15例HOCM 患者(其中5例合并晕厥)行PIMSRA 后随访半年时,LVOTPG 显著降低,晕厥消失,效果很肯定[9]。但该术式是在超声指导下经皮从左心室心尖部直接穿刺并将特制消融针刺入肥厚室间隔内消融,术前需选择避开心尖部有较大冠状动脉的患者,由于消融功率高(最高100 W)、消融时间长(平均60 min),消融过程中需要监测避免损伤左前降支,但损伤间隔支可以接受,这也是该术式在一定程度上类似化学消融的部分。因此,该术式术前必须严格筛选患者,术中、术后也需与心脏外科紧密合作,无论硬件、软件条件都堪比外科手术,操作要求比较高,学习曲线也要长,推广普及难度较大。
2 在心内三维超声指导下经导管射频消融心内膜治疗肥厚型梗阻性心肌病
2005年,Emmel 等[10]报道了3例HOCM 患儿在X 线指导下首次应用盐水灌注导管进行消融治疗。2011年,Lawrenz 等[11]发表了首项该领域的较大样本(共19例HOCM 患者) 研究,其中10例从室间隔右侧消融,9例从室间隔左侧消融,两种方式下LVOTPG 降低幅度差别不大;MRI 提示,室间隔消融深度普遍在2 mm 左右,4例患者因发生房室阻滞而植入心脏起搏器。同年,Sreeram 等[12]发表了32例HOCM 患儿进行消融治疗的结果,其中1例死亡,为术后LVOTPG 升高、矛盾运动加强所致。2013年,Riedlbauchová等[13]首次报道采用心腔内超声导管结合CARTO 三维标测系统消融治疗1例HOCM 患者。2016年,Cooper 等[14]首次报道采用心腔内三维超声导管(SoundStar)结合Carto 专用软件(CartoSound)特异性消融4例HOCM 患者SAM 区的室间隔,结果发现,静息时LVOTPG 由术前(64.2±50.6)mmHg 降至(12.3±2.5)mmHg,诱发状态下LVOTPG 由术前(93.5±30.9)mmHg 降至(23.3±8.3)mmHg。
可见,目前的PESA 术式是近几年才在国际上渐趋成熟的。自2017年起,贾玉和等选择不宜行TASA又不愿接受外科手术的部分患者开始进行探索。该团队在本期《中国循环杂志》发表12例HOCM 合并晕厥患者行PESA 的小样本研究结果[15],尽管他们仅报告了术后3 个月的随访资料,但实际上最长随访时间已超过2年,因此有必要对其结果进行分析和总结。
PESA 的核心技术是先通过心腔内三维超声导管描记出真正的室间隔梗阻区(图1A 绿线描记处,图1B、1C 中褐色区域),这是该术式的精华部分。与PIMSRA 全室间隔肌层消融不同的是,PESA 只精准消融室间隔梗阻区,因此梗阻区的定位是关键。曾有国内专家在TASA 术中利用常规经胸超声心动图通过评价消融后室间隔梗阻区的运动功能来评估消融的准确度,这是可行的。但这种方法在PESA 射频消融室间隔梗阻区时却不可行,因为经胸超声心动图无法将扫描过的扇面像心腔内超声导管利用专业软件CartoSound 那样整合成一个三维结构图。
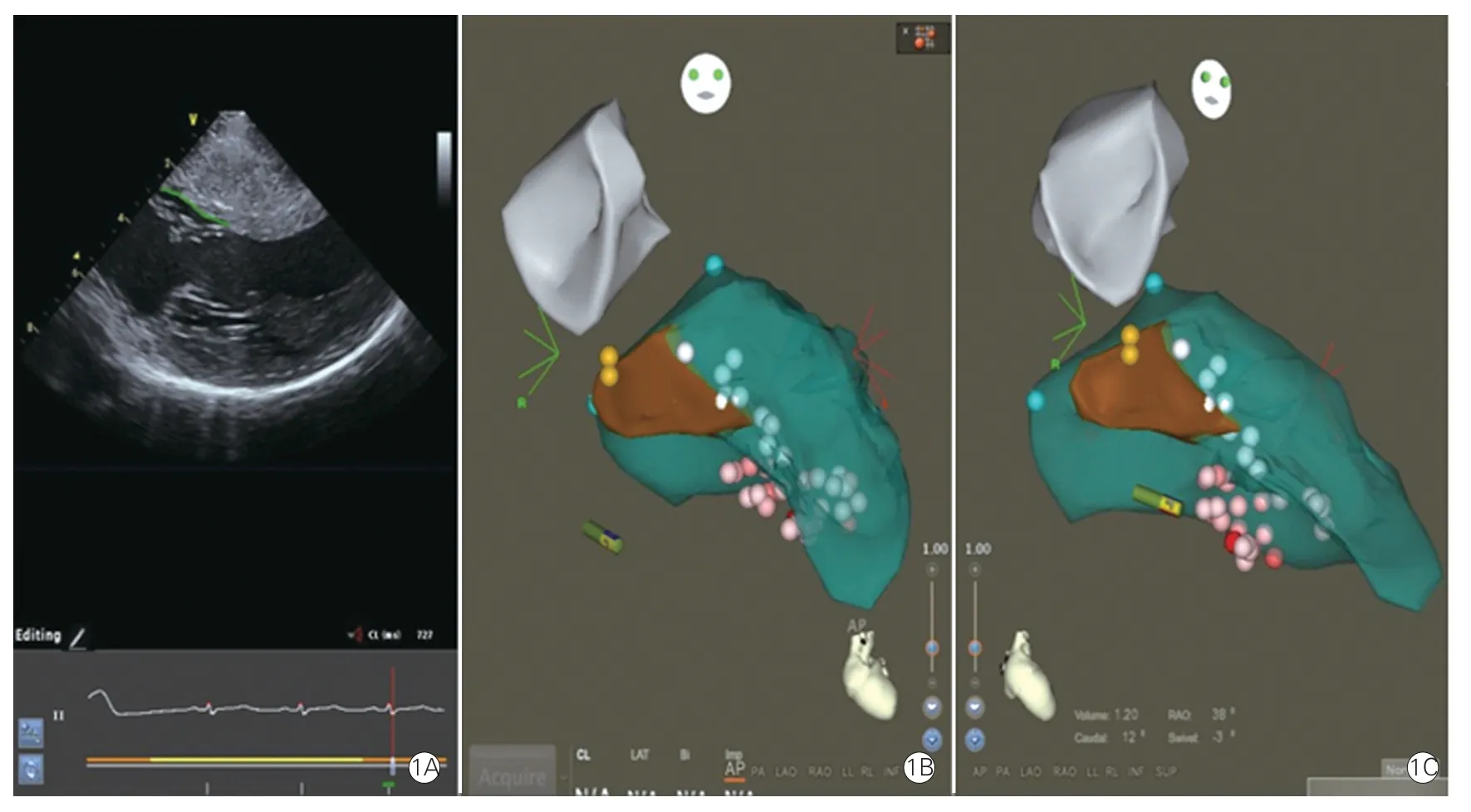
图1 经皮心内膜室间隔射频消融术心腔内超声导管描记和消融导管标测结果示例
在左心室三维超声结构和室间隔梗阻区被构建并标记好后,再通过主动脉逆行或穿刺房间隔途径将消融导管送入左心室。用导管描记出左心室内的传导束,包括希氏束、左束支及分支、浦肯野纤维。这是PESA术式的精彩之处。无论是外科切除术还是TASA,在操作中完全不能监测到传导束的瞬时功能状态,而在PESA 术中,可将室间隔梗阻区和传导束位点清楚地显示在界面上,每一个消融位点与希氏束-分支-浦氏纤维之间的距离都可以测量,因此能最大限度地保护心脏传导束不受损伤。这是PESA 术式优于外科切除术和TASA 的主要方面。在贾玉和团队此次报道的研究中,12例患者在术后3 个月直至2年多的随访中没有出现传导束受损的并发症,初步说明PESA 术式是安全的。
尽管都是采用射频能量消融,PIMSRA 是不加选择地进行全室间隔消融,而PESA 主要在室间隔梗阻区进行射频消融,其解除梗阻的机制也与外科切除手术、TASA、PIMSRA 仅将室间隔变薄不一样,主要认为是:消融时会使梗阻区肥厚的室间隔短期内水肿,心内膜下心肌顿抑,LVOTPG 降低,达到设定的LVOTPG 下降≥50%的消融终点;中期(术后1~3 个月)消融区开始疤痕化,局部激动延迟,同时局部收缩强度减低,应力方向也发生改变,使得左心室流出道梗阻得以缓解;远期(术后3 个月后)消融区逐渐萎缩,据既往文献报道,大约会萎缩2~4 mm,从而使左心室流出道梗阻缓解效应得以维持和保持。这些综合因素最终使LVOTPG 降低,梗阻解除。
在这些术式中,外科切除术在降低LVOTPG 方面的效果最好,远期效果也最肯定,TASA 次之,PIMSRA 与TASA 接近,PESA 最弱。但是,症状缓解与LVOTPG 降低幅度并不能完全等同,尤其是LVOTPG 降低到一定程度后,症状缓解与LVOTPG 数值的进一步降低并不同步。在此次贾玉和等[15]的报道中,12例HOCM 患者PESA 术后即刻LVOTPG 降低幅度≥50%,但术后3 个月复查时普遍又有所回升,LVOTPG 仅降低36%左右。尽管该研究中PESA 术后LVOTPG 降低幅度明显小于上述其他术式,甚至不如其他文献报道中同类术式对LVOTPG 的降低效果,但患者的症状缓解是比较明显的,尤其梗阻相关性晕厥和先兆晕厥的缓解率达到了100%。就这一点来说,PESA 的有效性不逊于外科切除术、TASA 和PIMSRA。PESA 能以最小的消融损伤来达到缓解梗阻的目的,更主要的是,它能与电生理技术相结合,在消融过程中能实时监测心率和房室传导,最大限度地避免术后房室阻滞的发生,这是其优于其他术式最主要的方面,因此受到广大年轻患者的信赖。
3 对经皮心内膜室间隔射频消融术的总结和整体评估
对PESA 的总结和整体评估包括以下几个方面。
(1)适应证广:该方法适宜人群广泛,几乎没有年龄限制,不受冠状动脉解剖限制(TASA 和PIMSRA受限),也不受肾功能限制,无需在外科手术室进行,普通导管室即可完成。如果不采用术中导管测压,完全可实现零射线操作和消融,这更适用于小儿、孕妇或其他对X 线敏感的患者。适应证广是其一大优势。
(2)不宜证: 首先,由于乳头肌肥大形成的左心室流出道梗阻患者不宜行PESA。在贾玉和等[15]的报道中,1例患者经胸超声心动图未准确描述肥厚梗阻的确切部位和成因,术中心内超声导管检查才发现梗阻区是由于肥大的乳头肌塞满左心室腔中远部所致,该患者消融获益不大,术后1 个月即复发心力衰竭,经再次住院治疗后缓解。当然,该类患者也不宜行外科切除术和TASA。另外,由于患者术后需静卧12 h,故要求其术前左心室射血分数≥50%。
(3)消融路径选择:对于梗阻区位于左心室中段及远段的患者,消融导管经房间隔穿刺进入左心室,导管的稳定性和操控性最佳;对于基底部梗阻,如果不合并SAM,穿间隔途径也是很好的,如果合并SAM,穿间隔途径导管很难避开二尖瓣前叶,会推动二尖瓣前叶一起贴向室间隔,部分患者会出现左心室流出道梗阻加重而在术中晕厥。对于这部分患者,应选择经股动脉逆行消融肥厚室间隔。
(4) 临床效果:术后随访,许多患者的LVOTPG 较刚消融结束时有不同程度回升,但都没有回升到术前水平,临床症状也持续改善,尤其是晕厥和先兆晕厥症状在消融后得到了完全缓解,晕厥解除率达100%。至于能否有效缓解或消除气促、胸痛、心悸等其他症状,还需要进一步选择相应的患者消融治疗后进行随访观察才能明确。
(5)围术期注意事项:术后早期消融区会出现严重水肿,可能会加重左心室流出道梗阻,引起围术期LVOTPG 升高,所以消融结束时要常规给予地塞米松或其他糖皮质激素以遏制水肿,同时要留置右心室心尖部临时备用起搏,这样一旦患者在病房出现左心室流出道梗阻加重时有应急处置手段。
总之,对于合并晕厥的HOCM 患者,在心内超声指导下行PESA 是一种比较安全、有效、微创、适应证广泛的新治疗手段。由于目前接受该手术治疗的患者例数尚少,观察时间尚短,因此还需进一步积累经验。
利益冲突:所有作者均声明不存在利益冲突

