高镁离子浓度对人骨髓间充质干细胞增殖与成骨分化的影响
李政垚 刘洁颖 吴狄 王海 吴志宏 高鹏 王以朋* 赵宇*
(中国医学科学院北京协和医学院北京协和医院1.骨科,2.医学科学研究中心,北京 100730)
骨折、截骨矫形治疗的核心是使骨断端保持稳定,所以内固定物的性能对治疗效果有着关键性的影响。理想的内固定物具有高度生物相容性、足够的机械强度和断裂韧性。目前临床获批和最常用的是金属内固定物,材料包括不锈钢、钛和钴铬钼合金。但是这些材料长时间滞留体内可能会造成永久性的物理刺激、慢性炎症反应,或释放有毒元素,所有这些反应都会损害机体健康[1,2]。同时,传统金属植入物与天然骨骼之间的弹性模量差异造成的应力遮挡效应会干扰骨的新陈代谢,从而导致骨丢失,并可能出现继发性骨折[3]。传统金属材料不具有生物可降解性,必须进行二次手术去除植入物,这会增加患者的疼痛、手术风险和医疗费用。因此,适用于骨科的可降解内固定物的研发已成为生物医学材料研究的热点之一。
近年来,镁及镁合金作为骨科应用的潜在材料受到越来越多的关注[4,5]。由于镁及其合金在水溶液中的腐蚀敏感性而具有天然的生物降解能力,特别是在溶液中含有氯离子的情况下降解更加确切[6]。并且镁具有良好的生物相容性[7],在植入和降解过程中主要释放的镁离子(Mg2+)可用于人体正常代谢。与传统金属材料如不锈钢(200 GPa)、钴基合金(230 GPa)、钛合金(115 GPa)相比,镁(40~45 GPa)的弹性模量与天然骨的弹性模量(3~20 GPa)更匹配,从而能够降低应力遮挡效应的发生概率[8]。
镁及镁合金材料降解过程中产生的局部高镁环境直接作用于骨折周围的组织与细胞。在正常人体内,血清中高镁可直接导致心律失常甚至死亡,然而高镁环境对组织、细胞的影响的研究目前较少。医用材料研发中,已有很多关于镁合金材料浸提液对成骨相关细胞影响的研究,但是在浸提过程中同时造成的浸提液pH值升高、Ca离子浓度下降等其他变化会在人体缓冲系统作用下被减弱。为剔除上述影响因素,本研究通过对常用镁合金材料进行浸提处理,测定浸提液中镁离子含量,以此为依据配置含有相应浓度镁离子的细胞培养液进行细胞培养。以高于人体血清镁正常值上限为“高镁离子环境”,研究单纯细胞外高镁离子环境对成骨相关细胞的影响,从而为反向进一步研发具有合适降解速率的、适合作为医用材料的镁合金/含镁复合材料提供参考。
人骨髓间充质干细胞(human bone marrow mes⁃enchymal stem cells,hBMSCs)的增殖与分化在骨折愈合的过程中发挥重要作用,所以细胞外高镁环境对hBMSCs 的影响则显得至关重要,故本研究以此细胞为研究对象。
1 材料与方法
1.1 主要材料与试剂
骨髓间充质干细胞完全培养基(苏州,赛业),成人骨髓间充质干细胞成骨诱导分化培养基(苏州,赛业),TrypLE胰蛋白酶替代物(美国,Gibco公司),CCK试剂盒(日本,同仁公司),DMSO(美国,Sigma公司),硫酸镁七水(北京,索莱宝),碱性磷酸酶检测试剂盒(上海,碧云天),BCA蛋白定量试剂盒(北京,索莱宝),Western及IP细胞裂解液(无抑制剂)(上海,碧云天),4%组织细胞固定液(北京,索莱宝),碱性磷酸酶染色液(北京,索莱宝),茜素红染色液(苏州,赛业),D-PBS缓冲液(四环阳生),氯化十六烷基吡啶(北京,索莱宝)。
超纯水机(美国,Aquapro 公司),酶联免疫检测仪(美国,Thermo公司),电感耦合等离子体原子发射光谱分析仪(inductively coupled plasma atomic emis⁃sion spectroscopy,ICP-AES)(日本,岛津公司)。
1.2 镁及镁合金浸提液的制备及镁离子浓度分析
根据ISO-10993 标准,按照材料表面积/浸提液1.25 cm2/ml的比例,使用成人骨髓间充质干细胞成骨诱导完全培养基作为浸提液,制作纯镁Mg9999(99.99% Mg,河南宇航金属材料有限公司)、镁合金BM ZG 20(Mg-2.5%Zn-0.05%Ca,西安卓恰医疗器械有限公司),镁合金AZ31B(Mg-2.5-3.5%Al-0.6-1.4%Zn-0.2-1%Mn,营口银河金属材料有限公司),镁合金WE43(Mg-3.85%Y-0.48%Zr-2.14%Nd,贵州安吉有色铸造有限公司)浸提液。具体方法为:将装有上述镁及镁合金材料的容器中加入相应体积细胞培养基,放置于37℃CO2培养箱中浸泡24 h,提取出的浸提液置于4℃条件保存,24 h 内送检,利用ICPAES分析浸提液中镁离子浓度。
1.3 不同浓度高镁浓度细胞培养液的配置
根据ICP-AES 对镁及镁合金浸提液离子浓度分析的结果,分别在骨髓间充质干细胞完全培养基、成人骨髓间充质干细胞成骨诱导分化培养基加入硫酸镁七水,配置为最终镁离子浓度分别为2、4、6、8、10mmol/L 的完全培养基和成骨诱导分化培养基,保存于4℃冰箱中尽快使用。
1.4 HBMSCs的培养
HBMSCs 购买自苏州赛业生物科技有限公司。细胞复苏于6 孔细胞培养板中,放置于37℃5%CO2饱和湿度条件下培养,每48 小时更换骨髓间充质干细胞完全培养基,待细胞融合至90%进行传代,取第3代细胞用于实验。
1.5 CCK法检测细胞增殖活性
将培养至第3代的hBMSCs 使用TrypLE 消化,于15 ml 离心管中1400 r/min 离心5 min,去除上清液后使用完全培养基重悬细胞,以5×103/孔密度将细胞接种于96 孔板中,培养24 h 待细胞贴壁、形态稳定后,将培养液更换为镁离子浓度为2、4、6、8、10 mmol/L的完全培养基,对照组加入骨髓间充质干细胞完全培养基,培养液每48 小时更换1 次。分别于培养后1、3、6、12 d弃去培养液,向每孔中加入100 μl培养液和10 μl CCK-8试剂,向无细胞孔中加入100 μl培养液和10 μl CCK-8试剂作为空白组,而后在培养箱中继续培养60 min,使用酶联免疫检测仪测定每孔在450 nm 处的吸光度(optical density,OD)值。按照公式计算:相对增殖率(%)=[(实验组OD值-空白组OD值)/(对照组OD 值-空白组OD 值)]×100%,以此数值评价细胞外高镁环境对细胞增殖的影响。本实验每组设置6个复孔,重复3次。
1.6 碱性磷酸酶活性检测与碱性磷酸酶染色
将培养至第3代的hBMSCs 以1×104/孔密度接种于96 孔板中,培养24 h 待细胞贴壁、形态稳定后,将培养液更换为镁离子浓度为2、4、6、8、10 mmol/L 的成骨分化诱导培养基,对照组加入普通成骨分化诱导培养基,培养液每48 小时更换1 次。分别于培养后7、14 d 对细胞进行碱性磷酸酶活性检测,应用细胞裂解液裂解细胞,按照说明书加入显色底物,并同时制作标准曲线,37℃孵育10 min,后于405 nm 测定吸光度,利用标准曲线测定碱性磷酸酶活性,单位为二乙醇胺(diethanolamine,DEA)酶活力单位,并同时利用二喹啉甲酸(bicinchoninic acid,BCA)测定法测定每孔蛋白质含量,以DEA 酶活力单位(U)/蛋白质总量(μg)表示碱性磷酸酶活性。在相同时间点进行碱性磷酸酶染色,并使用倒置显微镜观察细胞形态并拍照。本实验每组设置6个复孔,重复3次。
1.7 茜素红染色
成骨诱导第21天,吸去96孔板中培养基,D-PBS溶液洗涤2 次,每孔加入100 μl 4%组织细胞固定液固定30 min,使用去离子水洗涤2 次,每孔加入50 μl染色5 min,吸去茜素红染料,去离子水洗涤3 次,使用倒置显微镜观察钙结节形成情况并拍照。然后在每孔中加入100 μl 10%氯化十六烷基吡啶于37℃条件下充分溶解30 min,在562 nm 测定吸光度。本实验每组设置6个复孔,重复3次。
1.8 统计学方法
应用SPSS 19.0软件进行数据分析。计量资料以均数±标准差表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 镁及镁合金浸提液镁离子浓度
镁及镁合金在细胞培养基24小时浸提液中镁离子浓度见表1。细胞培养基中镁离子含量约为0.72 mmol/L,所有浸提液中镁离子含量均显著上升,其中AZ31B 降解最慢,浸提液镁离子含量为3.71 mmol/L,而WE43降解最快,含量为5.95 mmol/L。根据以上测定结果,配置含有2、4、6、8、10 mmol/L 镁离子的完全培养基及成骨分化诱导培养基,用以模拟可降解镁基金属材料内置物在体内降解造成的局部高镁环境对BMSCs增殖及分化的影响。
2.2 细胞外高镁离子环境对hBMSCs增殖的影响
培养第1天时,所有细胞外镁离子浓度均不利于hBMSCs 增殖,2mmol/L 组(77.5%±11.7%,P<0.01)、4mmol/L 组(78.2%±12.3%,P<0.01)、6mmol/L 组(71.5%±12.3%,P<0.01)、8 mmol/L 组(73.8%±7.3%,P<0.01)、10mmol/L 组(81.6%±8.4%,P<0.05)相对增殖率均显著下降,表现出一定的细胞毒性,但各组之间相对增殖率无统计学差异(图1)。

表1 浸提液镁离子浓度测定(mmol/L)
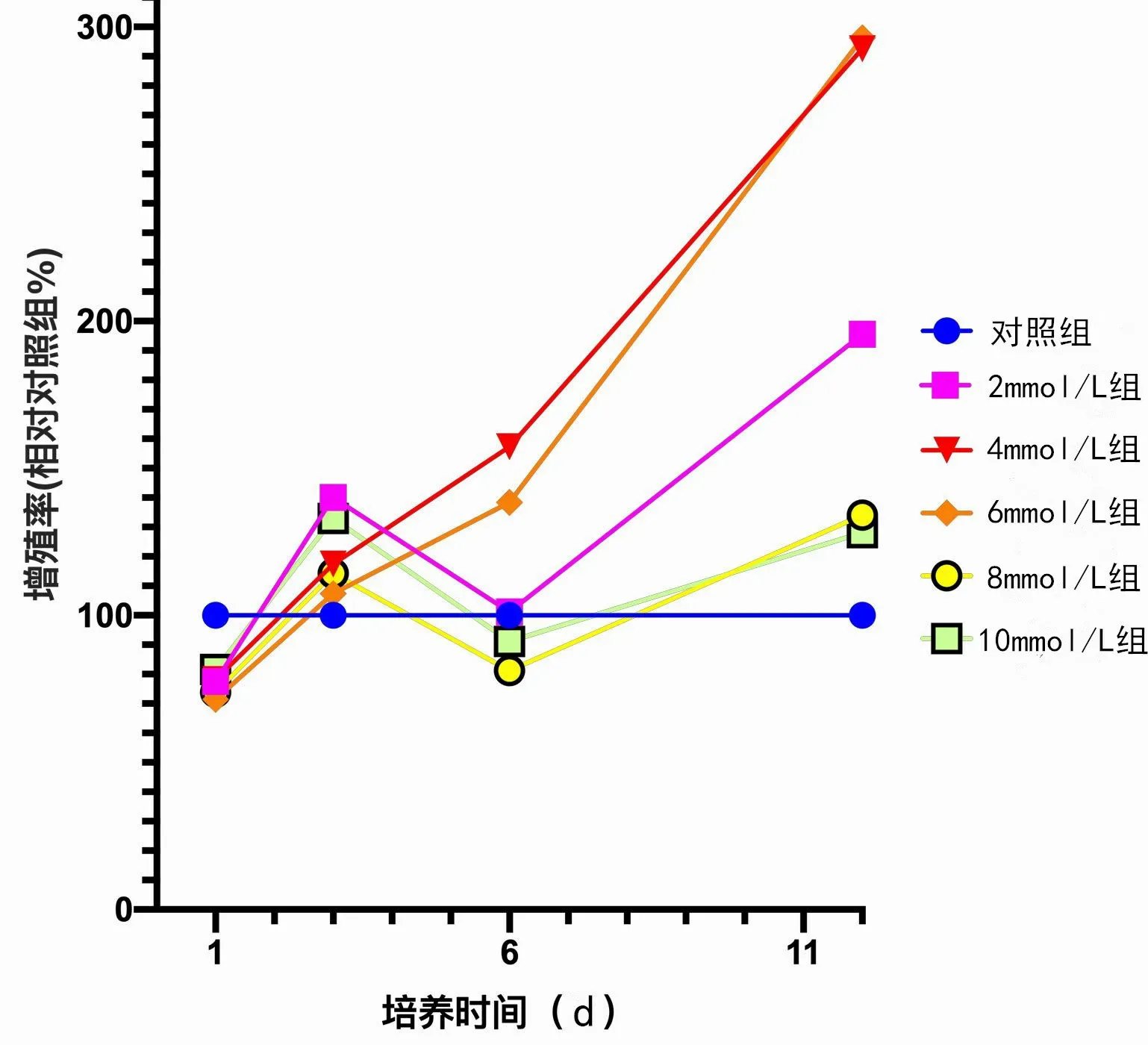
图1 细胞外镁离子浓度对细胞增殖率的影响
培养第3天,细胞外高镁离子环境不再体现出明显的细胞毒性,且2mmol/L 组(140.1%±22.8%,P<0.01)和10mmol/L 组(132.9%±11.9%,P<0.05)培养后提高了细胞相对增殖率,而4 mmol/L 组(117.7%±16.6%,P=0.384)、6mmol/L 组(107.5%±17.8%,P=0.959)、8mmol/L 组(114.3%±9.3%,P=0.673)较对照组差异均无统计学意义。组间比较,仅2mmol/L组与6mmol/L组之间差异存在统计学意义(P<0.05)。
培养至第6 天,4mmol/L 组(157.3%±12.2%,P<0.01)和6mmol/L 组(138.4%±21.3%,P<0.05)hBMSCs相对增殖率显著提高,而2 mmol/L 组(101.2%±27.8%,P=1.00)与对照组比较差异无统计学意义。8mmol/L 组(81.2%±20.8%,P=0.576)、10mmol/L 组(91.1%±17.5%,P=0.968)细胞增殖率出现下降,但差异无统计学意义。4mmol/L 组与6mmol/L 组hBMSCs相对增殖率比较,差异无统计学意义(P=0.615);4mmol/L 组、6mmol/L 组与2mmol/L 组、8mmol/L 组、10mmol/L 组分别比较,hBMSCs 相对生殖率差异均有统计学意义(P<0.05)。
培养至第12 天时,2mmol/L 组(195.6%±36.5%,P<0.01)、4mmol/L 组(292.6% ± 52.6%,P<0.01)、6mmol/L 组(296.3%±52.1%,P<0.01)hBMSCs 相对增殖率显著提高,且4mmol/L 组和6mmol/L 组提高幅度很大,相对增殖率将近300%。而8mmol/L 组(134.1%±48.6%,P=0.671)、10 mmol/L 组(128.1%±20.1%,P=0.671)对细胞相对增殖率未产生具有统计学意义的影响,但也未表现出明确细胞毒性。4mmol/L组和6mmol/L组间差异无统计学差异(P=1.000),但4mmol/L 组、6mmol/L 组与2mmol/L 组间差异均具有统计学意义(P<0.01)。4mmol/L 组、6mmol/L 组与8mmol/L 组、10mmol/L 组的组间差异有统计学意义(P<0.01),但2mmol/L 组与8mmol/L 组(P=0.115)、10mmol/L组(P=0.067)的组间差异无统计学意义。
2.3 高镁环境对hBMSCs碱性磷酸酶活性的影响
在细胞培养的第7 天,2mmol/L 组[(18.7±2.6)U/μg,P<0.01]、4mmol/L 组[(35.9±6.3)U/μg,P<0.01]、10mmol/L 组[(30.7±4.1)U/μg,P<0.05]碱性磷酸酶活性较对照组[(18.7±2.6)U/μg]均显著提高,而6mmol/L组[(26.1±4.8)U/μg,P=0.171]、8mmol/L 组[(27.6±5.8)U/μg,P=0.059]与对照组间的差异无统计学意义。实验组组间比较时,仅4mmol/L 组与6mmol/L 组之间差异有统计学意义(P<0.05)。见图2。
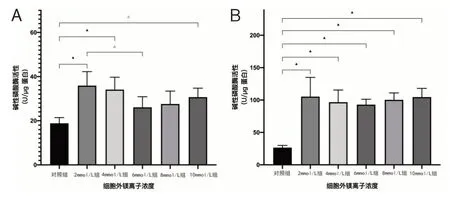
图2 高镁环境培养后hBMSCs碱性磷酸酶活性
培养至第14 天,2、4、6、8、10mmol/L 组[(105.3±29.7)U/μg,(96.7±18.8)U/μg,(92.9±8.3)U/μg,(100.4±10.6)U/μg,(104.6±13.5)U/μg,P<0.01]碱性磷酸酶活性较对照组[(26.6±3.3)U/μg]高表达更加显著,均达到3倍以上,而实验组组间表达差异无统计学意义。
在培养至第7天时,各组细胞密度接近,4mmol/L组、6mmol/L 组可以看到细胞质中较多碱性磷酸酶。培养至第14 天时,与对照组相比,高镁环境使hBM⁃SCs大量表达碱性磷酸酶(图3)。
2.4 细胞外高镁离子环境对hBMSCs 细胞外基质矿化的影响
茜素红对hBMSCs 细胞外基质中钙结节染色的结果见图4,对照组中可见散在成块的钙结节,并且在细胞外基质中可观察到均匀分布的红染钙颗粒区。而在所有细胞外高镁离子浓度组只可见少量细小颗粒状钙化结节形成。将钙结节溶解后,图5可见高镁环境组OD 值较对照组均有显著下降(P<0.01),其阻碍了hBMSCs细胞外基质矿化的过程,但高镁离子各组间差异无统计学意义。
3 讨论
3.1 镁及镁合金浸提液镁离子浓度测定及实验设计

图3 高镁环境培养后7 d、14 d各组hBMSCs碱性磷酸酶染色结果,图中蓝染部分为碱性磷酸酶
在镁和镁合金降解实验中,我们采用符合ISO-10993标准的浸提材料表面积/浸提液体积的比例,这也与我国现行使用的国标相匹配,被认为能够比较真实地反映其在体内降解的情况。但是,目前对于可降解镁合金材料的浸提液选择仍存在争议。在医疗器械评价时,经常选用一些缓冲液,例如PBS 作为浸提液,但是这种浸提液与实际临床情况相差甚远。镁合金等金属材料的降解不可以单纯以金属与水反应的化学公式而评估,由于体液中含有钙离子、碳酸根、磷酸根、蛋白质、生物小分子、细胞甚至细菌等多种物质的共同参与,在体内镁合金的降解会在金属表面最终形成MgxCay(PO4)z(OH)n的复杂化合物,同吸附在这种化合物表面的蛋白质等有机分子共同形成“保护膜”共同延缓镁合金的降解[9,10]。而之前的研究已经证实利用细胞培养液在细胞培养条件下对镁合金进行浸提更加接近人体体内降解过程[11,12]。所以在实验设计中,我们选用了细胞培养液在细胞培养条件下对目前最常用的镁及镁合金材料进行浸提。实验发现,不同镁及镁合金材料的浸提液中,镁离子的含量在3~6 mmol/L 之间。本实验中释放镁离子最快的金属是WE43,最慢的是AZ31B,纯镁释放速率在两者之间。镁及镁合金的降解速率受到纯度、工艺、铸造方法及镁合金成分等多种因素的影响,实际运用中可以对上述任一因素进行调整获取适宜降解速率的镁合金,所以我们选取几种常用的镁合金材料测定结果作为一种评价镁合金普遍降解速率的预估。
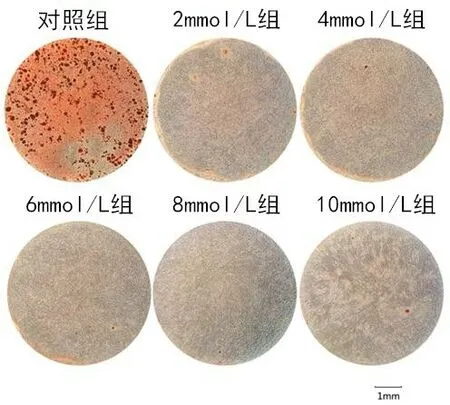
图4 高镁环境培养后21 d各组hBMSCs茜素红染色结果
多数学者在对镁及镁合金进行细胞实验时,均采用ISO-10993中提到的方法获得24 h的浸提液,认为是对体内降解后材料周围微环境的大致模拟。但镁/镁合金在降解过程中会产生表面保护层抑制腐蚀,并同时具有容易发生点蚀的特点,所以其在体内的降解速率并非一个匀速的过程,而是时刻变化、波动的。本研究采用刚进行完表面处理的材料,其置入浸提液中的反应是非常迅速的,所以第一个24 小时浸提液镁离子浓度是比较高的。据此向下向上分别设置浓度梯度,用以模拟其在体内不同时期降解产生的高镁离子微环境,以求更真实地反映体内降解情况。本研究的目的是通过实验来寻找适合hBM⁃SCs增殖与分化的细胞外高镁离子浓度的范围,以期为研发具有合适降解速率的镁合金材料及合适镁离子释放速率的复合材料提供参考。同前所述,我们在浸提液最高浓度的基础上继续向上设置镁离子梯度至10 mmol/L,由于在体内材料降解更加缓慢,且存在体液交换系统,此浓度应已高于体内局部镁离子浓度上限,同时已有研究表明高于10 mmol/L 的细胞外镁离子浓度不利于hBMSCs增殖[13]。所以在接下来的实验中,我们选定了2、4、6、8、10 mmol/L 的细胞外镁离子浓度来模拟体内镁合金降解产生的局部高镁环境。结果发现,4~6 mmol/L 细胞外镁离子浓度对hBMSCs 增殖的促进作用已经达到顶峰,故亦未继续扩大镁离子浓度梯度范围。
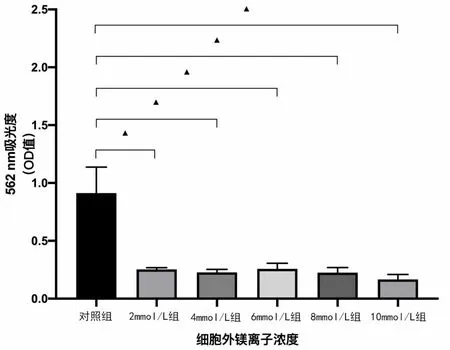
图5 高镁环境培养后21 d各组hBMSCs茜素红染色后使用10%氯化十六烷基吡啶溶解后562 nm处OD值
3.2 2~6 mmol/L细胞外镁离子浓度促进hBMSCs的增殖
镁和镁合金降解产物在局部形成的高镁离子环境对hBMSCs的影响尤为重要。骨折愈合的过程中,hBMSCs 的成骨分化,和进一步细胞外基质矿化起到了至关重要的作用,是产生骨性骨痂的重要条件,如果内置物造成其增殖能力的降低显然不利于骨折愈合。在医疗器械的评价中,如果体外实验中细胞增殖率小于80%,则认为医疗器械存在细胞毒性。本研究发现,高镁离子环境在细胞培养后第1天体现出了一定的毒性,各组细胞增殖率均出现部分下降,但在第3天细胞增殖率已经与对照组相当,培养至第6天时8 mmol/L 组和10 mmol/L 组细胞增殖率少许下降,但无统计学差异。hBMSCs培养至第12天时,不仅高镁离子环境已无细胞毒性,2~6 mmol/L浓度的细胞外高镁离子环境显著提高了hBMSCs的增殖率,其中以4~6 mmol/L促进作用最强,此浓度范围在其他研究中尚未报道过。而我们目前常用的镁合金材料浸提液浓度恰好在此范围中,这无疑是具有积极意义的。在之前的研究中,有学者发现关节软骨细胞[14]和微血管内皮细胞[15]在5~10 mmol/L细胞外镁离子环境中能够达到最高生殖率,与本研究接近。有学者利用纯镁在传统内置物材料表面形成一层镀膜,实验研究中发现其能够促进hBMSCs 增殖,与本实验相符,机制可能是降解产生的局部高镁环境对细胞增殖产生了积极影响[16]。Zhang等[17]发现处理为多孔的镁合金材料能够显著提高hBMSCs 的增殖率。但是也有研究发现,20 mmol/L、100 mmol/L 的细胞外镁离子浓度将对细胞增殖产生不利影响[13]。此外有研究提示[18],在镁合金中应用不同成分对hBMSCs黏附有影响,镁合金中含有钙并裸露于材料表面有利于细胞黏附。
从本实验结果进行拓展分析,将镁合金材料降解速度维持在一定范围内,或在复合材料中添加合理剂量的镁成分并释放,在周围组织产生合适的镁离子浓度,是镁基内置物材料设计的关键环节。
3.3 2~10 mmol/L 细胞外镁离子浓度促进hBMSCs碱性磷酸酶活性
本研究发现,2~10 mmol/L 浓度的细胞外镁离子浓度都能够显著提高碱性磷酸酶的活性,在第14 天时各组间差异无统计学意义,同时碱性磷酸酶染色可以看到细胞质中有大量碱性磷酸酶沉积,两者共同验证了细胞外高镁环境有助于促进hBMSCs 的成骨分化。与本研究相印证的是,先前已有多宗研究[13,19-23]报道钙离子和镁离子在细胞培养中有助于细胞的成骨分化及贴附。在实际的新材料研发中,Lu等[24]也发现加入可以释放镁的羟基磷灰石水泥后,MG63细胞的碱性磷酸酶活性增强。所以,镁基材料释放的镁离子在周围环境中有利于hBMSCs 的成骨分化作用是比较确切的。
而在本实验中,碱性磷酸酶活性被细胞培养孔内总蛋白量标准化,所以随着细胞增殖率上升,碱性磷酸酶总量随之上升。细胞外镁离子浓度为4~6 mmol/L时,总的碱性磷酸酶表达达到高峰。
3.4 2~10 mmol/L 细胞外镁离子浓度抑制hBMSCs细胞外基质矿化
本实验发现,2~10 mmol/L 的细胞外镁离子浓度阻止了细胞外基质矿化的过程,且作用十分显著,下降幅度超过50%,且各组间无显著差异。这与Leidi等[25]发现的5 mmol/L以上镁离子不利于SaOS-2细胞细胞外基质矿化的结果一致。这无疑非常不利于镁合金/含镁复合材料的研发,那么在研发中如何解决这一问题呢?
在开发镁基材料时,有学者研究发现[26],单纯镁支架在含有巨噬细胞的培养基中降低了BMSCs细胞外基质矿化的能力,但镁支架表面复合β-TCP 后,BMSCs 细胞外基质矿化的能力有所回升。将镁元素加入磷酸钙骨水泥中,在表面形成磷酸镁或MgHA,显著增强了BMSCs 在其表面的贴附能力和增殖能力,这可能与局部的高镁离子环境相关。含镁的磷酸钙骨水泥显著提高了BMSCs成骨分化的能力和细胞外基质矿化的能力,并且在动物实验中证实其促进了成骨效应,这说明两者间的协同作用[27]。Chen等[28]将镁合金制作成筛网状加入到PLGA/DBM(脱钙骨基质)支架中,发现hBMSCs 的成骨分化和细胞外基质矿化能力均明显提升,且通过动物实验证实其有效地修复了动物颅骨缺损。以上多个实验说明类似于羟基磷灰石、脱钙骨基质等具有成骨诱导活性的材料与镁的结合可能可以协同促进细胞外基质矿化,是改善镁对细胞外基质矿化阻挡作用的选择之一。Tian 等[29]已经成功利用羟基磷灰石纳米颗粒对镁金属表面进行表面涂层处理,发现hBMSCs可直接在其表面增殖,这说明以上想法是可以实现的。Cipriano 等[30]利用阳极氧化技术对镁表面进行处理,在类体液环境中降解表面更容易生成富含磷和钙的钝化层,在未来这可能是上述理论应用于镁金属材料的方法之一。
对镁的研究中,我们最期望镁合金能够作为一种可降解金属内固定物的原材料来应用,因为其机械强度和抗拉强度更适合骨折/矫形手术的内固定。研究也发现纯镁/Mg-2Ca/Mg-5Al镁合金浸提液有利于hBMSCs 成骨分化,纯镁/Mg-2Ca/Mg-1Y 有利于细胞外基质矿化,两者之间作用并不平行[31],但实验组并没有发生镁离子“钙化阻挡”效应。这可能与轻度提高的pH 值有利于细胞外基质矿化有关,但是这种效应在体内缓冲系统的作用下会减弱。同时已有研究证实[32],在锌表面和含有锌的镁合金AZ31 表面,hBMSCs 的成骨分化和细胞外基质矿化能力明显增强。Wang 等[33]合成了含有少量β-TCP 的镁锌合金,发现其明显提高了hBMSCs 的成骨分化和细胞外矿化能力。本研究包括上述体外实验均排除了真正发生骨折/截骨时体内的炎症反应对hBMSCs 的成骨分化与细胞外基质矿化的激活效应[34],这也造成了体外实验的局限性。但也已有报道[35]发现镁锌锶合金所制成的骨髓内针在动物体内固定骨折时,相对于纯镁的骨针和对照组,明显促进周围新骨形成,在磷酸钙材料中加入少量的锌也在体内促进了新骨生成[36]。很多研究证实锌离子能够通过上调成骨细胞的活力促进成骨,并能够抑制破骨细胞活性减少骨的吸收[37,38]。其中机制可能是锌上调碱性磷酸酶活性[39],以及成骨细胞Runx-2、OPG和OC的表达[40]。但将锌作为原料的镁合金在降解过程中两者产生协同效应的机制还亟待进一步研究。上述研究结果意味着部分合金成分(例如锌)也具有改善镁离子“钙化阻挡”的作用,这或许也是设计和筛选适宜的镁基材料的另一思路。
综上所述,适当的高镁离子浓度环境有利于hBMSCs 增殖及成骨分化,但高镁离子浓度不利于细胞外基质矿化。在未来骨科用镁、镁合金、含镁复合材料研发中,需要通过进一步研究干预和解决高镁环境的“钙化阻挡”效应,扬长避短,发挥镁基材料的优势。从既往的研究来看,在镁材料上复合其他具有活性的无机材料(如羟基磷灰石),或者在镁合金成分中加入其他有协同作用的元素(如锌),可能是解决这一问题的未来方向。

