骨科可降解镁合金生物材料的研究进展*
周盟 黄艺聪 康斌**
(1.骨科生物材料国家地方联合工程研究中心,广东深圳 518036;2.北京大学深圳医院骨关节科,广东深圳 518036)
早在19 世纪初,镁金属作为骨科内植物材料用于人体治疗,有学者将镁金属线用于术中的结扎止血[1]。后因为镁金属机械性能与人体皮质骨相似(表1),又有多例报道使用镁合金内植物治疗骨折,但因降解速度过快以及产生无法处理的气腔而导致治疗失败的比例较高[2],镁合金材料作为骨科植入物的应用随之减少。
进入21 世纪后随着材料生产工艺的不断提高,将镁进行合金化处理后,其机械性能、抗腐蚀性能等得到提高[3],且生物安全性未受影响,镁合金因此再次成为骨科领域研究热点之一。镁降解释放的Mg2+参与生物体内多种新陈代谢,包括调节骨代谢活动,诱导新骨生成。大量研究证明Mg2+能够通过多个信号通路影响骨代谢。多项人体外细胞实验、动物体内实验和一些临床试验证明镁合金具有骨科内植物材料所需的特性,有望成为一种骨科特色应用的新型材料。
1 镁的合金化
镁的合金化是在镁金属中加入其他金属元素构成合金,通过调整不同元素的含量或者添加不同元素,优化镁材料的性能。镁在合金化后抗腐蚀性、机械强度得到了明显提高(表2),同时具有较好的生物安全性。目前最常用的合金化元素是锌(Zn)、锆(Zr)、钙(Ca)、锶(Sr)、铝(Al)等。以下就添加不同金属得到的二元、三元及多元镁合金材料的研究进展进行阐述。
1.1 二元镁合金
1.1.1 镁-锌二元合金:锌是人体必需微量元素之一,在人体生长发育过程中起着极其重要的作用。镁-锌合金比纯镁具有更好的机械强度[4]和耐腐蚀性[5]。锌使镁-锌合金屈服强度(抵抗外力使之变形的强度)增加,研究表明当锌含量为6wt%(锌占总重量的6%)时屈服强度最大,含量为4wt%时终极抗拉强度和延展性最佳[6]。镁-锌二元合金比纯镁抗腐蚀性强,将三种镁-锌合金(Mg-1Zn、Mg-5Zn 和Mg-7Zn)和纯镁在模拟体液(simulated body fluid,SBF)中浸泡后观察溶液pH值变化,三种镁-锌合金溶液pH值改变均小于纯镁,其中Mg-5Zn合金pH变化最小[7]。在电化学测试和腐蚀形貌观察的基础上,发现随着锌含量的增加,镁-锌合金的耐蚀性大约成抛物线变化,锌含量在2~3wt%范围耐蚀性最佳,高于或低于此范围后,可观察到MgxZny二元共晶化合物(两种金属离子通过金属键按一定比例相形成晶体化合物,x、y分别为镁离子、锌离子数量)生成增多,产生“微阴极”效应,导致合金降解速度加快[8]。在镁中加入锌可以提高铁、镍、钴等杂质的含量限度,有效降低合金电偶腐蚀的可能性,增强抗腐蚀性[9]。多项动物实验证实镁-锌合金具有良好的生物相容性(表3),将镁-锌(5.62wt%锌)棒植入兔子股骨后,对心肝肾脾等器官进行检测,未发现合金对这些器官有任何毒性[10]。
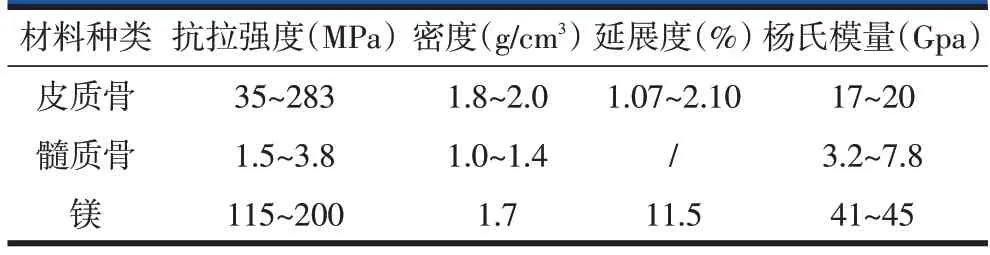
表1 正常骨组织与纯镁的机械性能

表2 部分镁合金植入物的机械性能
1.1.2 镁-锆二元合金:锆是镁合金化中最常用的晶粒(组成多晶体的外形不规则的小晶体,直径通常在0.015~0.25 mm)细化剂,在镁中加入锆可使等轴晶系(对称性最强晶系,如立方体、四面体、八面体等)细化,使合金具有更好的抗腐蚀性和机械强度。镁-锆合金的耐腐蚀性增强是由于在表面形成锆、镁的氢氧化合物[11]。Mg-1Zr 在所有二元镁-锆合金中具有最高的应力强度和延展性。分别在SBF 溶液和平衡盐(Hank)溶液中浸泡300 h后,Mg-1Zr氢气产生量均明显低于纯镁。同样,浸泡在DMEM(Dulbecco's modified eagle medium,伯克改良伊格尔培养基)中,Mg-1Zr 的pH 变化(8.58±0.05)比纯镁(9.18±0.14)更小[12]。锆使镁-锆合金晶粒细化,提高了延展性和耐腐蚀性。镁-锆合金中当锆含量达到3.8wt%时可使晶粒尺寸减小,当超过该含量限度时会产生纯锆颗粒,从而影响合金性能[13]。
1.1.3 镁-钙二元合金:钙是组成人体骨骼最重要的矿物质之一,因此镁-钙合金的生物相容性好,具有非常好的骨科应用前景。钙同样可细化镁的晶粒从而提高合金的机械性能[4,19]。钙含量0.6wt%时合金具有最佳的抗弯和抗压强度[14]。当钙处于较低含量时(0~4wt%),镁-钙合金抗拉强度较纯镁增加,抗腐蚀性增强[15]。镁-钙合金的耐腐蚀性在钙含量0.6wt%时最佳,进一步增加钙含量反而降低了镁-钙合金在SBF中的极化电阻(电流通过电解质溶液和电极表面的某种类型的膜时产生的欧姆电位降),增加Mg2Ca 二元共晶体积,从而使原电池反应增强,并最终降低抗腐蚀性[4]。评估降解性能的另一个重要指标是电解液pH 变化,镁降解产生Mg(OH)2使溶液pH 增高,因此溶液pH 增高程度越大,合金降解程度越高。将5种镁-钙合金浸泡在SBF 中发现钙含量最低的Mg-0.5Ca 合金pH 改变最小,钙含量最高的Mg-10Ca 的pH改变最大[1]。目前有多项关于镁-钙合金的体内研究,Makkar 等[16]通过SEM、EDX 和XRD 观察镁-钙合金在兔子体内降解变化,发现Mg-0.5Ca 具有良好的生物相容性,并具有增强的骨形成,Mg-5.0Ca合金具有更高的初始腐蚀速率,更快的降解速度和更长的发炎时间。Erdmann 等[17]将Mg-0.8Ca 螺钉植入兔胫骨,评估其机械性能和降解性能,采用316L 不锈钢螺钉作为对照。术后3 周两组均见新生骨组织。在降解方面,Mg-0.8Ca 螺钉在2 周后有轻度降解,4~8周观察到降解明显加快,尽管Mg-0.8Ca 螺钉在2~4周的抗拉强度与不降解的316L 螺钉相当,但4~8 周其抗拉强度明显下降(表3)。表明期间Mg-0.8Ca 合金在体内降解速度过快,导致其机械强度早期下降。镁、钙均为人体正常摄入元素,因此镁-钙合金具有自然生物相容性。目前实验未发现镁-钙合金植入物在动物体内产生任何毒性或不良反应[18]。将镁-钙合金植入兔体内观察8 周,具有良好的生物相容性[19]。
1.1.4 镁-锶二元合金:锶是人体内重要微量元素之一,其中99%储存在骨骼内。与镁、钙相似,锶与骨的形成密切相关,并可以调节骨髓间充质干细胞向成骨细胞分化[20]。锶的加入可以提高镁-锶合金的抗压强度、生物相容性[13]。镁与锶的合金化过程中其微观结构发生基于α-Mg和Mg17Sr2两相的晶粒细化(金属铸锭过程中使金属截面上具有均匀、细小的等轴晶),使合金的机械强度增加,镁中锶含量增加也导致第二相析出物的形成和晶粒细化[11]。锶含量为2wt%的镁合金抗拉和曲屈强度最佳,另一方面,在与锶合金化后镁的延展性降低[21]。加入锶后,合金的耐腐蚀性提高,当锶含量在1.5~2wt%时耐腐蚀性最佳。锶含量超过2%时,Mg17Sr2二元相形成增多,原电池腐蚀增强,降低了合金抗腐蚀性[22]。体外研究表明锶含量增加到2wt%时,镁-锶合金在Hank 溶液中的耐腐蚀性增加[23]。锶含量小于1.5wt%的镁-锶合金在SBF 中降解速率低于纯镁,腐蚀速率最慢的为含0.5wt%锶的合金[21]。锶不仅有自然生物相容性,同时有生物活性。Mg-0.5Sr 合金与Mg 63 细胞在DMEM中共培养,合金对细胞无毒副作用[17]。动物实验也证实了镁-锶合金的自发降解性和良好的生物相容性,Gu 等将Mg-2Sr 合金棒植入小鼠股骨,4 周后Mg-2Sr合金棒有降解迹象,新生骨密度明显高于空白对照组。尽管合金棒有局部的表面腐蚀,但基本保持了完整形态。新形成的骨与合金表面接触良好[14]。相似的研究,Dong等将Mg-1.5Sr合金植入兔体内,植入8周后的结果证明镁-锶合金生物相容性好(表3),具有作为骨科植入材料的潜力[24]。目前研究都限于4~8周较短期的生物安全性评估,还需要更多体内实验评估其长期生物安全性。
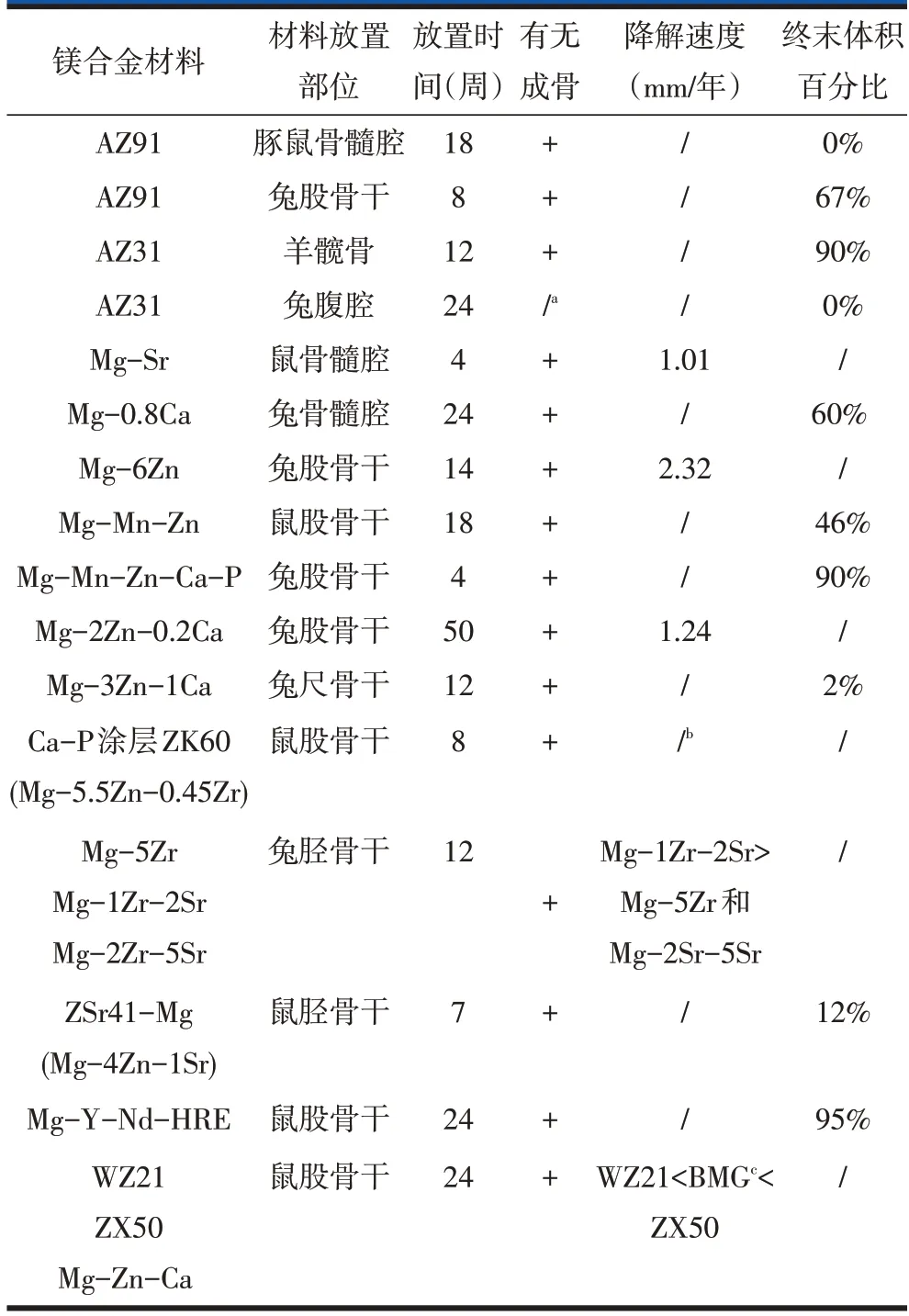
表3 不同镁合金在实验动物体内成骨及降解情况
1.1.5 镁-铝合金:将铝加入镁中可以促进合金固溶强化(纯金属经过适当的合金化后,强度、硬度提高的现象)及时效硬化过程,提高镁-铝合金的机械强度和耐腐蚀性,同时也表现出很好的可铸造性[25]。镁-铝合金中铝最佳含量在2~9wt%,在此范围内,随着铝的含量增加镁-铝合金的腐蚀速率会逐渐减缓[26],原因之一是合金表面形成不溶的Al2O3,起到保护作用。Miura等将Mg-1Al合金模型分别植入小鼠头部、背部、股骨干内4周,在头部中被腐蚀最快,在背部中部被腐蚀,而在股骨中腐蚀最慢,考虑是头部手术伤口未成熟的肉芽组织覆盖较其他部位厚,提供大量新生血管所致,但在组织学观察下都具有良好的生物相容性[27]。相比纯镁,镁-铝合金在SBF溶液、磷酸盐缓冲液(phosphate buffer solution,PBS)和NaCl溶液中抗腐蚀性增强[28]。镁-铝合金抗腐蚀的另一个重要因素是含有杂质元素(Fe、Ni、Cu),当杂质元素的含量保持在一定限度内,可以避免形成原电池反应。若杂质元素超过其含量限度,可在合金内部构成原电池的阴极,产生原电池反应,导致合金局部腐蚀,加快降解[29]。例如铁含量高于容限时,腐蚀速率会迅速增加,然而随着合金中铝含量的增加,其耐蚀性下降的趋势会得到一定的扼制,但不能得到逆转[30]。
1.1.6 镁-铜合金:铜金属具有一定抗菌性能,但其与Mg制备成合金,易出现电偶腐蚀,随着Cu的加入,合金的腐蚀速率显著增加。但随着工艺技术的提高,Yan 等制备出Cu 含量在0.1~0.3wt%范围内的Mg-Cu合金。发现Mg-0.1Cu合金具有最佳的耐蚀性能和良好的抗菌活性,Mg-Cu 合金可以促进成骨、血管生成,并有望用于骨髓炎的治疗,成为抗菌生物降解植入材料。Mg-0.1Cu 合金具有较慢的降解速度,但49.5 mm/年的腐蚀速率仍然过快,不能应用于骨科临床中,如何控制降解速率仍是Mg-Cu 合金面临的主要困难[31]。
1.2 三元镁合金
有学者以羟基磷灰石(hydroxyapatite,HA)作为对照,对ZK30(Mg-Zn-Zr)合金的生物相容性进行评估,发现ZK30具有更高的生物相容性,并能促进细胞增殖[32]。使用4 种Mg-4Zn-xSr 合金(4wt%锌和含量分别为0.15、0.5、1.0和1.5wt%的锶)作用于人类胚胎干细胞评估其生物相容性,4种三元合金均比纯镁具有更好的促细胞活性,促细胞活性最强的是锶含量为0.15wt%的Mg-4Zn-0.15Sr 合金[33]。将Mg-Zn-Ca合金与脂肪来源间充质干细胞在DMEM中共培养24 h,干细胞生存能力比在无Mg-Zn-Ca 合金的DMEM中要高[26]。在镁-锌合金中加入其他元素形成三元合金,可进一步改善镁-锌合金的性能。在Mg-4Zn 合金中添加钙,当钙含量在0.2~0.5wt%范围内,极限抗拉强度和延展性最佳,钙含量0.2wt%时合金在Hank溶液中生成H2最少,耐腐蚀性最高[23]。Zhang 等将不含涂层的Mg-Zn-Ca 合金(锌含量2.5~3.0wt%,钙含量0.5~1.5wt%)植入兔子尺骨缺损模型中,虽然有促骨效应,但是合金在植入的12周后几乎完全降解,降解速度过快不能给骨再生提供合理的机械性能支持,因此考虑通过增加表面涂层控制镁合金的降解速度[34]。同样,Mg-Zn合金加入一定重量的锶也可以改善耐腐蚀性。比较三种Mg-Zn-Sr 合金(锶含量分别为0.5、1.0和1.5wt%),含0.15wt%锶的Mg-Zn-Sr合金在SBF 溶液中质量损失最少。ZSr41 合金(一种Mg-Zn-Sr 合金)的机械性能,如硬度、极限抗拉强度和延展性与时效处理(合金经过固溶处理,从高温淬火或经过一定程度的冷加工变形后,在较高的温度或室温放置爆出其形状、尺寸,性能随时间而变化的热处理工艺)有关,175℃条件下时效处理时间8 h 时上述性质最佳,若时效时间延长上述性能反而下降[35]。在Mg-4Zn 合金当中添加Nd(钕)量为1.0wt%时,二次枝晶间距降低至10~20 μm,屈服强度和延伸率达最高值,分别是195.7 MPa 和6.8%[36]。体内实验证明三元镁合金具有良好的成骨特性,Bian等将Mg-1.8Zn-0.2Gd 钢钉植入鼠股骨内,2 个月后合金外形依然保持完好,6个月后合金才基本完全降解[41],整个降解过程均观察到良好的成骨效应。卢燕勤等将含Ca-P 涂层ZK60(Mg-5.5Zn-0.45Zr)合金植入大鼠股骨缺损模型中,8 周后可见明显成骨反应,组织没有填满缺损区域[38](表3)。
与纯镁相比,镁-锌合金(锌含量2~5wt%)极限抗压强度明显增强,Mg-Zr-Sr 合金(锌含量2~5wt%,锶含量2~5wt%)极限抗压强度随锶含量增加而下降。Mg-Zr-Sr 合金的耐蚀性随晶粒尺寸的减小而降低,因为随着锶含量的增加,合金晶界的宽度和粗糙度增加[39]。Cipriano 等将ZSr41-Mg 合金髓内钉植入大鼠胫骨内,通过CT 扫描3D 重建观察植入髓内钉变化,在28天前均匀降解,但其后开始失去结构完整性并降解成更小的节段[40]。另外有学者将不同含量Mg-Zr-Sr合金植入兔子股骨内,3个月后Mg-1Zr-2Sr组和Mg-2Zr-5Sr 组骨密度和骨矿物质含量均高于Mg-5Zr组(表3)。同时发现Mg-5Z组和Mg-2Zr-5Sr组新生骨与合金表面接触欠佳。Mg-1Zr-2Sr新生骨与合金表面融合良好。总体来说Mg-1Zr-2Sr合金降解速率和机械性能以及生物相容性最好[38]。
在镁-铝合金中加入其他元素,如钙、锌、锰(Mn)、稀土元素(rare earth elements,REEs)等可以改善性能。将钙加入AZ91(Mg-Al)合金中可以细化β相的微观结构并使其热稳定性增加,提高屈服强度(抗变形应力)和蠕变强度(固体材料在保持应力不变的条件下,应变随时间延长而增加的现象)。把钙和镧系元素(镧:La,铈:Ce)一起加入AZ91 合金,可提高屈服强度和蠕变强度[41]。在镁-铝合金中加入锌可提高耐腐蚀性,加入硅(Si)在高温下增加了蠕变强度和抗张力强度[42]。Mg-Si-Sr合金中,降解速率的加快与锶相含量和金属间化合物MgSi、MgSiSr 和Mg⁃SiSr粗大颗粒的存在有关[43]。
1.3 多元合金
Hendrik 等将MgYREZr(WE43)合金制备成接骨板模型,在体外分别与人成骨细胞、成纤维细胞和骨肉瘤细胞孵育,与传统钛合金相比,有明显促细胞生成效果,表现出良好的生物相容性,但增殖率呈时间依赖性降低,尤其是成纤维细胞组[44]。另有学者将Mg-0.96Zn-0.21Zr-0.3REEs棒植入兔子胫骨,在术后第12 周未观察到合金降解,在第36、53 周分别降解约58%和85%,虽然观察到骨组织生成效果好,但新生骨密度和孔隙率相对于正常骨差,因此不建议继续使用它进行生物医学实验[33]。多种元素加入镁合金中,同时需要注意生物安全性,孔祥东等在新西兰兔子腹腔中植入AZ31 镁合金,在长达24 周的观察中,兔子的抽血检查未见金属元素指标异常,组织标本未见有害物质集聚[45](表3)。在Mg-Zr-Sr 合金中加入适量的稀土元素能改善抗腐蚀性,提高生物相容性和机械性能,当钬(Ho)元素含量从1wt%增加到5wt%显示合金晶粒尺寸明显下降,耐腐蚀性有所提高。Mg-1Zr-2Sr-xHo(x<5wt%)合金作用于成骨细胞,比Mg、Mg-1Zr-2Sr 和对照组表现出更好的生物相容性[46]。锆(Zr)是镁合金晶粒细化的最佳元素之一,可以与锶、钙、钬一起被添加入镁合金。Mg-1Zr-2Sr-3Ho是目前机械性能、抗腐蚀性和生物相容性最好的合金[46]。加入少量其他元素进行合金化可以提高镁-钙合金的机械性能和抗腐蚀性,如铝、锌、锰。将铝加入镁-钙合金可提高时效硬化反应(过饱和固溶体在时效过程中使合金的强度和硬度升高现象),增强机械强度[47]。与Mg-2Ca 和Mg-4Ca 相比,Mg-2Ca-0.5Mn-2Zn 在SBF 中pH 值变化最小,具有更好的耐蚀性[48]。
1.4 不同镁合金在骨科植入材料领域的临床试验
多项动物体内实验虽然证实不同镁合金都有良好的治疗效果,但尚无研究明确哪种合金治疗效果最佳(表4)。镁合金作为骨科新型内植物,目前取得了一定的临床进展,Mg-Y-RE-Zr(镁-钇-稀土元素-锆)合金、Mg-5Ca-1Zn 两种镁合金和纯镁都已经进行了临床实试验。2010 年,Plaass 使用德国Syntellix公司生产的Mg-Y-RE-Zr 螺钉应用于拇外翻矫形手术,术后骨折端愈后良好,患者未出现不良反应[49]。随后该公司推出的镁合金螺钉用于治疗四肢骨折及骨折不愈合等,均取得良好效果[50,51]。2015 年,韩国生产的Mg-Ca-Zn 螺钉被批准应用于临床舟骨及桡骨远端骨折不愈合内固定治疗,临床观察显示,患者骨折线愈合良好,螺钉可在6~18 个月内完全降解[51]。大连大学附属中山医院赵德伟将纯镁螺钉用于股骨头坏死的游离髂骨移植治疗。术后随访时间1 年,降解螺钉周围骨生长明显好于对照组,表现出良好的成骨性能[52]。上述临床试验均使用单个纯镁或镁合金螺钉,植入部位为非负重区域,取得了良好的临床治疗效果。考虑到未来镁合金内植物可能会运用到需要提供强大支撑力或扭转力的长骨,因此其是否能够提供足够的机械强度仍然未知。Hel⁃mecke 等使用Mg-Y-RE-Zr 镁合金干涉螺钉固定人工韧带在人造骨上,较普通干涉螺钉,镁合金干涉螺钉需要更大的力量才可拔除,给韧带固定提供更好的稳定性[48]。目前临床试验均未观察到纯镁及镁合金螺钉周围骨质内及软组织内有大量气体聚集,仅在周围的骨质内见射线透亮区,周围软组织内见少量气体聚集,前者在术后4~6 周内消失,软组织内气体在术后2个月内被完全吸收[50,51]。气体量不多原因可能与螺钉与人体体积比较小有关。若后期需要使用较多数量的螺钉或体积较大的镁合金板或者假体时,降解过程可能产生大量气体聚集于周围组织内。此时对其降解速度的控制尤为重要,减缓降解速度是控制气体产生的关键所在。目前的临床试验证明纯镁及镁合金螺钉在骨科临床应用方面提供了所在部位所需的支撑力,同时具有较高的生物相容性,且降解速度未出现过快的现象[50,51]。临床试验为镁合金未来在骨科的临床应用提供了宝贵的数据,打下坚实的基础。随着更多临床试验的开展,将会对镁合金在骨科的应用起到巨大的推进作用。
2 镁合金现存的主要问题与挑战
镁-锌合金具有良好的力学性能、耐腐蚀性和生物相容性。目前锌是被推荐为生物医用镁合金的首选合金化元素,当镁合金中锌含量为4wt%时力学性能、耐腐蚀性最佳[6]。同时可在镁-锌合金中添加其他元素提高生物性能,但要保持4wt%的锌含量。尽管镁-钙合金生物相容性和机械强度好,然而其降解速度过快导致早期机械性能下降,极有可能使内固定失效。因此如何提高其抗腐蚀性,控制降解速度仍是镁-钙合金需要解决的首要问题。镁-锶合金除了有良好的机械性能、生物相容性和抗腐蚀性,还具有一定的生物活性,能促进骨髓间充质干细胞向成骨细胞分化。但如何获得镁-锶的最佳抗腐蚀效果和力学性能仍然是一个挑战。在镁-锶基础上加入较强的抗腐蚀元素形成三元合金是解决此问题的较好方法,但仍需要体内实验证明长期生物相容性。镁-铝合金虽然具有较好的机械强度和耐腐蚀性能,但铝在体内的堆积可导致中枢神经损伤,并对体内成骨细胞有害。关于镁-铝合金的生物相容性仍存在争议,虽然有学者将Mg-1Al合金放入大鼠体内4周,结果表明合金具有良好的生物相容性[27]。目前实验已证实镁-铝合金的短期生物相容性,但还未明确铝的安全含量范围及镁-铝合金是否有长期的生物相容性。迄今没有明显的证据表明其具有长期的生物相容性,因此使用镁-铝合金进行临床研究要慎重。
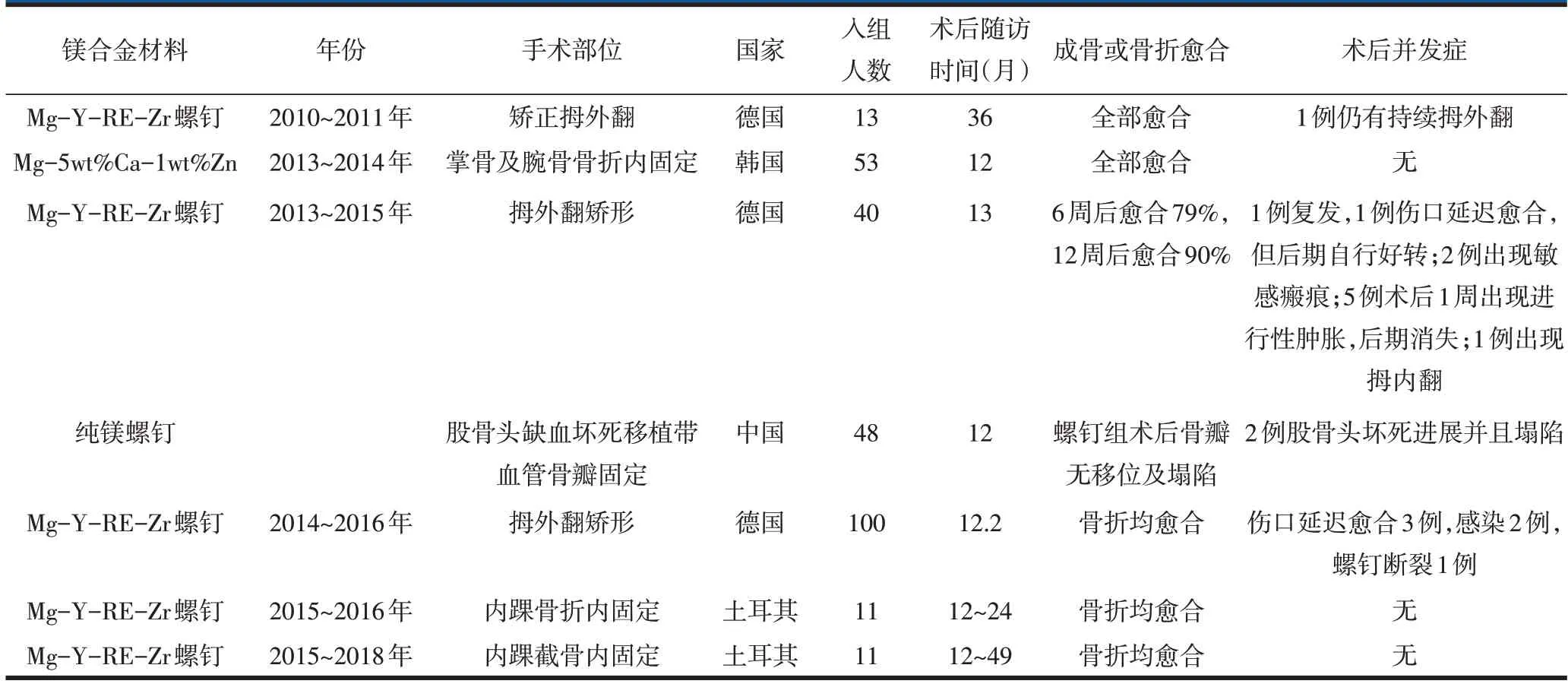
表4 不同国家实验镁或镁合金进行临床研究情况
镁合金作为极具潜力的骨科内植物材料,除了可自发降解、生物相容性好等优点外,镁在体内降解产生Mg2+还可促进新骨形成,但具体成骨机制尚未完全明确。目前对Mg2+的促成骨作用的分子生物学研究虽取得了一定的进展,认为Mg2+的促成骨可能与PI3K/Akt通路、骨保护素(OPG)/RAKL通路、TRPM蛋白通路及Wnt 信号通路等有关。但具体每个通路在成骨方面作用大小仍需进一步研究明确[53]。
镁合金在骨科应用中存在的主要挑战仍然是如何控制合金降解和气体的产生的速度。完美的骨科可降解内植物材料在骨折愈合前不被降解,提供足够的机械强度,以维持坚强内固定作用,骨折愈合后缓慢均匀降解,避免产生大量气体聚集。镁合金早期降解速度过快导致机械强度的快速下降,产生的气体聚集在植入部位,从而导致内固定作用失效、疼痛、感染等并发症。目前解决的主要方法是合金化和表面涂层技术。表面涂层技术可使内部合金与组织隔绝,常用涂层有钙磷陶瓷涂层(如羟基磷灰石HA)、β-磷酸三钙(β-TCP)、聚乳酸-羟基乙酸共聚物(PLGA)、二水磷酸氢钙(DCPD)、聚合物涂层聚己内脂(PCL)及复合涂层,也有学者不断制备出各种新型涂层,使用氟化物处理获得MGF 涂层[54]。虽然在骨折愈合早期不被降解,以维持其内固定作用,待涂层完全降解后内部的镁合金接触到体液后均匀缓慢降解,但缺乏涂层保护的镁合金后期降解速度较快仍可能产生大量气体,引起并发症[33]。将具有生物相容性的元素及稀土元素加入镁中进行合金化,可以有效提高合金抗腐蚀性。但其早期抗腐蚀性未必能达到临床应用标准,因此可以将二者结合,早期具有涂层保护的镁合金在涂层的保护下不发生降解,提供足够的力学支撑作用,后期涂层降解完全后合金缓慢降解避免产生大量气体聚集,并局部持续提供一定浓度镁离子,提高抗菌及促骨修复效果[38,55-57]。
3 总结与展望
镁合金具有可降解性能、良好的力学相容性和生物安全性,作为新一代可降解医用金属材料,目前是骨科内植物领域研究热点之一,被誉为“革命性的金属生物材料”[58]。但最终能否取代传统内固定材料并广泛应用于骨科临床治疗取决于是否有可控的降解速率、材料的安全性及对产生气体的处理。因此需要更多系统深入的研究,为镁合金的临床骨科应用提供更加可靠的科学实验依据。相信随着化学制造工艺的发展和医学的进步,各种新型可降解医用镁合金材料在骨科将得到更广泛的应用。

