无前柱支撑PVCR治疗脊髓功能Ⅰ型重度僵硬性脊柱侧后凸的神经并发症分析
隋文渊 邓耀龙 杨靖凡 张伟 黄紫房 范恒伟 王其飞 杨军林*
(1.上海交通大学新华医院脊柱中心,上海 200000;2.中山大学附属第七医院骨科,广东深圳 518107;3.中山大学附属第一医院脊柱外科,广州 510080;4.安徽医科大学第二附属医院骨科,合肥 230000)
重度僵硬型脊柱侧后凸是发生在脊柱的复杂三维结构畸形,一般指Cobb 角超过100°同时伴有骨性结构异常、肋骨形态异常甚至局部骨性融合而导致柔韧性丢失的一类畸形。其可随着年龄增长及退变因素的出现而逐渐加重,进一步影响心肺功能、外观,畸形的持续加重还会产生脊髓压迫、机械性疼痛、间歇性跛行等症状并进一步导致心理障碍,具有很高的致死致残率[1,2]。全椎体切除术(posterior verte⁃bral column resection,PVCR)是该类畸形最有效的治疗手段之一。由于手术技术限制和麻醉要求较高,该术式存在诸多并发症,而其潜在的神经并发症仍是目前脊柱外科医师面临的巨大挑战[3,4]。自2010年开始,我们采用脊髓功能分型系统对该类脊柱畸形进行临床分型,并通过无前柱支撑PVCR治疗脊髓功能I型重度僵硬性脊柱侧后凸畸形,术中采用多模式诱发电位监测。本研究目的是分析该治疗方法的相关病例神经并发症的发生情况及可能的发生原因。
1 资料与方法
1.1 重度僵硬性脊柱畸形脊髓功能分型及推荐手术方式[5]
Ⅰ型:术前MRI 神经结构无异常,诱发电位无异常,神经查体无异常,可使用Ⅴ级及以上截骨,无前柱支撑。Ⅱ型:术前MRI 神经结构和(或)诱发电位有异常,神经查体无异常,可使用Ⅳ级及以下截骨,前柱支撑。Ⅲ型:神经查体异常,并伴或不伴术前MRI神经结构及诱发电位异常,可使用Ⅲ级及以下截骨,适度矫形。
1.2 一般资料
选取2013年3月至2019年2月收治的脊髓功能I型重度僵硬性脊柱畸形患者36例,男15例,女21例;年龄12~51岁,平均(17.6±6.1)岁。术前侧凸Cobb角107°~172°,平均115.6°±8.0°;后凸Cobb 角85°~160°,平均90.0°±20.2°。所有患者均成功随访并有完整影像学资料及术中电生理监测资料。术前心肺功能均需达到以下标准:射血分数(ejection fraction,EF)>50%,用力肺活量(forced vital capacity,FVC)>40%,无呼吸道感染表现。所有女性患者均避开月经期手术。对于未能达到以上标准的患者均一期给予Halo骨盆/Halo 重力牵引配合肺功能锻炼,直到肺功能达标后再行手术治疗。
1.3 麻醉及手术方法
为避免吸入麻醉剂对运动诱发电位(motor evoked potentials,MEP)的干扰,所有手术均在全身静脉麻醉下进行。麻醉方案:丙泊酚诱导1.5~2 mg/kg、7 mg/kg/h 维持,麻醉诱导时应用非去极化肌松药物辅助气管插管,之后手术全程不再使用肌松药物。术中对患者进行严格体温控制(36~37°C)。
所有患者均采用无前柱支撑PVCR术式,手术方式详见参考文献[6],所有手术均由通信作者主刀完成。
1.4 术中监测方法、阳性报警标准及评价标准[6,7]
应用Endeavor CR16 通道监测仪(Nicolet 公司,美国),采用MEP、体感诱发电位(somatosensory evoked potentials,SEP)及下行神经源性诱发电位(de⁃scending neurogenic evoked potentials,DNEP)的联合监测模式。
1.4.1 MEP 监测模式:刺激电极固定于头皮C3、C4 前方2 cm 处,C3、C4 互为阳极或阴极,阳极为刺激极。刺激左侧皮质时C3 为阳极、C4 为阴极;反之亦然。记录电极位于大、小鱼际肌,胫前肌以及足短屈肌处。设置滤波20~1000 Hz,扫描时间100 ms,刺激强度100~400 V,单次刺激,无叠加。
MEP 报警阳性标准:当单侧或双侧下肢的MEP消失,排除麻醉、血压和仪器等非手术因素影响后重复或加大刺激强度后仍记录不到MEP,且10 min 内仍无法恢复。
1.4.2 SEP监测模式:采用针电极刺激双侧胫后神经,记录电极置于头皮Cz(中央点)处,参考电极置于Fpz(额中点),设置刺激频率4.7~5.1 Hz,刺激强度25~40 mA,持续时间0.3 ms,50~200次叠加。
SEP报警阳性标准:以手术显露前记录到的SEP信号作为监测基准,当波幅值下降50%或潜伏期延长>10%为SEP阳性。
1.4.3 DNEP 监测模式:采用针电极刺激经皮刺激颈椎、棘突或硬脊膜间接刺激脊髓,记录电极位于腘窝坐骨神经处。设置刺激频率4.7~5.1 Hz,持续时间0.5~0.7 ms,叠加100次。
DNEP 阳性标准:幅值较基线下降80%,潜伏期延长10%。
本研究采用Thuet[8]标准对术中诱发电位变化进行评价。
1.5 诱发电位阳性相关记录
记录诱发电位阳性事件发生的阶段,阳性事件发生时平均动脉压(mean arterail pressure,MAP),血红蛋白(hemoglobin,Hb)水平,神经并发症发生前与手术相关的机械性操作等。
1.6 统计学分析
采用SPSS 17.0 软件进行统计学分析,计量资料以均数±标准差表示,分别统计诱发电位阳性率及不同操作阶段诱发电位阳性事件的发生率,进而分析神经并发症的发生原因。
2 结果
2.1 手术情况
36 例患者均采用无前柱支撑PVCR 手术获得满意临床矫形效果(图1),其中12例肺功能未达标患者进行了术前Halo 骨盆/Halo 重力牵引配合肺功能锻炼,牵引时间2~9 个月,平均(6.2±1.3)个月。术后侧凸Cobb 角25°~59°,平均34.8°±9.2°;术后后凸Cobb角42°~58°,平均47.5°±5.2°(表1)。36例患者均获得完整随访资料,随访时间3~60 个月,平均(32.5±8.2)个月。

图1 患者,女,19岁,特发性脊柱侧后凸畸形
表1 手术矫形情况()
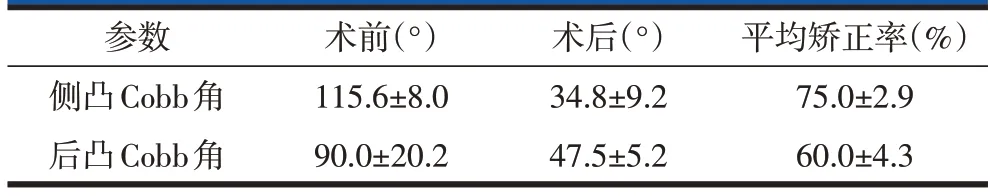
表1 手术矫形情况()
2.2 诱发电位阳性报警及原因
本组患者电生理监测数据无假阴性发生,10 例患者出现监测阳性事件(27.8%,10/36)。其中1例(1/10)发生于凹侧顶椎区置钉阶段,表现为SEP/MEP/DNEP三种模式的阳性,取出螺钉后探查椎弓根内壁破损,给予甲强龙500 mg快速静脉滴注,18 min后诱发电位信号逐渐恢复,至30 min 时诱发电位信号完全恢复,该螺钉未再次置入。7 例(7/10)发生于截骨阶段,其中4例(4/7)表现为单一MEP持续阳性,在排除系统因素及升高血压后MEP 信号未能恢复,血气分析提示Hb 均在100 g/L 以上,唤醒试验4例均可见双下肢运动,根据评价标准判断为假阳性;3 例(3/7)也表现为SEP/MEP/DNEP 三种模式的阳性,其中2例(2/3)表现为MAP 过低,Hb 低于80 g/L,给予输血并升高MAP 后1 例(1/2)诱发电位信号恢复,1 例(1/2)诱发电位信号无变化,进行唤醒试验双下肢可见部分肌肉收缩,1 例(1/3)在骨刀截骨过程中,经处理后信号无恢复,唤醒试验双下肢未见运动,考虑为骨刀震荡及机械性刺激损伤。1 例(1/10)发生于矫形阶段,表现为SEP/MEP/DNEP 三种模式的阳性,阳性与原位折弯矫形动作明确相关,在放松矫形后,15 min信号恢复。1 例(1/10)发生于矫形后,表现为SEP/MEP/DNEP三种模式的阳性,经探查截骨区脊髓腹侧存在残余骨组织压迫,去除骨赘压迫后30 min 诱发电位信号恢复(表2)。
2.3 阳性监测事件的随访结果
本组患者进行系统排查并采取相关处理措施后确定真阳性6 例(60%,6/10)、假阳性4 例(40%,4/10)。真阳性中4 例(4/6)术后未出现神经症状,2 例(2/6)术中唤醒试验阳性。其中1例(1/2)在随访期间表现为持久性神经功能障碍,双下肢运动、感觉完全丧失,仅保留S4、S5 区域感觉功能(ASIA B 级),末次随访时神经功能障碍较术后即刻无改善;另1 例(1/2)出现术后短暂性神经功能障碍,术后髂腰肌、胫前肌、股四头、踇背伸肌肌力下降至3级以下,并出现股前及胫前区域感觉减退(ASIA C级),术后9个月时神经功能障碍完全恢复(ASIA E级)。
3 讨论
3.1 无前柱支撑PVCR 术中诱发电位监测阳性事件发生率及原因
1922年MacLennan[9]首次报道前后路联合全椎体切除(vertebral column resection,VCR),在之后的50年中这一术式仅被应用于先天性半椎体的切除,直至1987 年Bradford[10]首次将该术式应用于复杂脊柱畸形。2002 年Suk[11]报道单一后路VCR 应用于侧后凸畸形截骨矫形后,PVCR在全球范围内得到广泛应用。PVCR对于复杂脊柱畸形具有极高的矫形能力,同时也具有技术难度大、手术时间长、出血多、并发症多的特点,尤其是其较高的神经并发症发生率,让很多脊柱外科医师望而却步。
文献报道约25%的PVCR 手术会出现诱发电位阳性事件,而永久性神经损伤的发生率在2%~6%之间。2002 年SUK[11]报道其70 例PVCR 患者术后短暂性神经并发症的发生率为6%,永久性神经并发症发生率为3%,其认为神经并发症发生的主要原因为术前畸形对脊髓的影响极大降低了其对手术操作的耐受力。2010年Lenke[12]报道43例脊柱畸形PVCR术中7 例出现诱发电位真阳性事件,其中5 例源于截骨后闭合所产生的矢状面错位,2例由于截骨阶段血压过低,在放松矫形和调整血压后诱发电位信号均恢复,术后所有患者均无神经症状出现。2012 年Kim[13]报道152 例PVCR 术后短暂性神经功能障碍发生率为13.8%,永久性神经损伤发生率为3.3%。2015 年Pa⁃padopoulos[14]报道45例PVCR术中10例出现诱发电位真阳性事件,主要原因为血压过低,截骨闭合错位及机械性刺激,其中2 例表现为术后永久性神经损害(ASIA E级),1例表现为术后短暂性神经损害,术后6个月内恢复。本组36例患者中出现电生理真阳性事件6例(16.7%),其中永久性神经并发症发生率2.8%(1例),短暂性神经功能障碍发生率2.8%(1例),低于文献报道结果。进一步分析诱发电位发生阳性的阶段及具体原因,其中70%神经电生理阳性事件发生于截骨阶段(7 例),其中4 例为假阳性,3 例为真阳性,主要原因为截骨阶段的MAP(<70 mmHg)和Hb(<80 g/L)过低(2例)及机械性刺激所致(1例,骨刀震荡及机械性刺激);置钉阶段(椎弓根内壁破损)、矫形阶段(矫形时截骨端错位)、矫形后阶段(矫形后脊髓腹侧骨赘压迫)各有1例出现神经电生理阳性。这一结果与文献报道稍有不同,本组的阳性事件更多发生在截骨阶段而非矫形阶段。主要原因可能是截骨操作过程中大量出血所造成的MAP、Hb下降,以及器械操作,因此,截骨过程中应保持血流动力学的稳定(建议MAP>85 mmHg,Hb>100 g/L),推荐使用超声骨刀完成截骨操作。另外,本组采用脊髓功能分型法推荐的手术方法,对I 型患者采用的无前柱支撑PVCR 技术可以实现截骨面bone-on-bone 闭合。这一术式有效避免了放置前柱支撑过程所产生附加操作和损伤以及截骨面无法闭合所产生的矢状面错位,这是本组病例电生理阳性事件在矫形阶段发生率较低的关键原因[6]。另外,我们建议截骨完成后应彻底探查脊髓腹侧有无残余骨赘存在,以避免矫形后骨赘对脊髓的持续压迫。
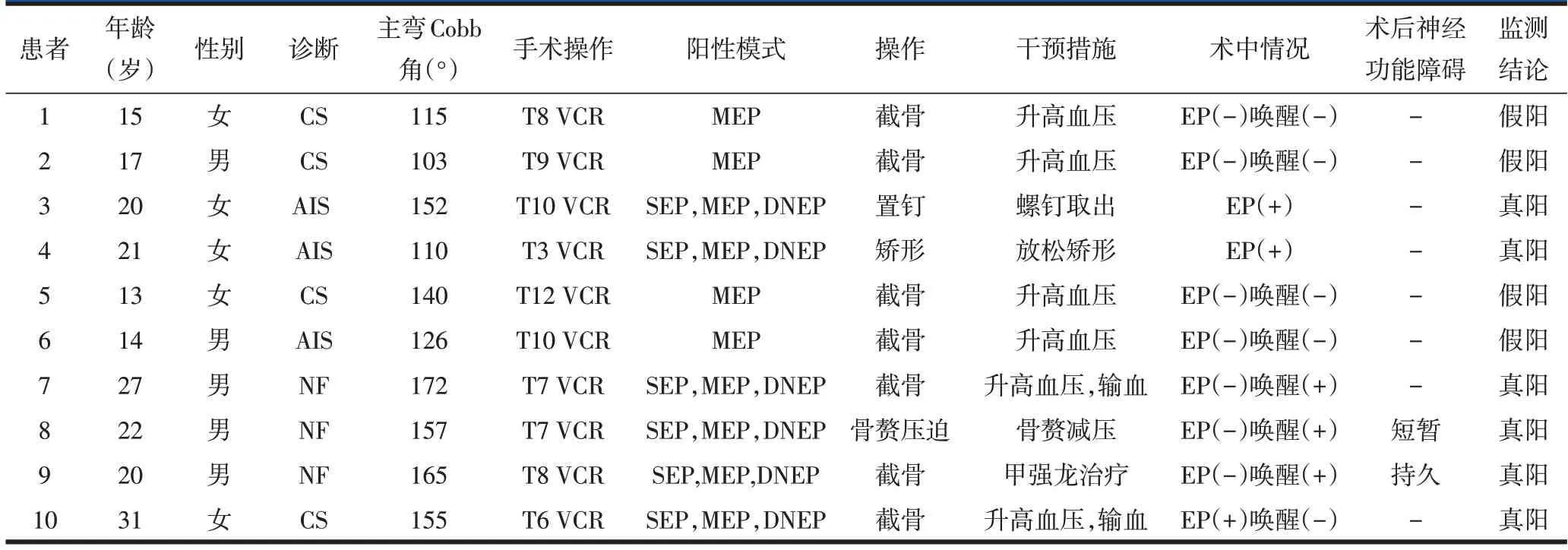
表2 10例脊柱畸形矫形手术中发生阳性监测事件患者的一般资料
除了术中多模式的诱发电位监测和规范的手术操作外,术前充分评估和认识术后神经并发症发生的危险因素具有重要意义。解京明等[15]报道PVCR治疗76例重度脊柱侧后凸畸形,6例出现术后短暂神经功能障碍,其认为术前即存在神经组织畸形或神经损害表现是术后发生神经并发症的首要危险因素。Kim[13]通过多元回归分析认为术前即存在神经功能障碍、截骨超过2个椎体是术后神经并发症发生的主要危险因素。Lee 等[16]研究发现后凸平均成角率(sagittal-deformity angular ratio,S-DAR)是神经并发症发生的危险因素,S-DAR>16.4 的患者更容易出现神经并发症,这一结论与本课题组之前的另一项研究结果相似。本组选取的病例均为脊髓功能I 型脊柱侧后凸畸形患者,术前MRI、神经查体及诱发电位检查均无异常,因而有效规避了文献研究所报道的神经并发症高危因素。另外,对于S-DAR 较大的患者,截骨区域往往为后凸顶椎区域,此处脊髓组织相对脆弱,因而在PVCR 操作时,我们建议密集地进行诱发电位监测,维持血流动力学稳定,并做适度矫形。严格选择入组患者并规范手术操作是本组患者永久性神经并发症发生率(2.8%)低于文献报道的主要原因。
3.2 诱发电位阳性事件发生时的操作流程
诱发电位作为电生理信号受到多种因素的干扰,如MEP对吸入麻醉敏感、容易受血压等多种因素干扰而假阳性率高,这一现象尤其容易发生在截骨阶段,SEP仅对感觉通路具有监测作用而容易遗漏运动通路的损伤且易受镇静剂干扰[17-19]。Kundnani[20]报告2 例MEP 监测阳性患者,术中SEP 监测持续为阴性,排除手术操作的原因并结合SEP 监测结果,判断为MEP 假阳性,患者术后未发生神经功能损伤。本组患者出现术中MEP假阳性事件4例,占所有诱发电位MEP 阳性事件40%(4/10)。不难看出术中诱发电位阳性事件发生时的应对措施至关重要。结合文献报道与我们自身经验,推荐诱发电位阳性事件发生时采用以下操作流程。①排除系统因素及麻醉(肌松药物)影响;②维持MAP>80 mmHg 保证脊髓灌注压,同时行血气分析明确Hb值(应不低于85 mmHg),必要时输血[21,22];③如血压在正常范围或调整血压后电生理信号无恢复,需确认报警前所进行的手术操作(螺钉误置、截骨端缩短、器械矫形等)并逆转,重新评估电生理信号,必要时行激素冲击[23,24];④如脊髓已显露,需确认骨赘压迫的存在。以上处理后电生理信号如无恢复,则采用唤醒试验确定是否存在脊髓损伤发生。另外,我们认为PVCR手术必须使用多种诱发电位联合监测模式。
综上所述,无前柱支撑PVCR 是治疗脊髓功能I型重度僵硬性脊柱侧后凸畸形的有效方式,本组患者神经并发症发生率为5.6%,永久性神经并发症发生率2.8%,均低于既往文献报道。其中70%神经电生理阳性事件发生于截骨阶段,主要原因为MAP 过低、血流动力学不稳、Hb过低及机械性刺激。多模式诱发电位监测在无前柱支撑PVCR 矫形手术中可有效降低术后神经系统并发症的发生。

