新型争论贪噬菌Variovorax paradoxus S110的细胞色素P450酶的异源表达及催化特性分析
李晨星,侯晓冬,郭保党,饶义剑
·合成生物技术·
新型争论贪噬菌S110的细胞色素P450酶的异源表达及催化特性分析
李晨星,侯晓冬,郭保党,饶义剑
江南大学 生物工程学院 糖化学与生物技术教育部重点实验室,江苏 无锡 214122
细胞色素P450单加氧酶 (Cytochrome P450 monooxygenases) 是一种广谱催化剂,可以催化多种类型反应而参与生物体外源物质代谢与天然产物的合成。为丰富P450作为合成生物学的酶元件库,并探索新型催化反应,利用生物信息学手段从争论贪噬菌S110中挖掘出一种新型电子自供体细胞色素P450MO单加氧酶,属于CYP116B家族,它可以在大肠杆菌异源可溶表达。酶学性质研究表明P450MO最适pH和最适温度分别为8.0和45 ℃,并且在温度低于35 ℃时具有良好的稳定性,m值为0.458 mmol/L,cat为2.438 min–1;重要的是重组P450MO可以催化一系列包含污染物的含甲氧基底物进行脱甲基反应,其中对4-甲氧基苯乙酮的脱甲基反应转化率高达91%。相比于其他CYP116B家族的P450酶,P450MO表现出较强的酶活性,这为后期进一步研究P450MO提供了基础。
P450单加氧酶P450MO,争论贪噬菌,一氧化碳示差法,酶学性质,脱甲基反应
合成生物学的基础是对各种生物元件进行人工设计并经过有序组装,以实现复杂的、新的生物功能,从而建立药物、功能材料或能源替代品等的绿色生物制造;而其中催化元件,即功能酶分子的挖掘和应用是合成生物学研究的核心[1]。细胞色素P450单加氧酶 (Cytochrome P450 monooxygenases,EC: 1.14.14.1) 是一类广泛存在于自然界中的含有亚铁血红素-硫醇盐 (Heme-thiolate) 的超家族氧化酶[2-3]。它可在温和条件下,立体选择性地催化各种类型的化学反应,如C-H羟基化、烯烃环氧化和-脱烷基化等[4-5],而参与生物体一系列初级和次级代谢产物的生物合成,如类固醇、萜类、生物碱、类黄酮等[6],因此,P450酶已成为一类重要的合成生物学催化元件,并用于一系列的绿色生物催化有机合成反应[7-9]。并且由于P450酶的氧化功能较化学氧化反应而言优势明显[10],因而被广泛应用于药物、维生素、杀虫剂、香料等产品的生产[11];特别是能在抗癌药物紫杉醇合成过程中起重要作用[12]。此外,P450酶也可以参与外源性难降解有机物的生物氧化,在环境污染物的降解和生态修复等方面也发挥着重要的作用[13-14]。
基于电子传递系统的不同,P450酶在传统上可以分为2大类[15-16]:ClassⅠ为利用铁硫簇 (Fe2S2) 的铁氧还蛋白 (Ferredoxin,Fdx) 与FAD的铁氧还蛋白还原酶 (Ferredoxin reductase,FdR) 进行分子间电子传递;ClassⅡ为通过含有FAD/ FMN的细胞色素P450酶还原酶 (Cytochrome P450 reductase,CPR) 进行分子间电子传递,然而它们通常是以独立的蛋白存在来催化各种化学反应。近些年来,随着P450酶元件的不断挖掘,发现P450酶分子可以与电子供体蛋白天然融合成一体,而实现分子内的电子自给自足高效传递 (Self-sufficient electron transfer systems)。比如,来自巨大芽孢杆菌的P450BM3 (CYP102A) 融合了双黄素 (FAD/FMN) 氧化还原伴侣结构域 (CPR) 和P450结构域[17-18];红球菌NCIMB9784的P450RhF(CYP116B2) 融合了Fe‒S簇铁氧还蛋白 (Fe/S) 、黄素单核苷酸 (FMN) 氧化还原伴侣结构域以及P450催化结构域[19]。由于这类P450酶分子具有高效的电子传递效率,可以实现P450酶催化反应的快速发生。因此,对于该类P450酶分子的挖掘、改造和定向进化已成为研究热点。
前期的研究发现争论贪噬菌可以有效地降解环境中的蒽、对酞酸二甲酯等污染物,且发现在对酞酸二甲酯的降解过程中发生脱甲基反应[20]。由于细胞色素P450酶清除环境污染物的主要功能之一为脱甲基[21],因而推测的此功能与其体内所含有的P450酶相关。为此,本研究从基因库中检索了一个来源于S110的细胞色素P450单加氧酶基因[22],经过系统命名属于CYP116家族,CYP116B256V2,简称为P450MO,之后经密码子优化后实现在大肠杆菌BL21中异源表达。重组P450MO经过纯化后,以4-甲氧基苯乙酮为模式底物测定其酶学性质,同时对其他多种含甲氧基底物进行底物谱拓展分析(图1),发现其对这些底物均有较高的酶催化 活性。
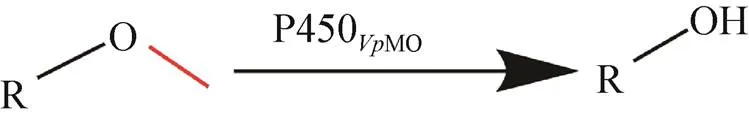
图1 P450VpMO脱甲基反应方程式
1 材料与方法
1.1 菌株、质粒和培养基
大肠杆菌TOP10和BL21 (DE3) 由本实验室保存,分别用于质粒抽提和蛋白表达;载体pET-21b由本实验室保存,用于重组质粒的构建。LB培养基:10 g/L胰蛋白胨,5 g/L酵母提取物,10 g/L氯化钠;2×YT培养基:16 g/L胰蛋白胨,10 g/L酵母提取物,5 g/L氯化钠。
1.2 主要试剂及仪器
异丙基-β-D-硫代吡喃半乳糖苷 (IPTG)、5-氨基乙酰丙酸 (ALA) 和质粒提取试剂盒购自生工生物工程 (上海) 股份有限公司;标准分子量蛋白购自大连TaKaRa公司;葡萄糖脱氢酶(GDH)由本实验室制备保存;4-甲氧基苯乙酮 (1)、6-甲氧基喹啉 (2)、7-甲氧基香豆素 (3)、4-甲氧基苯甲腈 (4)、6-甲氧基-1-萘满酮 (5)、2¢-羟基-4¢-甲氧基苯乙酮 (6)、7-甲氧基-1-萘满酮(7) 和4-甲氧基二苯甲酮 (8)、甲氧苄啶(9)购置于萨恩化学技术有限公司。
ÄKTA pure蛋白纯化仪购自美国GE公司;安捷伦1260高效液相色谱 (HPLC) 购自美国安捷伦公司。
1.3 P450VpMO基因的克隆
在UniProt上检索并获得来源于S110细胞色素P450家族的氨基酸序列 (UniProt: C5CTM5) 及基因序列 (GenEMBL: ACS20213或GenBank: WP_012748691)。基于密码子偏好性对基因序列优化,并在5′端加入6×His-tag核酸序列用于后期的纯化,之后由天霖生物科技 (上海) 有限公司合成,并连接至pET-21b表达载体上获得重组质粒pET-21b-P450,导入至Top10 感受态中,提取质粒进行DNA测序验证。正确的pET-21b-P450转化至BL21表达菌株中得到重组菌/P450。
1.4 重组P450VpMO在E. coli中的表达与纯化
挑取重组菌/P450转接到含 100 μg/mL的氨苄青霉素的LB培养基中于37 ℃、200 r/min振荡培养10 h,以2% (/) 接种量转接至500 mL的2×YT培养基中,37 ℃、200 r/min下培养至600在0.8–1.0时加入终浓度均为 0.2 mmol/L的IPTG和ALA (其中IPTG为诱导剂,ALA为P450辅酶因子血红素前体物质5-氨基乙酰丙酸(5-aminolevulinic acid)) 于16 ℃诱导培养16 h后,离心收集菌体[23]。湿菌体用缓冲液 (50 mmol/L Tris-HCl,500 mmol/L NaCl, 10 mmol/L咪唑,10%甘油,pH 8.0) 重悬制备 100 mg/mL菌悬液。高压匀浆机破碎细胞后于4 ℃、40 000×离心30 min,收集上清液。上清液采用镍柱进行纯化,用含100 mmol/L咪唑缓冲液 (pH 8) 对目的蛋白洗脱收集;用脱盐柱 (HistrpTM5 mL Desalting) 脱盐,脱盐缓冲液 (25 mmol/L Tris-HCl,150 mmol/L NaCl,10%甘油),脱盐后超滤浓缩至10 mg/mL,−80 ℃保存。
1.5 重组P450VpMO的光谱特性分析
采用一氧化碳示差法对重组P450MO进行光谱鉴定[24-25]。首先,在玻璃比色皿中加入150 μL 10 mg/mL P450MO纯酶液和2.85 mL磷酸钾缓冲液 (100 mmol/L,pH 8.0,含1 mmol/L EDTA,20%甘油和1 μg/mL藏红T) 混合均匀,采用紫外可见型分光光度计 (日立U-3900) 在400–500 nm的波长范围内扫描。然后,在玻璃比色皿中加入适量连二亚硫酸钠将氧化态P450MO还原后,在400–500 nm的波长范围内扫描。最后,通入一氧化碳30 s使得一氧化碳与还原态P450MO充分结合后,在400–500 nm的波长范围内扫描,观察3种状态P450MO特征吸光值的变化。以磷酸钾缓冲液作为空白对照。
1.6 重组P450VpMO的酶活力测定方法
以4-甲氧基苯乙酮为模式底物,测定重组P450MO的酶活力。构建200 μL Tris-HCl (50 mmol/L,pH 8.0) 反应体系:2 mmol/L底物、5 mmol/L葡萄糖、0.5 mmol/L辅酶NADP+、 0.24 mg/mL GDH和1.3 mg/mL的P450MO纯酶,于30 ℃下反应10 min后,加入等体积甲醇终止反应,样品使用HPLC检测。酶活力单位 (U) 定义为每分钟生成1 μmol 的产物所需的酶量。
HPLC检测条件:色谱柱为XDB-C18柱 (4.6 mm×250 mm,5 μm);柱温为30 ℃;检测波长为280 nm,流动相为甲醇 (A) 和水 (B),梯度洗脱程序为:0–20 min由20% A线性变化至100% A。4-甲氧基苯乙酮及其产物的出峰时间分别为13.3 min和9.4 min。
1.7 重组P450VpMO的酶学性质分析
1.7.1 pH与温度对重组P450MO酶活力的影响
配制不同pH缓冲液 (50 mmol/L醋酸-醋酸钠 pH 5.5–6.0;磷酸二氢钠-磷酸氢二钠pH 6.0–7.5;Tris-HCl pH 7.5–9.0)。按照方法1.6,测定P450MO在不同pH条件下的酶活力。在最适pH下,按方法1.6测定P450MO在不同温度下 (20–55 ℃) 的酶活力。最适反应pH和温度分别定义为最高酶活力 (以相对酶活力100%计) 所对应的pH值和温度。
1.7.2 重组P450MO的温度稳定性
将P450MO酶液分别置于20–45 ℃条件下孵育1 h后于冰上冷却,按照方法1.6测定P450MO的残余酶活力。将P450MO分别置于35 ℃、40 ℃和45 ℃温度下孵育不同时间,按照方法1.6测定P450MO的残余酶活力。半衰期1/2指在不同温度下处理后残余酶活力为50%时所对应的时间。以未经处理的酶液作为对照。
1.7.3 重组P450MO的动力学参数测定
以不同浓度 (0.2–3.0 mmol/L) 的4-甲氧基苯乙酮作为底物,按方法1.6测定P450MO的初始反应速率,利用GraphPad Prism8 按米氏方程进行非线性拟合,计算P450MO的动力学参数m与max值。
1.8 重组P450VpMO的底物谱分析
选定8种含甲基底物进行P450MO底物谱分析。构建200 μL Tris-HCl (50 mmol/L,pH 8.0) 反应体系:0.5 mmol/L 底物,5 mmol/L葡萄糖, 0.5 mmol/L NADP+,0.24 mg/mL GDH和 1.3 mg/mL P450MO纯酶,于30 ℃条件下反应3.5 h,加入等体积甲醇终止反应,样品采用HPLC检测。
HPLC检测条件:底物1–8除检测波长(1:280 nm,2:232 nm,3:232 nm,4:254 nm,5:280 nm,6:280 nm,7:254 nm,8:280 nm)差异外,其他工作条件为通用条件;色谱柱为XDB-C18柱 (4.6 mm×250 mm,5 μm);柱温为30 ℃;流动相为甲醇 (A) 和水 (B);梯度洗脱程序为:0–20 min由20% A线性变化至100% A。底物9的液相检测条件为:色谱柱为XDB-C18 柱 (4.6 mm×250 mm,5 μm);柱温为30 ℃;流动相为0.1%磷酸水和0.1%磷酸-乙腈溶液;等度洗脱程序为:88%的0.1%磷酸-乙腈溶液与12%的0.1%磷酸水溶液等度洗脱15 min;检测波长为240 nm。
2 结果与分析
2.1 重组P450VpMO的一级结构分析
P450MO的一级结构分析表明,该酶含782个氨基酸 (aa),由P450催化结构域 (15–439 aa)、黄素单核苷酸 (FMN) 还原酶结构域 (475–682 aa) 和Fe‒S簇铁氧还蛋白结构域 (698–781 aa) 组成。根据电子传递分类规则,表明P450MO为电子自供体类型的P450s[26]。将P450MO氨基酸序列提交细胞色素P450国际命名委员会(http://drnelson.uthsc.edu/CytochromeP450.html),被命名为CYP116B256V2,进一步采用MEGA5.0构建已报道15种CYP116B亚家族P450s的系统发育进化树 (图2),结果显示P450MO与其他15种P450s相似度为51.2%–75.2%,为一种新型CYP116B亚家族P450s成员,其性质和功能值得进一步探索。
2.2 重组P450VpMO的表达与纯化
重组菌/P450经IPTG诱导P450MO表达,SDS-PAGE结果如图3A所示,与/P450未诱导全细胞相比比较,/P450破碎上清液和Ni柱纯化后重组P450MO中均在87 kDa处有明显的条带,其表观分子量与理论分子量符合;此外,纯化的该酶样品与其他类型酶如葡萄糖脱氢酶GDH相比呈现出P450酶分子特有的结合血红素带来的浅红 色(图3B),表明P450MO在中实现了可溶表达。
2.3 重组P450VpMO的光谱特性分析
由于细胞色素P450单加氧酶都具有特定的光谱学特征[24]。首先应用一氧化碳示差法来测定重组P450MO是否有相关特性。经过测定,当使用纯化后重组P450MO直接进行光谱特性分析时,重组P450MO在420 nm处有特定的吸收波长如图4A,然后用连二亚硫酸钠将其还原后其特征峰如图4B所示,最后通入一氧化碳,其吸收 波长会偏移至450 nm处 (图4C)。这一特殊的 光谱特性,进一步证实该酶为细胞色素P450单加氧酶。
2.4 pH与温度对重组P450VpMO酶活力的影响
如图5A所示,当pH为8.0 时P450MO酶活力最高;当pH小于8.0时,其酶活力缓慢下降;当pH大于8.5时其活力快速下降;pH为5.5和9.0时,仅为15%和8%的相对酶活。如图5B所示,P450MO酶活力随温度的提高而升高,当温度高于45 ℃时P450MO的酶活力迅速降低。由此确定重组P450MO最适反应pH和温度分别为8.0和45 ℃。如表1所示,P450MO酶的最适pH与CYP116B家族中P450MO的相同,而最适温度均高于CYP116B家族中的P450MO(40 ℃)[23]和P450SMO(30 ℃)[33]。
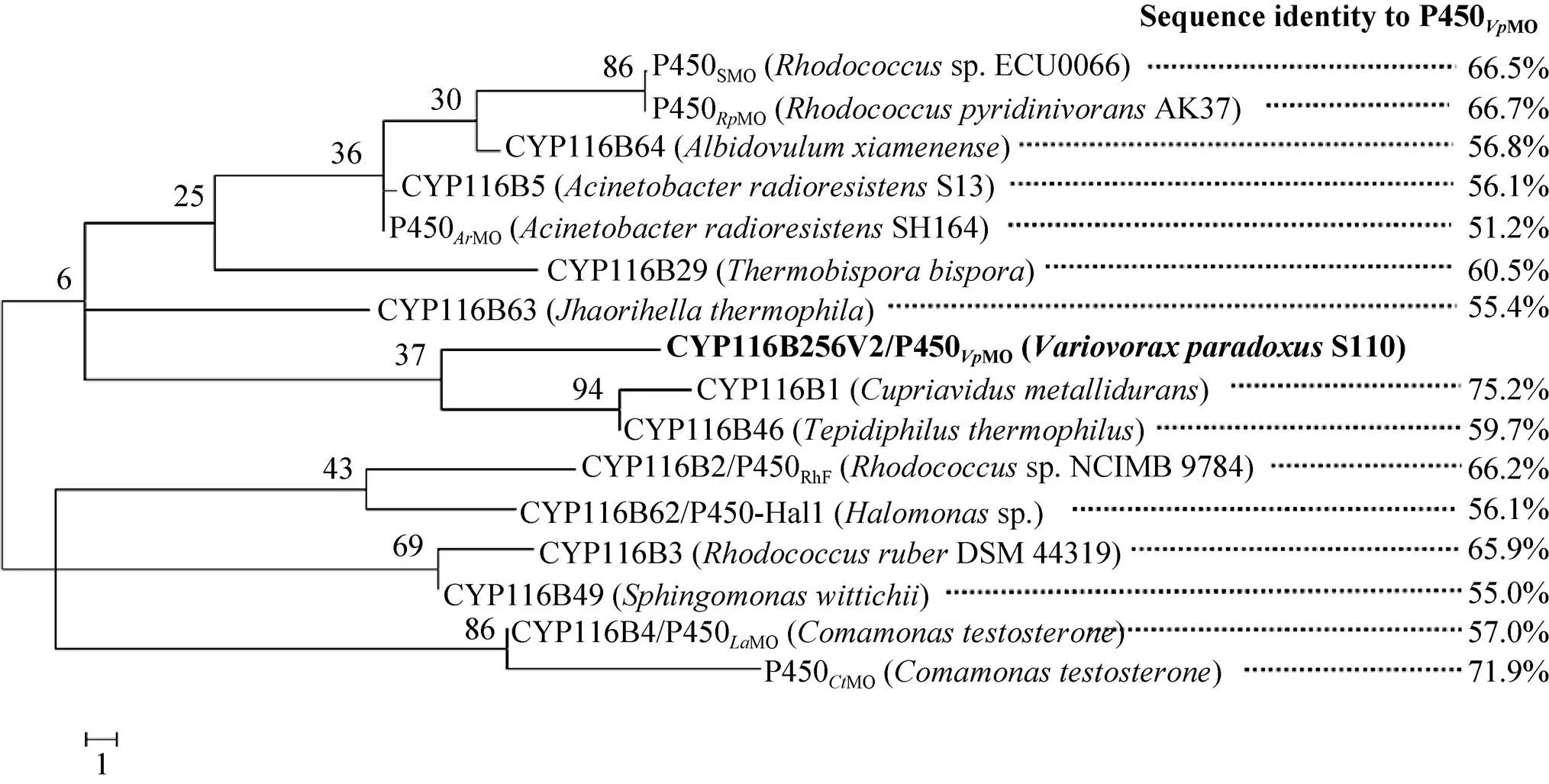
图2 已报道的CYP116B亚家族P450s与P450VpMO的系统发育进化树
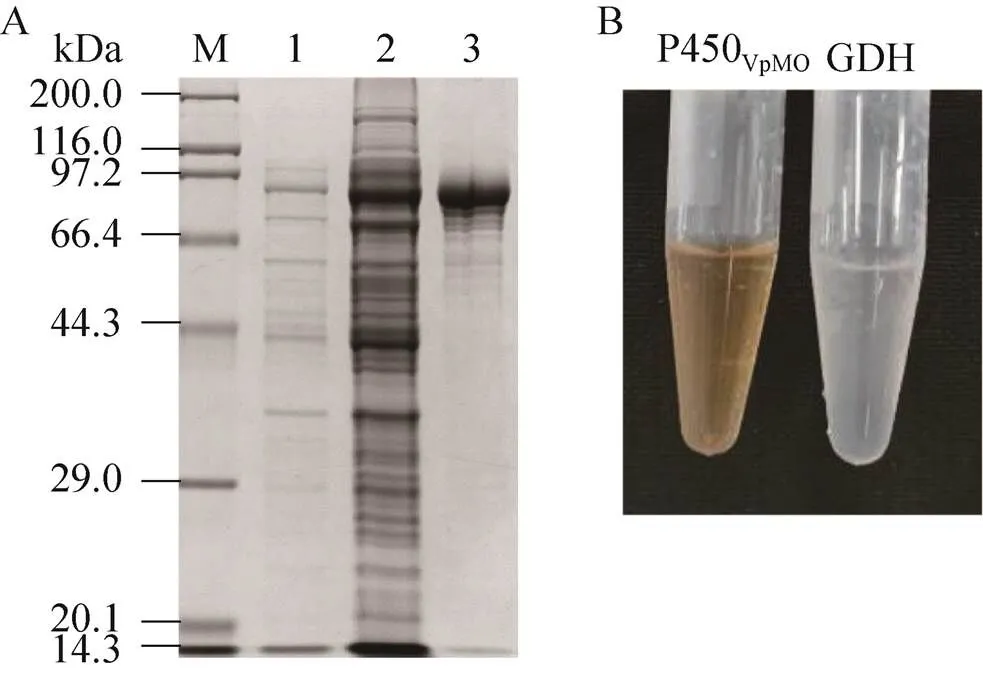
图3 重组P450VpMO表达纯化的SDS-PAGE分析以及纯化后P450VpMO与GDH颜色对比图
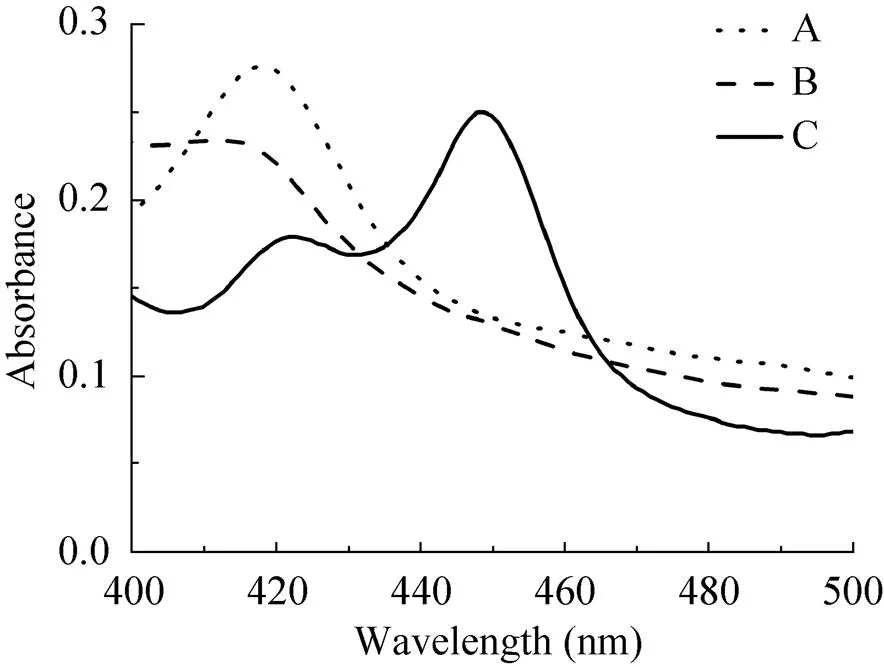
图4 重组P450VpMO的吸收光谱图
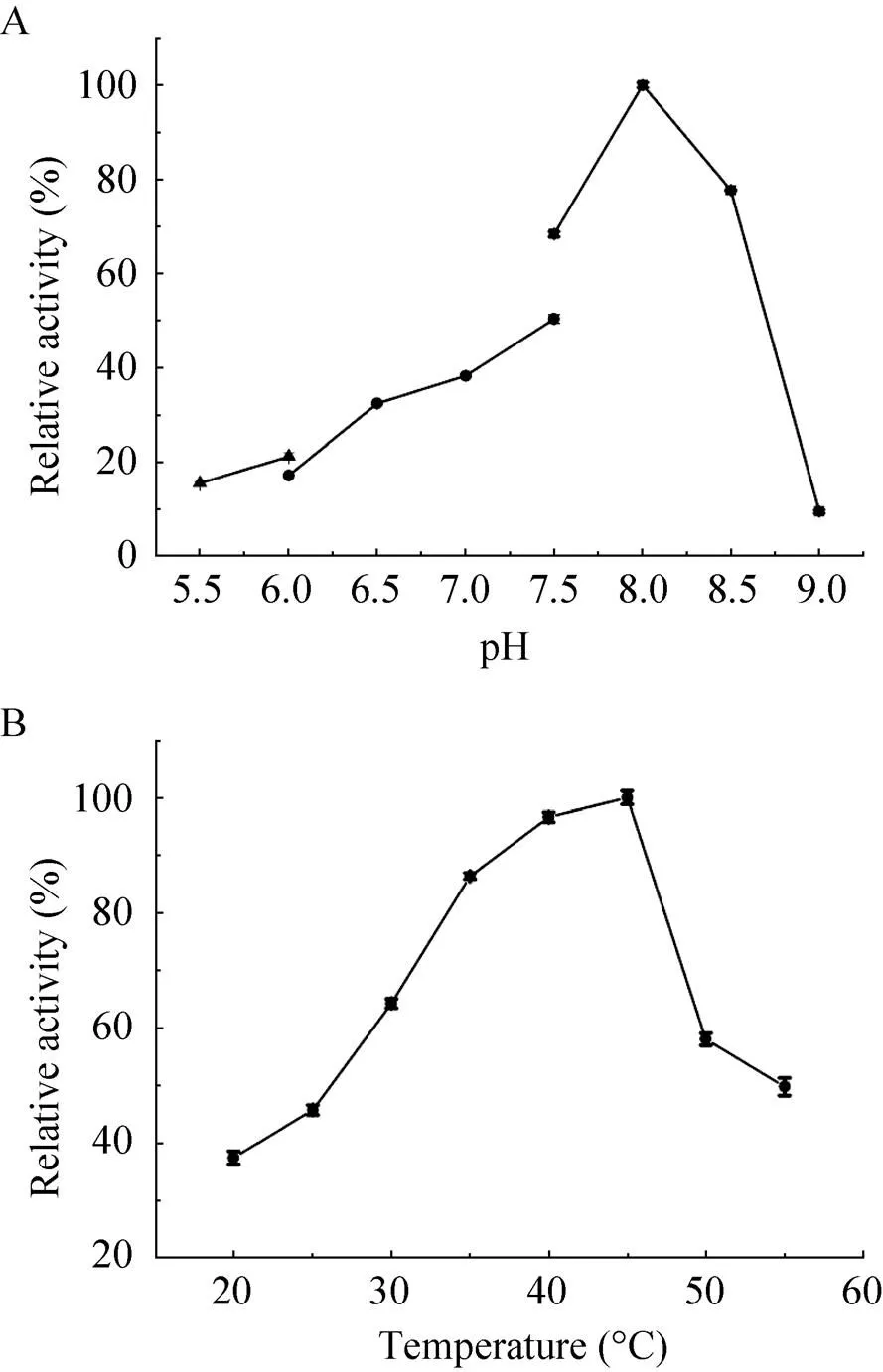
图5 pH (A)和温度 (B) 对重组P450VpMO酶活力的影响
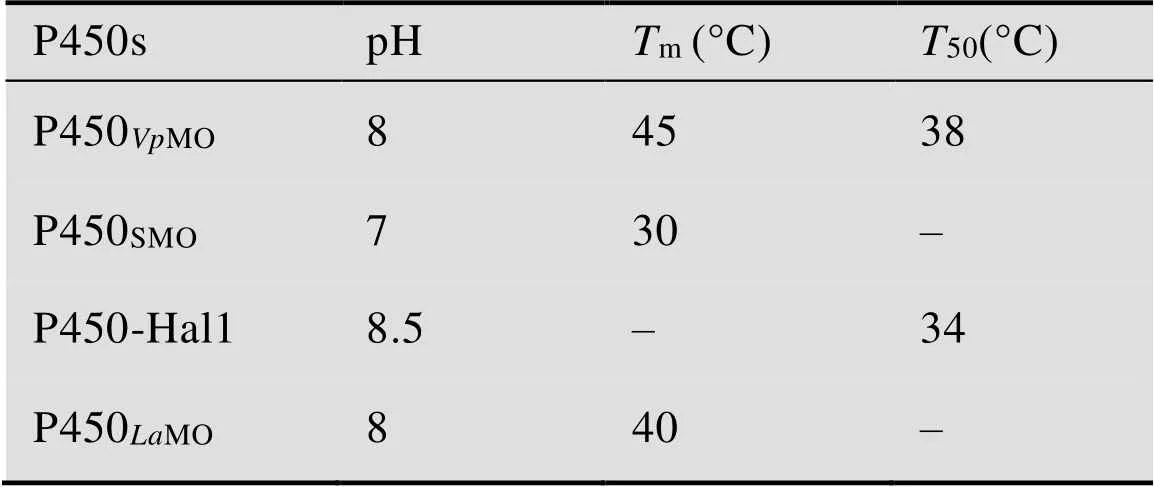
表1 CYP116B家族P450酶的酶学性质比较
“–”indicate which was not reported; pH indicates the optimal pH;mindicates the optimal temperature;50indicates the half-inactivation temperature.
2.5 温度对重组P450VpMO稳定性的影响
接下来测定重组P450MO在不同温度下孵育1 h后其残余酶活力。如图6A所示,当温度低于30 ℃时,P450MO的残余酶活力可保持80%以上;40 ℃和45 ℃孵育1 h,其残余酶活力仅为40%和0%。其半失活温度大约为38 ℃,略高于CYP116B62的半失活温度 (34 ℃)[32]。如图6B所示,重组P450MO在35 ℃、40 ℃和45 ℃条件下孵育不同时间测定残余酶活力,其半衰期1/2分别为130 min、40 min和4 min (图6B)。在低于35 ℃时,重组P450MO稳定,故选择30 ℃作为其 催化反应温度用于后续的反应测试。此外,将重组P450MO的相关酶学性质与同类酶相比较(表1),发现其最适温度和半失活温度均高于同类酶,表明该酶具有良好温度稳定性,适合后期应用 研究。
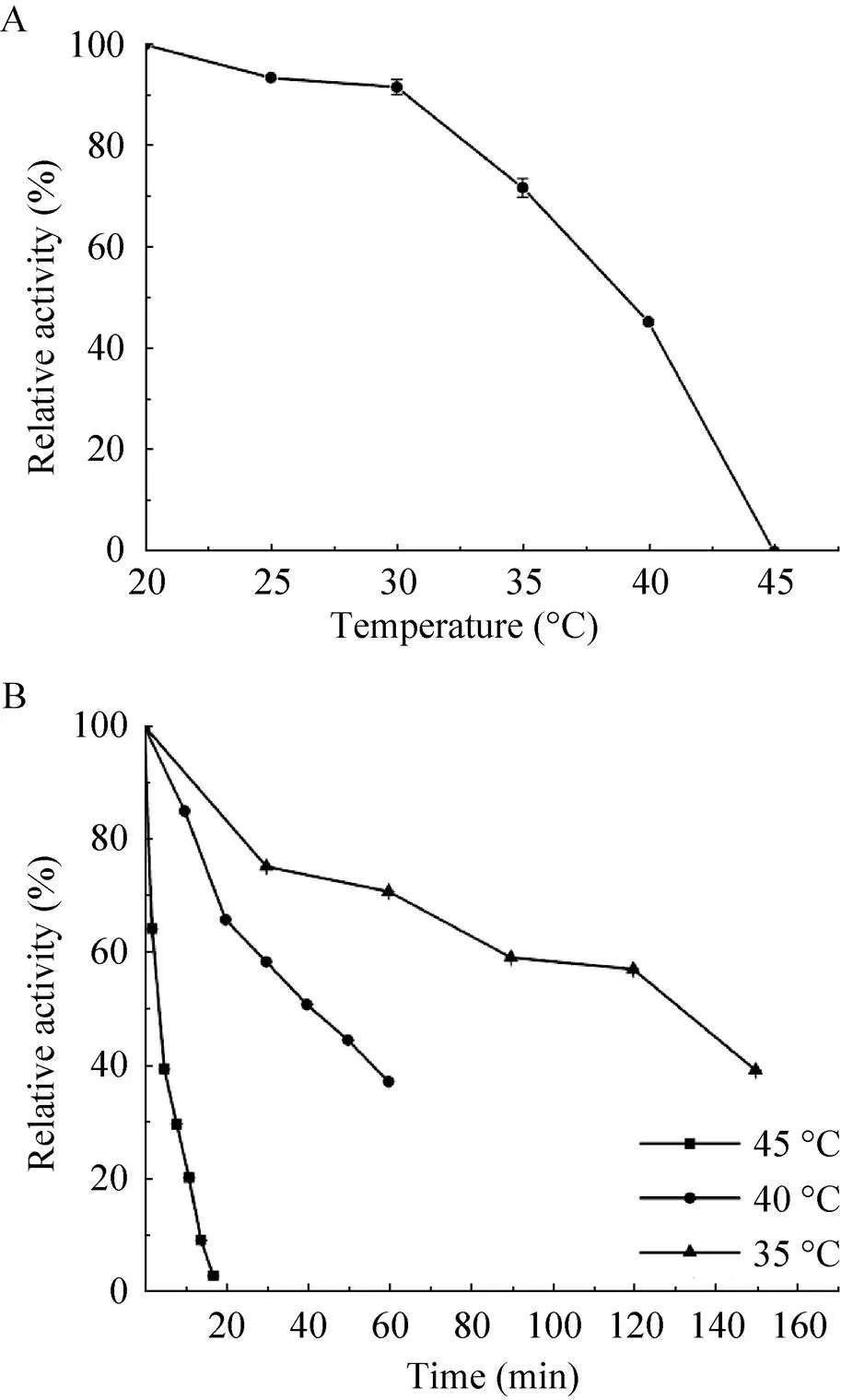
图6 温度对重组P450VpMO稳定性的影响
2.6 P450VpMO动力学参数测定
由于具备可以降解环境中含有甲氧基的污染物的能力[20],为此本实验选择以结构相对简单的4-甲氧基苯乙酮为模式底物,按照方法1.6研究和测定P450MO的动力学常数。非线性拟合的结果符合Michaelis-Menten方程 (图7),测得重组P450MO的m和max值分别为0.458 mmol/L和0.028 μmol/(mg·min),以分子量为87.072 kDa计算其cat值为2.438 min–1,催化效率cat/m为5.318 mmol/(L·min)。
2.7 重组P450VpMO的底物谱探索
最后按照方法1.8,检测重组P450MO是否也可以催化其他能够被不同CYP116B家族P450催化而脱甲基的底物,分别为4-甲氧基苯乙酮[30](1)、6-甲氧基喹啉[23](2)、7-甲氧基香豆素[32](3)、4-甲氧基苯甲腈[30](4)、6-甲氧基-1-萘满酮[21](5)、2¢-羟基-4¢-甲氧基苯乙酮[30](6)、7-甲氧基-1-萘满酮[21](7) 和4-甲氧基二苯甲酮[30](8)。结果如图8所示,重组P450MO对这些含甲氧基的底物均具有较强的脱甲基功能。相比于CYP116B家族其他P450,重组P450MO对4-甲氧基苯乙酮的转化率高于P450-TT (CY116B46,32%)[30],对7-甲氧基香豆素的转化率高于P450Hal-1 (CYP116B62,35%)[32];对4-甲氧基二苯甲酮的转化率高于P450RhF(CYP116B2,13%)[30];对2¢-羟基-4¢-甲氧基苯乙酮的转化率高于P450-AX (CYP116B64,10%)[30];对4-甲氧基苯甲腈的转化率高于P450-TB (CYP116B29,12%)[30]。由此结果显示重组P450MO在同类酶中转化效率较高,具有一定研究价值。
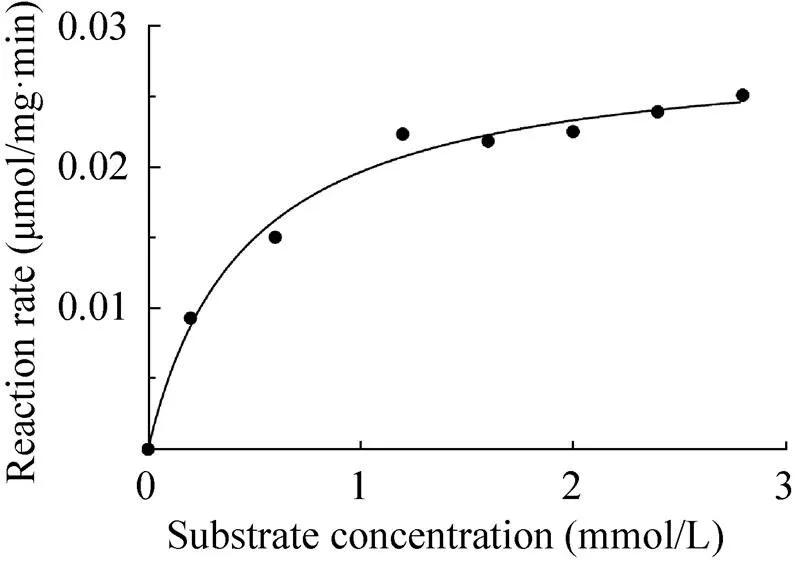
图7 重组P450VpMO的动力学参数的非线性拟合
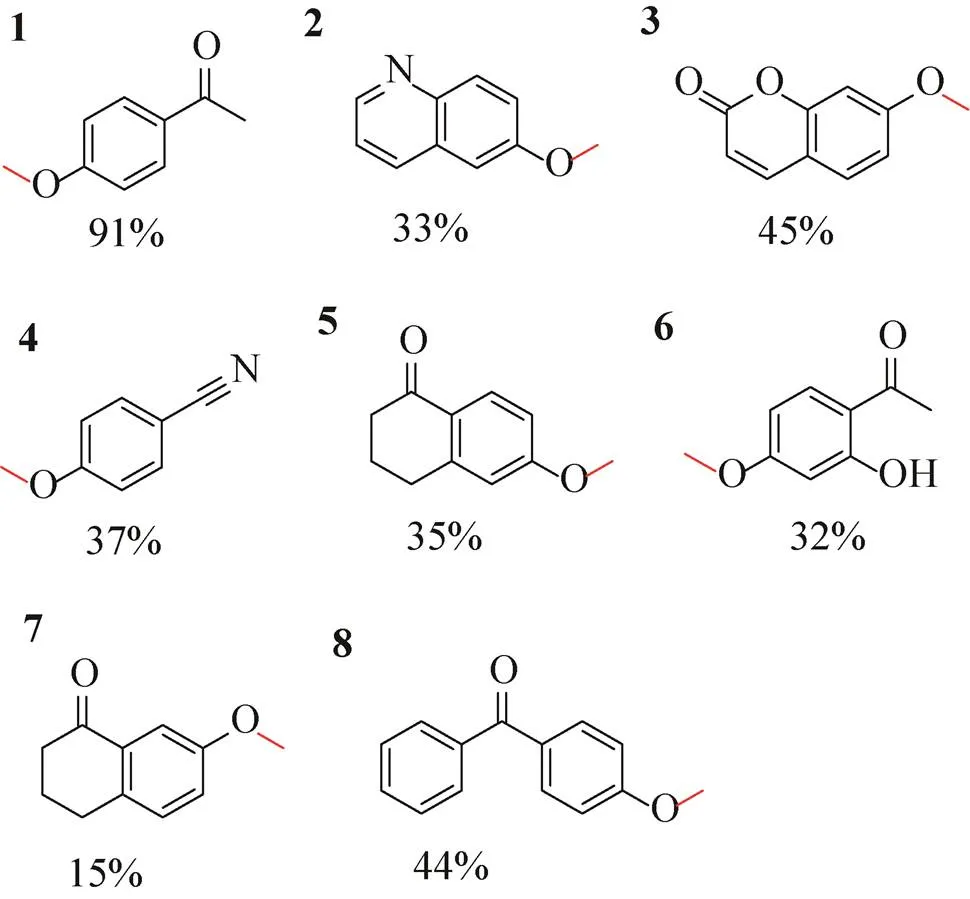
图8 重组P450VpMO对催化不同含甲氧基底物的转化率
2.8 重组P450VpMO对甲氧苄啶的降解测试
鉴于P450MO酶有较好的脱甲基功能,随后测定其能否降解含甲氧基的抗生素污染物甲氧苄啶,实验表明该酶对甲氧苄啶有一定降解作用(图9)。然而,该反应降解效率不到5%,故在后续研究中会进一步对反应条件进行优化,并利用分子生物学技术对P450MO进行定向进化来提高该酶对甲氧苄啶的降解效率。
3 结论
由于细胞色素P450单加氧酶可催化多种不同类型的化学反应而参与天然产物的生物合成,因此,它是合成生物学重要的催化元件和绿色的生物催化剂。本研究全基因合成了一种来源于争论贪噬菌S110的细胞色素P450单加氧酶基因,并成功地在大肠杆菌中可溶表达。通过一级序列和一氧化碳示差法分析表明P450MO为一种新型电子自供体类P450s,隶属于为CYP116B亚家族;并对这种新型电子自供体P450MO的酶学性质和脱甲基功能作了初步探索,发现该酶具有降解抗生素甲氧苄啶的重要作用,这为后期对该酶的定向进化改造以及拓展该类酶的应用奠定了基础。
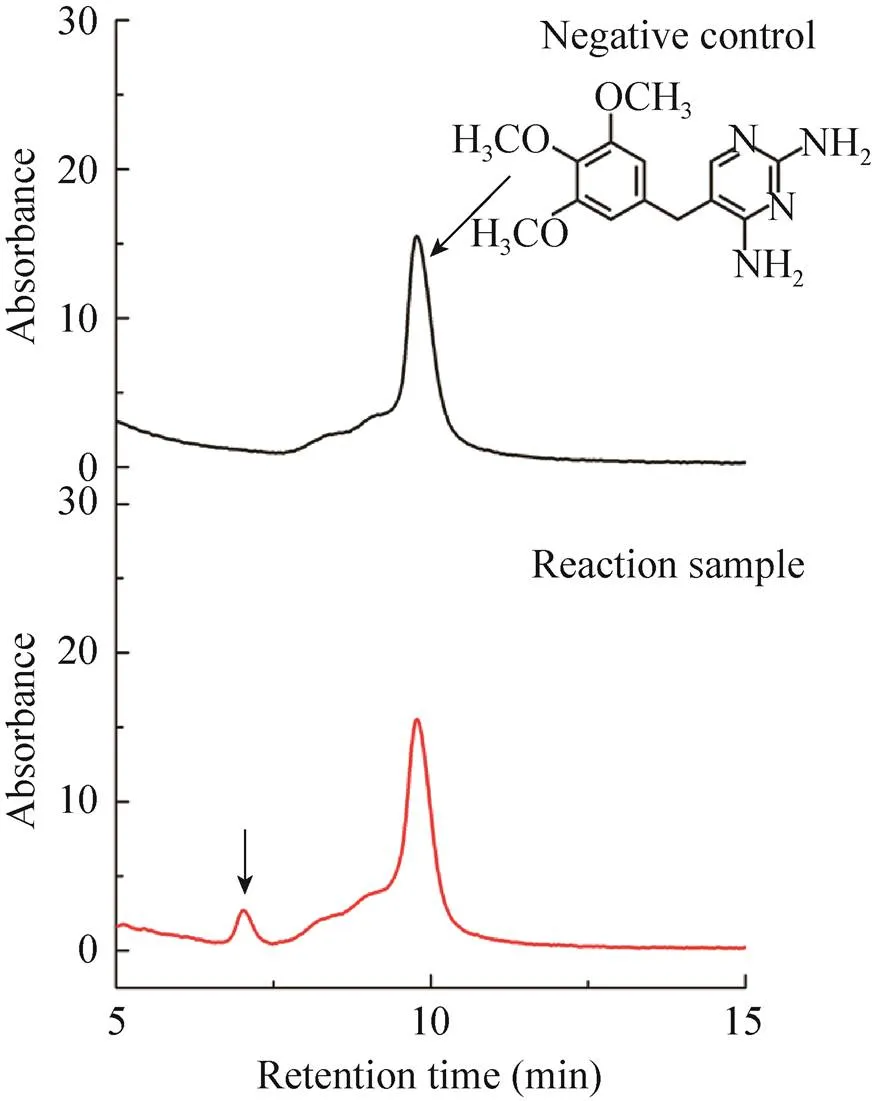
图9 P450VpMO催化甲氧苄啶的HPLC检测
[1] Girvan HM, Munro AW. Applications of microbial cytochrome P450 enzymes in biotechnology and synthetic biology. Curr Opin Chem Biol, 2016, 31: 136–145.
[2] Nelson DR. Cytochrome P450 diversity in the tree of life. Biochim Biophys Acta (BBA)–Prot Proteom, 2018, 1866(1): 141–154.
[3] Nelson DR, Koymans L, Kamataki T, et al. P450 superfamily: update on new sequences, gene mapping, accession numbers and nomenclature. Pharmacogenetics, 1996, 6(1): 1–42.
[4] Sono M, Roach MP, Coulter ED, et al. Heme- containing oxygenases. Chem Rev, 1996, 96(7): 2841–2888.
[5] Bernhardt R. Cytochromes P450 as versatile biocatalysts. J Biotechnol, 2006, 124(1): 128–145.
[6] Yin YC. Data mining and catalytic performance of a new self-sufficient monooxygenase in CYP116B family[D]. Shanghai: East China University of Science and Technology, 2014. 殷曰彩. CYP116B家族单加氧酶的基因挖掘与催化性能研究[D]. 上海: 华东理工大学, 2014.
[7] Wei YF, Ang EL, Zhao HM. Recent developments in the application of P450 based biocatalysts. Curr Opin Chem Biol, 2018, 43: 1–7.
[8] Ciaramella A, Minerdi D, Gilardi G. Catalytically self-sufficient cytochromes P450 for green production of fine chemicals. Rend Fis Acc Lincei, 2017, 28: S169–S181.
[9] Zhang XW, Li SY. Expansion of chemical space for natural products by uncommon P450 reactions. Nat Prod Rep, 2017, 34(9): 1061–1089.
[10] Jiang YY, Li SY. Catalytic function and application of cytochrome P450 enzymes in biosynthesis and organic synthesis. Chin J Org Chem, 2018, 38: 2307–2323 (in Chinese).蒋媛媛, 李盛英. 细胞色素P450酶在生物合成及有合成中的催化功能及其应用. 有机化学, 2018, 38: 2307–2323.
[11] Sakaki T. Practical application of cytochrome P450. Biol Pharm Bull, 2012, 35(6): 844–849.
[12] Jennewein S, ParK H, DeJong JM, et al. Coexpression in yeast of Taxus cytochrome P450 reductase with cytochrome P450 oxygenases involved in Taxol biosynthesis. Biotechnol Bioeng, 2005, 89(5): 588–598.
[13] Luo A, Wu YR, Xu Y, et al. Characterization of a cytochrome P450 monooxygenase capable of high molecular weight PAHs oxidization from Rhodococcus sp. P14. Proc Biochem, 2016, 51(12): 2127–2133.
[14] Jones JP, O’Hare EJ, Wong LL. Oxidation of polychlorinated benzenes by genetically engineered CYP101(cytochrome P450(cam)). Eur J Biochem, 2001, 268(5): 1460–1467.
[15] Hannemann F, Bichet A, Ewen KM, et al. Cytochrome P450 systems–biological variations of electron transport chains. Biochim Biophys Acta (BBA)–General Subj, 2007, 1770(3): 330–344.
[16] Erdogan H . One small step for cytochrome P450 in its catalytic cycle, one giant leap for enzymology. J Porphyrins Phthalocyanines, 2019, 23: 1-9.
[17] Narhi LO, Fulco AJ. Characterization of a catalytically self-sufficient 119 000-dalton cytochrome P-450 monooxygenase induced by barbiturates in. J Biol Chem, 1986, 261(16): 7160–7169.
[18] Sevrioukova IF, Li H, Zhang H, et al. Structure of a cytochrome P450-redox partner electron-transfer complex. PNAS, 1999, 96(5): 1863–1868.
[19] Roberts GA, Çelik A, Hunter DJB, et al. A self-sufficient cytochrome P450 with a primary sructural organization that includes a flavin domain and a [2Fe-2S] redox center. J Biol Chem, 2003, 278(49): 48914–48920.
[20] Satola B, Wübbeler JH, Steinbüchel A. Metabolic characteristics of the species. Appl Microbiol Biotechnol, 2013, 97(2): 541–560.
[21] Li RJ, Xu JH, Yin YC, et al. Rapid probing of the reactivity of P450 monooxygenases from the CYP116B subfamily using a substrate-based method. New J Chem, 2016, 40(10): 8928–8934.
[22] Han JI, Choi HK, Lee SW, et al. Complete genome sequence of the metabolically versatile plant growth-promoting endophyteS110. J Bacteriol, 2011, 193(5): 1183–1190.
[23] Yin YC, Yu HL, Luan ZJ, et al. Unusually broad substrate profile of self-sufficient cytochrome P450 monooxygenase CYP116B4 from. ChemBioChem, 2014, 15(16): 2443–2449.
[24] Omura T, Sato R. The carbon monoxide–binding pigment of liver microsomes. I. Evidence for its hemoprotein nature. J Biol Chem, 1964, 239: 2370–2378.
[25] Guengerich FP, Martin MV, Sohl CD, et al. Measurement of cytochrome P450 and NADPH–cytochrome P450 reductase. Nat Protoc, 2009, 4(9): 1245–1251.
[26] Li RJ, Zhang Y, Xu JH, et al. Discovery, characterization and molecular engineering of CYP116B monooxygenase. Chin J Bioprocess Eng, 2019, 17(1): 29–35 (in Chinese). 李仁结, 张龑, 许建和, 等. CYP116B家族单加氧酶的发现、表征及分子改造研究进展. 生物加工过程, 2019, 17(1): 29–35.
[27] Warman AJ, Robinson JW, Luciakova D, et al. Characterization ofCYP116B1–A thiocarbamate herbicide oxygenating P450–phthalate dioxygenase reductase fusion protein. FFBS J, 2012, 279(9): 1675–1693.
[28] Liu L, Schmid RD, Urlacher VB. Engineering cytochrome P450 monooxygenase CYP 116B3 for high dealkylation activity. Biotechnol Lett, 2010, 32(6): 841–845.
[29] Minerdi D, Sadeghi SJ, Di Nardo G, et al. CYP116B5: a new class VII catalytically self-sufficient cytochrome P450 from Acinetobacter radioresistens that enables growth on alkanes. Mol Microbiol, 2015, 95(3): 539–554.
[30] Tavanti M, Porter JL, Sabatini S, et al. Panel of new thermostable CYP116B self-sufficient cytochrome P450 monooxygenases that catalyze C-H activation with a diverse substrate scope. ChemCatChem, 2018, 10(5): 1042–1051.
[31] Tavanti M, Porter JL, Levy CW, et al. The crystal structure of P450-TT heme-domain provides the first structural insights into the versatile class VII P450s. Biochem Biophys Res Commun, 2018, 501(4): 846–850.
[32] Porter JL, Sabatini S, Manning J, et al. Cloning, expression and characterisation of P450-Hal1 (CYP116B62) fromsp. NCIMB 172: A self-sufficient P450 with high expression and diverse substrate scope. Enzyme Microb Technol, 2018, 113: 1–8.
[33] Zhang JD, Li AT, Yang Y, et al. Sequence analysis and heterologous expression of a new cytochrome P450 monooxygenase fromsp. for asymmetric sulfoxidation. Appl Microbiol Biotechnol, 2010, 85(3): 615–624.
Expression and characterization of a novel cytochrome P450 enzyme fromS110
Chenxing Li, Xiaodong Hou, Baodang Guo, and Yijian Rao
Key Laboratory of Carbohydrate Chemistry and Biotechnology, Ministry of Education, School of Biotechnology, Jiangnan University, Wuxi 214122, Jiangsu, China
Cytochrome P450 monooxygenases as powerful biocatalysts catalyze a wide range of chemical reactions to facilitate exogenous substances metabolism and biosynthesis of natural products. In order to explore new catalytic reactions and increase the number of P450 biocatalysts used in synthetic biology, a new self-sufficient cytochrome P450 monooxygenase (P450MO), belongs to CYP116B class, was mined fromS110 genome and expressed in. Based on characterization of the enzymatic properties, it shows that the optimal pH and temperature for P450MOreaction activity are 8.0 and 45 °C, respectively. P450MOis relatively stable at temperatures below 35 °C. Themandcatof P450MOtoward 4¢-Methoxyacetophenone are 0.458 mmol/L and 2.438 min-1, respectively. Importantly, P450MOwas able to catalyze the demethylation reaction for a range of substrates containing methoxy group. Its demethylation reactivity is reasonably better than other P450s belongs to CYP116B class, particularly, for 4-methoxyacetophenone with a great conversion efficiency at 91%, showing that P450MOcould be used as a great biocatalyst candidate for further analysis.
P450MO,, CO-difference spectroscopy, enzymatic property, demethylation
10.13345/j.cjb.190533
November 28, 2019;
February 4, 2020
Supported by: National Key R&D Program of China (No. 2018YFA0901700).
Yijian Rao. Tel: +86-510-85912322; E-mail: raoyijian@jiangnan.edu.cn
国家重点研发计划 (No. 2018YFA0901700) 资助。
李晨星, 侯晓冬, 郭保党, 等. 新型争论贪噬菌S110的细胞色素P450酶的异源表达及催化特性分析. 生物工程学报, 2020, 36(7): 1346–1355.
Li CX, Hou XD, Guo BD, et al. Expression and characterization of a novel cytochrome P450 enzyme fromS110. Chin J Biotech, 2020, 36(7): 1346–1355.
(本文责编 陈宏宇)

