罗非昔布与牛血清白蛋白之间相互作用的研究
刘昭清, 万 众, 江 政, 庹 浔*
(1.南昌大学化学学院,江西南昌 330000; 2.南昌大学药学院,江西南昌 330000)
罗非昔布(Rofecoxib,RFB)是一种非甾体类抗炎药物,它也是环氧化酶(COX)抑制剂的代表性药物,具有解热,镇痛和消炎等作用,主要用于止痛与治疗骨关节炎。与传统的非甾体类抗炎药相比,服用RFB可有效地降低胃肠道不良反应的发生率。然而,持续服用RFB会导致心血管风险的增加,2004年该药物也因此安全问题而撤市[1]。但Tremeau Pharmaceuticals制药公司在2018年宣布计划将该药重新推向市场,且该药主要应用于治疗血友病引起的严重关节疼痛。因此研究RFB在体内的作用机制可以为相关的监管机构确定该药的利弊提供基础数据[2]。
血清白蛋白是生体内含量最丰富的载体蛋白,能够与很多小分子药物广泛结合,在血液物质的储存、转运和代谢中担任了重要的角色[3]。通过光谱法研究单一(多个)药物与牛血清白蛋白(BSA)相互作用的报道较多,但是对于RFB与BSA之间相互作用机制的研究尚未见报道。因此,本文结合光谱学与分子对接技术探究RFB与BSA之间的相互作用的机理,为进一步揭示RFB对生物体的作用机制提供理论基础和数据支撑。
1 实验方法
1.1 仪器与试剂
F-4500荧光分光光度计(日本,日立公司),带温控系统;Cary Eclipse荧光光谱仪(美国,安捷伦公司);UV-5500PC紫外分光光度计(上海元析仪器有限公司);Terson-27红外光谱仪(布鲁克),带ATR附件。
牛血清白蛋白(BSA,Sigma-Aldrich公司)溶液:溶于超纯水中,配制成1.0×10-3mol/L的溶液,于-20 ℃保存;罗非昔布(RFB)(上海源叶生物,≥98%)溶液:配制成1.0×10-3mol/L贮备溶液,4 ℃保存;Tris-HCl缓冲液:称取2.42 g Tris和3.51 g NaCl,溶于500 mL超纯水中,配制成pH=7.40的缓冲溶液。实验用水均为超纯水。
1.2 实验部分
1.2.1 荧光光谱测定准确移取3 mL的Tris-HCl缓冲液至1 cm的比色皿中,固定溶液中BSA的浓度(1.7×10-6mol/L),逐渐增加RFB的浓度至8.3×10-7mol/L,设置合适的仪器参数,以280 nm为激发波长,在300~400 nm范围内测定RFB对BSA荧光光谱的影响。
改变BSA-RFB体系的温度(288 K、293 K、298 K),以280 nm为激发波长,测量300~400 nm的荧光光谱。固定Δλ(λex-λem)=15 nm与Δλ(λex-λem)=60 nm,测定BSA在250~320 nm范围内的同步荧光光谱。固定溶液中BSA(1.7×10-6mol/L)与RFB(1.7×0-7mol/L)的浓度,设置合适的仪器参数,在激发波长每增加2 nm的情况下,绘制200~300 nm的三维荧光光谱。
1.2.2 红外光谱测定在分辨率为4 cm-1,背景扫描和样品扫描都是64次的情况下,测定游离态和复合态BSA的红外光谱。
2 结果与讨论
2.1 RFB与BSA的结合方式
分子中的色氨酸残基(Trp)与酪氨酸残基(Tyr)是BSA内源性荧光的主要来源[4,6]。如图1所示,BSA的荧光强度随着RFB浓度的增加而显著下降,表明BSA内源性荧光发生猝灭是因为RFB与BSA发生了相互作用[5]。
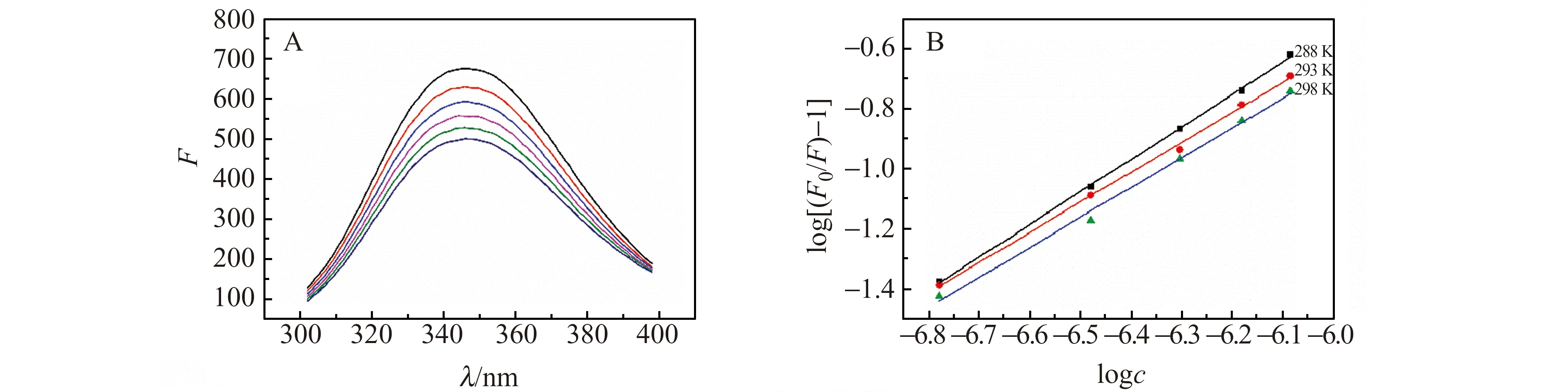
图1 BSA-RFB体系的荧光光谱(A)和BSA与RFB相互作用的双对数图(B)Fig.1 Fluorescence spectra of BSA-RFB system(A) and plots of log[(F0/F)-1] versus logc for BSA-RFB system(B) [BSA]=1.7×10-6 mol/L;1 - 6:[RFB]=0、1.7、3.3、4.9、6.6、8.3×10-7 mol/L.
RFB导致BSA荧光猝灭的机制包括动态和静态猝灭[4,6]。所以,可以通过温度与结合常数之间的关系和Stern-Volmer方程来判断荧光猝灭机制[7]。
F0/F=1 +KSV[Q]=1 +Kqτ0[Q]
(1)
式中的F0为BSA的荧光强度,F为BSA中加入不同浓度的RFB后的荧光强度,KSV为动态猝灭常数,[Q]为RFB的浓度,τ0为RFB不存在时BSA的荧光寿命(10-8s),Kq为双分子猝灭过程速率常数。
根据式(1)可以计算出温度分别为288 K、293 K和298 K时,RFB对BSA的猝灭常数Kq分别是2.98×1013L/(mol·s),2.47×1013L/(mol·s),2.20×1013L/(mol·s),比最大碰撞猝灭常数2.0×1010L/(mol·s)高出3个数量级,表明了RFB与BSA是分子间结合形成不发光物质而引起了静态猝灭[8]。同时动态猝灭常数随着温度的升高而降低,与动态猝灭的机制不符,证明了RFB与BSA的荧光猝灭机制是静态猝灭[9]。
2.2 荧光光谱分析
对于静态猝灭来说,RFB-BSA体系的结合常数KA及结合位点数n,可由公式(2)得到
log[(F0-F)/F]=logKA+nlog[Q]
(2)
如图1所示,根据线性方程的斜率与截距即可得到结合位点数n和结合常数KA[10]。由表(1)可知,RFB与BSA相互作用的结合常数随着温度的升高而降低进一步证明了RFB与BSA之间的荧光猝灭机理是静态猝灭。RFB与BSA之间结合常数的数量级是105,说明了RFB与BSA之间有较强的结合作用[10]。不同温度条件下,n值均为1说明RFB和BSA两者之间有一个有效的结合位点。
BSA有两个位点与小分子结合,位点Ⅰ有Trp与Tyr两个芳香族的氨基酸残基,位点Ⅱ仅有Tyr一个芳香族氨基酸残基[11]。因此,可以利用同步光谱单独区分Trp与Tyr的特征荧光光谱,从而确定BSA与RFB之间的结合位点。其中Δλ=15 nm仅显示Tyr的特征光谱,Δλ=60 nm仅表现为Trp的特征光谱[11 - 12],结果见图2。随着RFB浓度的增加([RFB]∶[BSA]<1),Tyr、Trp荧光均被猝灭,Tyr的荧光强度下降22.59%;Trp的荧光强度下降27.14%,揭示了RFB与Tyr和Trp都发生了相互作用,且RFB与BSA的结合位点更接近Trp残基。因此,可判断RFB和BSA之间的结合位点是在位点Ⅰ。
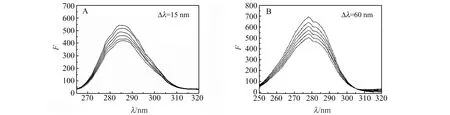
图2 RFB-BSA体系的同步荧光光谱Fig.2 Synchronous fluorescence spectra of BSA-RFB system[BSA]=1.7×10-6 mol/L;1 - 6:[RFB]=0,1.7,3.3,4.9,6.6,8.3×10-7 mol/L.
2.3 RFB和BSA的相互作用力
静电作用力、范德华力、氢键和疏水作用力等作用力是化学小分子与生物大分子之间形成超分子复合物的主要驱动力[12 - 13]。通过RFB与BSA之间相互作用的热力学参数,能够推断出它们之间相互结合的作用力类型。由表1可知,ΔG<0,由此说明了反应是自发进行的;ΔH<0、ΔS<0,表明RFB和BSA之间的相互作用力主要为氢键与范德华力。
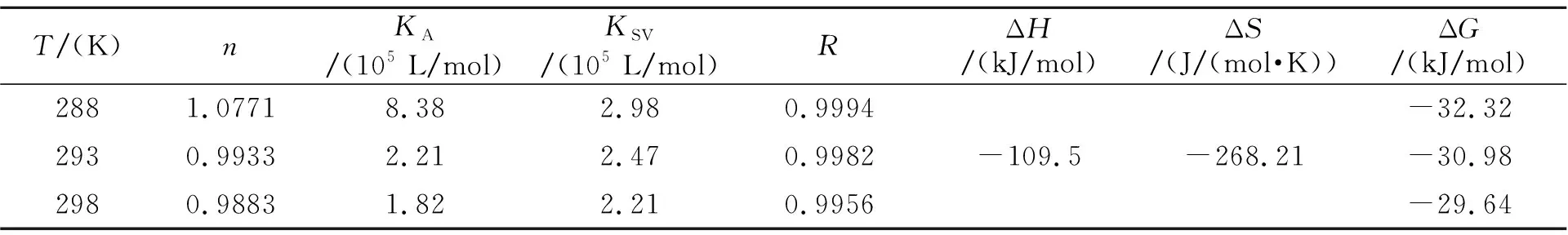
表1 不同温度下BSA-RFB体系的热力学常数
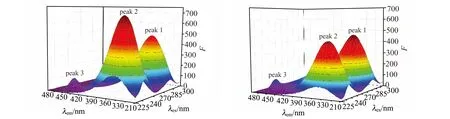
2.4 RFB-BSA之间的能量转移与结合距离
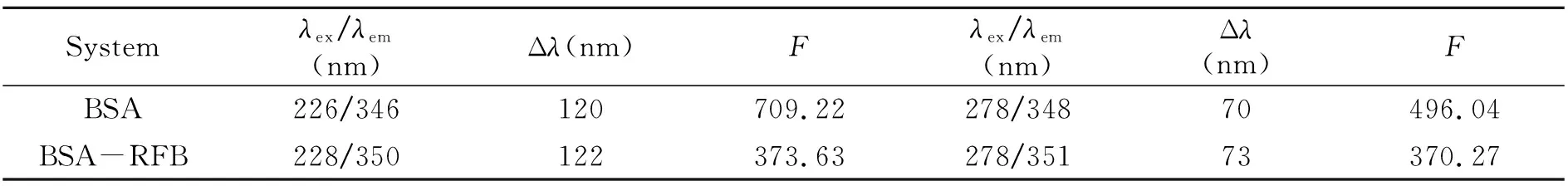
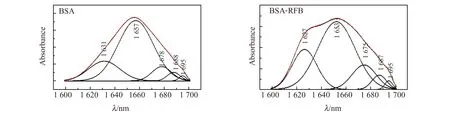
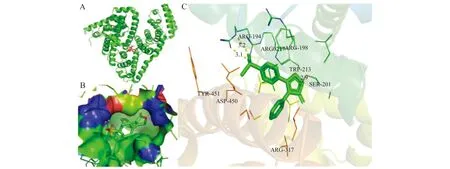
根据Förter的偶极-偶极非辐射能量转移定理可以计算出BSA-RFB之间的结合距离。由图3可以看出,BSA荧光光谱与RFB紫外可见光谱的重叠面积J0=2.65×10-14cm2·L/mol,进一步计算得临界距离R0=2.88 nm,RFB与氨基酸残基Trp之间的结合距离r0=3.50 nm<7 nm,即RFB与BSA之间发生了非辐射能量转移[13]。0.5R0 图3 BSA的荧光发射光谱(a)和RFB的紫外吸收光谱(b)Fig.3 Spectral overlap between fluorescence emission spectrum of BSA(a)and the absorption spectrum of RFB(b)[BSA]=[RFB]=1.7×10-6 mol/L. 三维荧光光谱可以为BSA的构象变化提供更多和更为详细的信息[15]。如图4与表2所示,加入RFB后,Peak1 Stoke位移由70 nm变化到了73 nm且荧光强度由496.04降低到了370.27;Peak2 stoke位移由120 nm变化到了122 nm且荧光强度由709.22下降到了373.63。三维荧光的结果表明研究体系中RFB的存在诱导BSA构象发生了变化。 图4 BSA(A)和RFB-BSA(B)体系的三维荧光光谱Fig.4 Three-dimensional spectroscopy of BSA(A)and BSA-RFB(B) [BSA]=1.7×10-6 mol/L,[RFB]=0,1.7×10-7 mol/L. 表2 三维荧光光谱的特征参数 蛋白质的红外光谱主要是由肽基的羰基伸缩振动、肽基N-H平面内弯曲和C-N伸缩振动所诱导的酰胺Ⅰ带和酰胺Ⅱ带组成[16]。一般来说,酰胺Ⅰ带比酰胺Ⅱ带对蛋白质二级结构的变化更敏感。利用分峰技术分析BSA酰胺Ⅰ 带的红外光谱可以得到α-螺旋(1 660~1 650 cm-1)、β-折叠(1 640~1 610 cm-1)、β-转角(1 680~1 640 cm-1)、β-片层结构(1 690~1 680 cm-1)、无规则卷(1 648~1 441 cm-1)等蛋白质二级结构的具体信息[16]。游离态和复合态BSA的蛋白质二级结构含量如图5和表2所示,BSA的α-螺旋的含量从游离态的67.16%下降到了复合态的57.58%,证明RFB与BSA发生相互作用时导致BSA的构象发生变化。该结论与三维荧光的结论一致,进一步验证了RFB诱导BSA的构象发生了变化。 图5 BSA和BSA-RFB的红外光谱图Fig.5 The infrared spectra of BSA and BSA-RFB 表3 蛋白质二级结构相关参数 分子对接技术为光谱学研究小分子药物与生物大分子之间的相互作用提供了有利的佐证[12,17]。因此本研究运用Autodock4.2对RFB与BSA在结合位点Ⅰ与Ⅱ处的结合模式进行了研究。研究表明RFB分别进入BSA的结合位点Ⅰ与结合位点Ⅱ时,它们结合的吉布斯自由能是-9.2 kcal/mol(位点Ⅰ)和-5.1 kcal/mol(位点Ⅱ),说明了RFB更倾向于与BSA的位点Ⅰ进行结合。对接技术的结论与同步荧光的结论一致。 利用PyMOL进一步对结合位点Ⅰ的分子对接结果进行分析,发现BSA的Arg194/198/217/347、Ser201、Trp213、Tyr451、Asp450等氨基酸残基与RFB具有相互作用。其中绝大多数氨基酸都是疏水性氨基酸,表明了RFB与BSA之间具有较强的疏水作用力;Ser201、Arg194与RFB还形成了三个氢键,键长分别是2.9 Å、3.1 Å和3.2 Å;芳香族氨基酸Tyr451、Trp213和RFB之间的π-π堆积作用可能是导致其荧光下降的主要因素;同时,RFB附近存在一些极性带电氨基酸残基,例如Arg194/198/217/347、ASP450,因此,BSA与RFB之间的π-cation作用同样值得关注。综上所述,这些作用力的协同作用对维持RFB-BSA复合物的稳定性具有重要作用。 图6 RFB与BSA的分子对接模拟图。A:BSA-RFB复合物结构图,B:RFB位于BSA疏水性空腔Ⅰ中放大图,C:RFB与BSA相互作用Fig.6 Simulation of molecular docking between RFB and BSA.A:Structure diagram of BSA-RFB complex;B:Enlarged diagraming of RFB located on BSA site Ⅰ;C:Interaction between RFB and BSA 本工作结合光谱学与分子对接技术研究RFB与BSA之间的相互作用机制,结果表明:RFB和BSA之间形成了复合物,其过程为静态猝灭与非辐射能量转移;疏水作用力、π-π堆积作用、氢键和π-cation作用等对于维持RFB-BSA复合物的稳定性起到了重要作用;三维荧光与红外光谱相互印证了RFB诱导BSA的蛋白质二级结构发生变化;分子对接的结果与光谱学的结果一致,表明了RFB-BSA的结合位点在位点Ⅰ,为RFB的进一步研究提供了更有力的参考。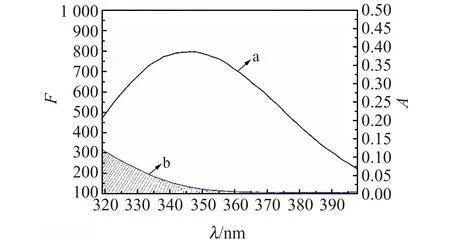
2.5 RFB对BSA构象的影响
2.6 分子对接
3 结论

