肾移植术后患者血液他克莫司代谢率(C0/D值)对肝肾功能的影响研究
魏菁菁,王冬梅,胡 俊,丁进亚(中部战区总医院汉口院区检验科,武汉 430014)
他克莫司(Tac)是一种有大环内酯结构普遍用于临床的强效免疫抑制剂,目前广泛用于肝、肾移植术后。由于Tac 的治疗窗窄,患者个体间和个体自身药动力学差异大,给药剂量和全血浓度之间的相关性差,临床应用时为获得最佳的免疫效果并减少不良反应的发生,应实时监测患者的血药浓度并调整用药剂量。为了更好地达到疗效同时避免不良反应,本研究收集211 例肾移植患者Tac 药谷浓度和当天检测的生化与血细胞检测的结果,回顾分析Tac 的不同代谢率(C0/D 值)对肝肾功能,血浆蛋白相关指标的影响,供临床医生用药参考。
1 材料与方法
1.1 研究对象 采用回顾性研究方法,收集武汉地区中部战区总医院肾移植术后病人标本。选择2014年~2016年来我院检查血药浓度的肾移植受者211 例,其中男性162 例,女性49 例,年龄44.26±12.63 岁。接受移植的时间≥12 个月。本研究符合医学伦理学标准,并经医院伦理委员会批准,所有治疗和检测均得到受者或家属的知情同意。纳入标准:肾移植患者术后治疗方案主要是:FK506+吗替麦考酚酯+皮质类固醇激素三联免疫抑制治疗,FK506 每日服用2 次,剂量随术后时间、血药浓度检测结果及患者临床状况进行适当调整,临床情况稳定。
1.2 仪器与试剂 检测试剂盒来源为:日本积水;检测生化仪器:日立7600-110 生化分析仪。血红蛋白(HGB)检测仪器为Mindray 公司BC-6800 全血五分类血细胞仪。Tac 血药浓度的检测:应用Abbott ARCHITECT 他克莫司测定试剂盒,仪器:ARCHITECT i2000SR 全自动免疫分析仪。肝功能的检测指标包括总胆红素(TBIL)、直接胆红素(DBIL)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST);肾功能的检测指标包括尿素氮(Urea)、肌酐(Cr)、尿酸(UA)、二氧化碳(CO2)以及肾小球率过滤(eGFR)。蛋白检测指标包括总蛋白(TP)、清蛋白(ALB)、血红蛋白(HGB)。
1.3 方法
1.3.1 肝肾功能的检测:均采用酶法测定,测定在日立7600-110 型全自动生化仪上完成。
1.3.2 血红蛋白检测:全自动血液分析仪检测HGB。
1.3.3 血Tac 浓度及代谢率的测定:血Tac 药谷浓度的测定:于检测日前晚20:00 口服Tac,次日清晨8:00 服用Tac 前采血,采用化学发光免疫法检测血Tac 浓度。实验方法参考试剂说明书。
1.3.4 Tac 代谢率的计算:使用测定的药谷浓度(C0)和Tac 使用的日剂量的比值表示Tac 代谢率[7,10],即C0/D(ng/ml/1/mg)=Tac 药 谷 浓 度(ng/ml)/ Tac日剂量(mg)。将C0/D 值从小到大进行排序,平均分为三组。快代谢(rapid metabolizer,RM)组70例,C0/D 值范围0.48~1.52,均值为1.04;中间代 谢(intermediate metabolizer,IM) 组70 例,C0/D 值范围1.53~2.63,均值为2.03;慢代谢(poor metabolizer,PM)组71 例,C0/D 值范围2.65~22.8,均值为4.98。
1.4 统计学分析 本研究所得数据采用 SPSS(19.0版)软件统计处理。运用K-S 检验对数据是否符合正态分布进行检验。符合正态分布的数据,多组数据之间的比较采用F检验,两组数据之间的比较用t检验,各组间性别的比较用卡方检验。数据描述方式为均值±标准差(+s),P<0.05 为差异有统计学意义。
2 结果
2.1 Tac 代谢率对体重、身高、年龄、性别、用药剂量的影响 见表1。我们对所有符合纳入条件的肾移植受者的身高、体重、年龄、性别、日用药剂量、Tac 的谷药物浓度进行归档记录;将Tac 药谷浓度/Tac日剂量的比值(C0/D 值)从小到大进行排序,并平均分为三组。三个代谢组肾移植受者的年龄、身高、体重、BMI 值以及性别(χ2=2.759)之间差异无统计学意义(均P>0.05)。用药剂量:RM 组>IM组>PM 组。药谷浓度:RM 组<IM 组<PM 组。三组数据在用药剂量和血药浓度之间比较,差异有统计学意义(P=0.000)。
表1 不同代谢组体重、身高、年龄、性别、用药剂量的比较(+s)

表1 不同代谢组体重、身高、年龄、性别、用药剂量的比较(+s)
注:BMI:身体质量指数; a: P 值来源于单因素方差分析; b: P 值来源于卡方检验。
项 目 RM 组(n=70) IM 组(n=70) PM 组(n=71) F/χ2 P体重(kg) 71.03±12.05 72.51±11.65 70.53±11.93 0.529 0.590a身高(m) 1.72±0.14 1.69±0.12 1.70±0.10 1.241 0.291a BMI(kg/m2) 24.38±5.20 25.84±5.68 24.63±5.02 1.516 0.222a年龄(years) 44.31±10.74 45.19±14.04 43.30±13.00 0.393 0.675a性别(m/f) 53/17 50/20 59/12 - 0.252b剂量(mg/d) 5.49±1.50 3.39±0.89 1.97±0.93 169.384 0.000a Tac 谷药浓度(ng/ml) 5.62±1.89 6.78±1.56 8.05±3.04 20.406 0.000a C0/D 值(ng/ml/mg) 1.04±0.29 2.03±0.30 4.98±3.69 63.936 0.000a
2Tac 代谢率对肾移植受者肝、肾功能以及血浆蛋白的影响见表2。为了探索长期服用Tac 是否对肾移植受者的肝功能和肾功能有影响,我们比较三个代谢组之间肝功能和肾功能以及血浆蛋白的相关生化指标。统计学分析表明:肝功能相关指标中,ALT 在PM 组的水平较RM 组高(P=0.026),ALT 在PM 组和IM 组的比较,差异无统计学意义(P=0.962);TBIL,DBIL,IBIL 和AST 的组间比较,差异均无统计学意义(均P>0.05)。
肾功能相关指标中,Urea 在RM 组的水平较IM 组(P=0.005)和PM 组(P=0.001)高;Cr 在RM 组的水平较IM 组(P=0.022)和PM组(P=0.034)高,Urea(P=0.696),Cr(P=0.849)在PM组和IM组之间的比较差异无统计学意义。eGFR 在RM 组的水平较IM组(P=0.018)和PM(P=0.001) 组低,eGFR在PM组和IM组的比较差异无统计学意义(P=0.273)。CO2在RM组水平较PM组低(P=0.009),CO2在RM组和IM组之间(P=0.102)以及IM和PM组之间(P=0.321)的比较差异无统计学意义。UA 的组间比较差异无统计学意义(P=0.731)。
血浆蛋白相关指标中,ALB 在RM 组水平较IM 组(P=0.000) 和PM组(P=0.059) 低,ALB在PM组和IM组的比较差异无统计学意义(P=0.094)。HGB 在RM组水平较IM组(P=0.014) 和PM 组(P=0.004)低,HGB 在PM组和IM组之间的比较差异无统计学意义(P=0.657)。
表2 不同代谢组肾移植受者肝肾功能以及血浆蛋白的比较(+s)
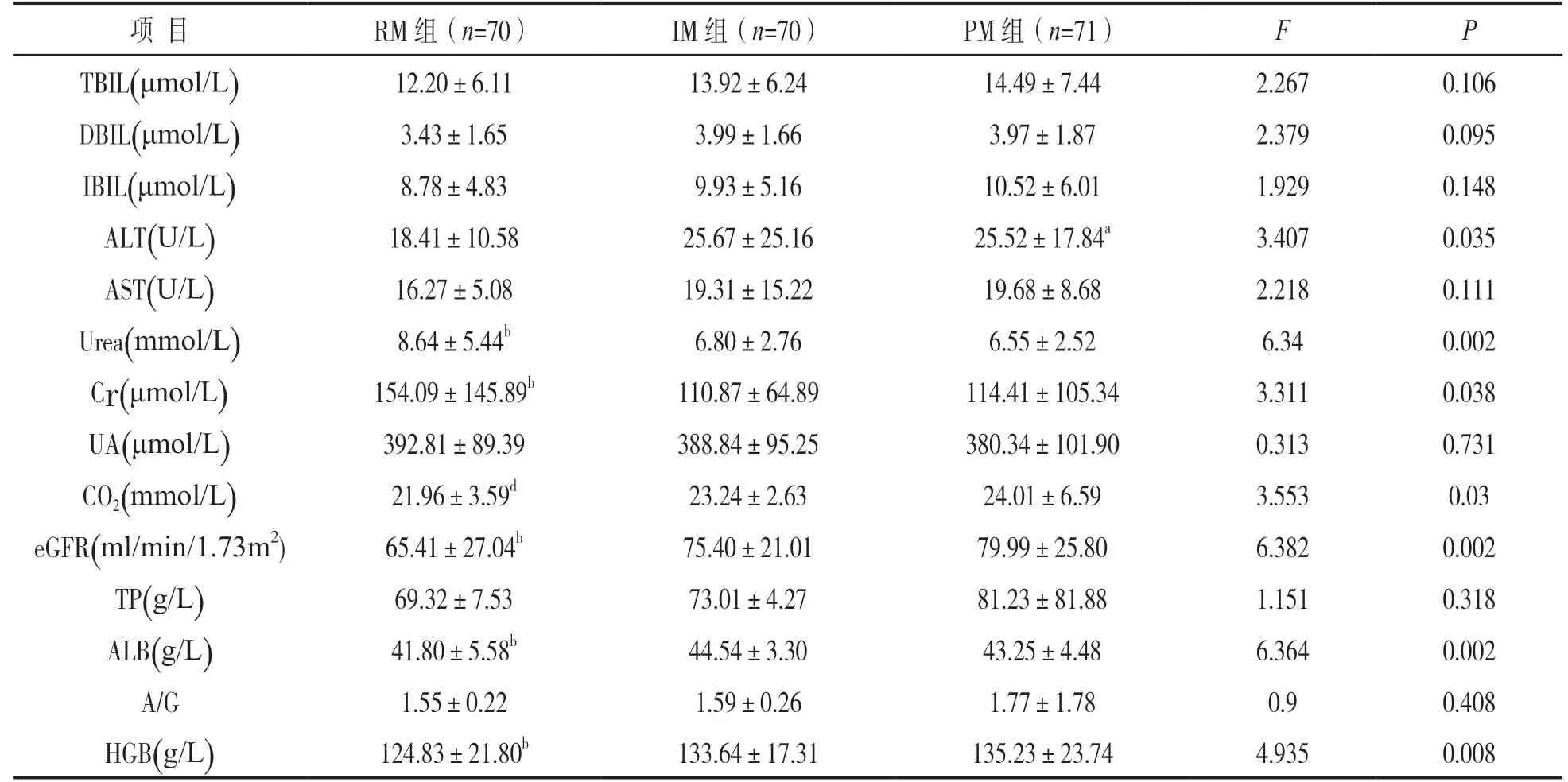
表2 不同代谢组肾移植受者肝肾功能以及血浆蛋白的比较(+s)
注:a:与RM 组比,P<0.05;b:与IM,PM 组比,P<0.05;d:与PM 组比,P<0.05。
项 目 RM 组(n=70) IM 组(n=70) PM 组(n=71) F P TBIL(μmol/L) 12.20±6.11 13.92±6.24 14.49±7.44 2.267 0.106 DBIL(μmol/L) 3.43±1.65 3.99±1.66 3.97±1.87 2.379 0.095 IBIL(μmol/L) 8.78±4.83 9.93±5.16 10.52±6.01 1.929 0.148 ALT(U/L) 18.41±10.58 25.67±25.16 25.52±17.84a 3.407 0.035 AST(U/L) 16.27±5.08 19.31±15.22 19.68±8.68 2.218 0.111 Urea(mmol/L) 8.64±5.44b 6.80±2.76 6.55±2.52 6.34 0.002 Cr(μmol/L) 154.09±145.89b 110.87±64.89 114.41±105.34 3.311 0.038 UA(μmol/L) 392.81±89.39 388.84±95.25 380.34±101.90 0.313 0.731 CO2(mmol/L) 21.96±3.59d 23.24±2.63 24.01±6.59 3.553 0.03 eGFR(ml/min/1.73m2) 65.41±27.04b 75.40±21.01 79.99±25.80 6.382 0.002 TP(g/L) 69.32±7.53 73.01±4.27 81.23±81.88 1.151 0.318 ALB(g/L) 41.80±5.58b 44.54±3.30 43.25±4.48 6.364 0.002 A/G 1.55±0.22 1.59±0.26 1.77±1.78 0.9 0.408 HGB(g/L) 124.83±21.80b 133.64±17.31 135.23±23.74 4.935 0.008
3 讨论
钙调神经蛋白抑制剂联合吗替麦考酚酯及类固醇激素类药物的三联免疫抑制方案已广泛用于临床,并以其确切的免疫抑制疗效获得临床医生的认可[1]。Tac 广泛应用于实体器官移植领域[1-3],但其治疗窗窄,血液中浓度太低易导致排斥反应的发生,因此在初始治疗的数周内,应将Tac 保持在一个必要血药浓度之上,但浓度过高(>15 μg/L)又较易引起严重的副反应以及肾脏毒性[2]。不同国家不同中心所采用的Tac 稳态药谷浓度的范围也有所不同,但一般控制在5~15μg/L 之间[11]。本研究中211 例肾移植受者有154 例(72.99%)肾移植受者药谷浓度维持在5~10μg/L 之间,40 例(18.96%)肾移植受者药谷浓度低于5μg/L,17 例(8.06%)肾移植受者药谷浓度高于10μg/L 但小于15μg/L,说明本中心Tac 的血药浓度控制相对比较稳定。
Tac 口服后很快在空肠、十二指肠等部位吸收,除不到1%的药物以原形形式从胆汁、尿液及粪便中排出外,大部分通过CYP3A5 代谢分解[4]。因此,肾移植受者肝功能正常与否对药物在体内的代谢影响较大。本研究中肾移植受者的肝功能指标(除了ALT 以外)在三个代谢组之间的比较差异无统计学意义。虽然ALT 在PM 组较高(P<0.05),但是仍然在正常人群参考范围之内,考虑Tac 长期用药对肝脏的损伤较小,肝毒性发生率低。李佳[10]、牛志立[12]、张鹰[14]等的研究结果与我们相似,只是他们的研究发现AST 在不同血药浓度组的比较差异有统计学意义。ALB 和HGB 在不同代谢之间比较差异有统计学意义,它们在RM 组的水平低于其他两组(P<0.05)。有研究表明血浆中绝大多数Tac 结合在血浆蛋白上(98.8%),血浆蛋白低将导致未结合的Tac 增加,从而加快Tac 的清除[5]。这也提示我们如果肾移植受者在术后出现贫血症状或者低血浆蛋白症状,应警惕Tac 血浆浓度过低引起的移植器官排斥反应。eGFR 被认为是影响移植肾功能的重要因素之一,可作为短期和长期预测肾移植的结果[14]。本研究中肾功能相关指标(Urea,Cr,eGFR,CO2)在不同代谢组之间的比较差异有统计学意义(P<0.05)。Urea,Cr 在RM 组较高,eGFR在RM 组较低,这可能与下列因素有关:一是RM组的用药剂量大,二是RM 组的血药浓度低,三是RM 组的药物代谢产物增多,这些因素都可能不利于肾功能的维持,引起肾毒性的发生[6-9,14]。
既往研究关注较多的是药谷浓度和肾移植术后肝肾功能,血浆蛋白之间的关系[10-14],较少人关注Tac 的代谢率(C0/D 值)对肾移植术后肝肾功能的影响。C0/D 值一方面反映药谷浓度情况,另一方面反映临床医生用药情况,是判断Tac 代谢的一个更好的综合指标。C0/D 评估Tac 的代谢率在一些国外研究中也得以应用[7]。他们定义C0/D=1.05 为快代谢组的cutoff 值[9]。我们研究中RM 组C0/D 的均值为1.04±0.29,与THÖLKING 等[7]的研究结果相近。
虽然Tac 已经广泛应用于肾移植术后,但是Tac 的血药浓度受到很多因素的影响,单独检测血药浓度可能不能完全满足临床需求。临床医生可以根据肾移植受者的C0/D 值评估该患者的Tac 代谢情况,并参考其肝肾功能指标,从而调整Tac 的用药量,进而使长期服用Tac 的肾移植受者达到最好的疗效。

