新辅助化疗前后局部晚期宫颈癌中VEGF-C、VEGFR-3表达及疗效的研究
陈志琴 高玉玲 李文洲
福建医科大学省立临床学院妇产科,福建福州 350001
宫颈癌的发生率仅次于乳腺癌,被认为是女性生殖系统最常见的恶性肿瘤之一,严重威胁女性身体健康。相对早期宫颈癌(包括ⅠB2-ⅡA2 巨块型),局部晚期宫颈癌(locally advanced cervical cancer,LACC)肿瘤直径≥4cm,5 年生存率不足60%[1],临床预后较差。宫颈癌的新辅助化疗(neoadjuvant chemotherapy,NACT)也被称为先期化疗,即在宫颈癌进行手术或放疗前应用的化疗,改善患者无瘤生存期、提高患者的完全缓解率。但目前NACT 效果判断一般是根据临床症状和体征,存在一定的主观性和局限性。本研究采用免疫组化方法检测局部晚期宫颈癌NACT 前后VEGF-C、VEGFR-3 的表达情况,结合临床症状和体征,进一步探讨VEGF-C、VEGFR-3 表达情况与狭义的LACC 治疗效果的关系,从而进一步验证局部晚期宫颈癌NACT 的有效性及可行性。
1 资料与方法
1.1 一般资料
选择2011 年12 月~2016 年12 月我院妇产科局部晚期宫颈癌患者45 例。年龄22 ~65 岁,中位年龄42 岁。按照2009 版FIGO 宫颈癌临床分期,Ⅰ B2 期22 例,Ⅱ A1 期6 例,Ⅱ A2 期10 例,Ⅱ B 期7 例,其中腺癌11 例,鳞癌34 例;高分化13 例,中分化23 例,低分化9 例。纳入标准:所有患者临床资料完整,均经过病理确诊,由2 位有经验的妇科肿瘤医师妇科检查分期,签署知情同意书。排除标准:已经过任何放疗、化疗或手术患者。所选患者均采用TP(紫杉醇联合顺铂)方案静脉化疗2 个疗程,第二次化疗结束后2 周选择手术治疗。NACT 前进行宫颈组织活检,手术后留取肿瘤边缘生长活跃宫颈癌标本。所有免疫组化试剂购于北京中杉金桥生物技术有限公司,按试剂盒说明进行操作。
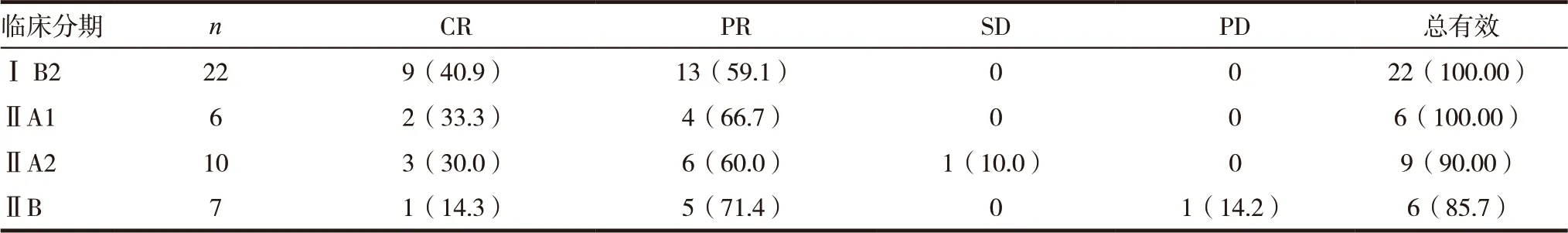
表1 宫颈癌新辅助静脉化疗疗效比较[n(%)]
1.2 免疫组化方法
将宫颈癌标本用中性福尔马林固定、石蜡包埋,连续切片2 张,厚度4pm,染色采用SP 免疫组化,抗原热修复使用微波炉,用pH6.0 的柠檬酸缓冲液作为抗原修复液,阴性对照以PBS 缓冲液代替一抗,用DAB 进行显色,苏木精进行对比染色后,封片(用中性树胶)。阳性对照用已知阳性片,阴性对照以PBS 缓冲液代替一抗。
1.3 结果判定
1.3.1 VEGF-C 阳性评分标准 高倍镜下棕黄色细颗粒状物为VEGF-C,其主要位于癌细胞的细胞质内。高倍镜下随机取5 个视野(细胞数≥200 个/视野),以棕黄色细颗粒状物细胞(简称阳性细胞)所占百分比以及着染色程度作为结果判定。以阳性细胞得分乘以染色程度得分来计总分,总分≥3 为阳性,<3 为阴性。以阳性细胞百分比判定:阳性细胞≥75%计4 分;75%>阳性细胞≥50%计3分;50%>阳性细胞>10%计2 分;≤10%计1 分;阴性计0 分;以染色程度判定:棕黄色计3 分;中度黄色计2 分;淡黄色计1 分;不着色计0 分[2]。
1.3.2 VEGFR-3 阳性评分标准 低倍镜下棕黄色颗粒为VEGFR-3,其主要位于脉管内皮细胞细胞质内。VEGFR-3 计数方法及脉管判断标准:低倍镜下寻找热区(VEGFR-3 阳性脉管密集区),用100倍视野来计算5 个热区中VEGFR-3 阳性脉管数,取其平均值。
1.3.3 NACT 疗效判断标准 若肿瘤变大并超过25%,或者影像学检查提示新病灶,为进展(PD);若肿瘤有缩小(但缩小<50%)或增大(但增大≤25%),为稳定或无效(SD);若肿瘤缩小≥50%,为部分缓解(PR);若肿瘤完全消失,为完全缓解(CR)。NACT 后,SD+PD 视为无效,CR+PR 视为有效[2]。
1.4 统计学方法
本研究使用SPSS11.0 软件对所得数据进行统计学分析,计数资料采用χ2检验与秩和检验,计量资料采用t 检验、单因素方差分析,P <0.05 为差异有统计学意义。
2 结果
2.1 新辅助化疗临床疗效比较
本研究认为局部晚期宫颈癌新辅助静脉化疗的总有效率为95.6%,经过2 个疗程新辅助化疗后的45 例局部晚期宫颈癌患者,其中43 例达到止血、止痛、缩小肿块体积的近期疗效,6 例Ⅱ B 期的患者降低临床分期,获得手术机会,1 例Ⅱ A2 和1 例Ⅱ B 期患者仍无手术机会,辅以放射治疗,见表1。
2.2 新辅助化疗前后VEGF的表达
新辅助化疗前VEGF-C、VEGFR-3 表达率分别为84.4%、75.6%,而新辅助化疗后第14 天VEGF-C、VEGFR-3 表达率分别20.9%、25.6%,差异无统计学意义(P >0.05)。见表2。低分化者VEGF-C 阳性表达率88.9%,中分化者为82.6%,高分化者84.6%,差异无统计学意义(P >0.05),认为VEGF-C 的表达与组织学分级无明显相关性。有无淋巴结转移者VEGF-C 阳性表达率分别为100.0%、78.1%,差异有统计学意义(P <0.05),认为VEGF-C 的表达与淋巴结转移相关,见表2。
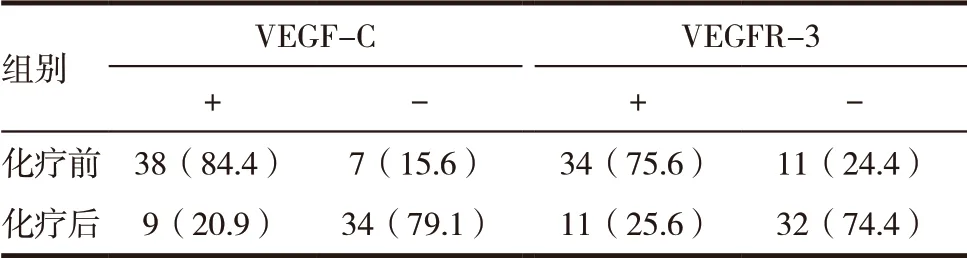
表2 宫颈癌新辅助化疗前后VEGF-C、VEGFR-3的表达[n(%)]
3 讨论
NACT 起源于20 世纪80 年代,是指对恶性肿瘤进行放疗或手术之前给予一定疗程的化疗,从而缩小肿瘤,降低淋巴结转移、脉管浸润、宫旁浸润等高危因素的几率,从而提高手术切除率[3]。Park等[4]对43例ⅠB2 ~ⅡB 期患者采用紫杉醇联合顺铂(DDP)行NACT,发现有效率达90.7%,其中39.5%为CR(11.6%为病理完全缓解),51.2%为PR,有效的患者中72.1%分期下降,故认为以紫杉醇联合DDP行NACT,对LACC 患者效果显著。意大利学者Napolitano 等[5]研究表明,以VBP 方案对ⅠB-ⅡA期宫颈鳞癌患者根治手术前行NACT 的5 年无瘤生存率高于单独手术组或放疗组。本研究认为LACC患者进行NACT 后,临床上基本可以达到止血、止痛、缩小肿块体积的近期疗效,缓解临床症状,降低分期,为患者增加手术机会。
VEGF-C 是个淋巴管生成因子,可以激活VEGFR-3,并与之结合,从而改变淋巴屏障作用[6],促进淋巴管生成,对肿瘤的转移和生长以及胚胎发育起到重要调控作用。宫颈癌细胞可以分泌VEGF-C,刺激受体VEGFR-3 表达,并相互结合,促进肿瘤内和瘤旁淋巴管的生成,从而导致宫颈癌的淋巴转移。Fujimoto J 等[7]对40 例淋巴结转移的宫颈癌患者进行检测VEGF-C 的表达率,其中24例VEGF-C 表达显著升高,VEGF-C 升高的淋巴结转移者和无VEGF-C 升高的淋巴结转移者的24 个月生存率分别为38%、81%,差异有显著性,认为宫颈癌患者如VEGF-C 高表达,可以促进癌细胞通过淋巴道转移,可以作为判断预后的指标。Mitschashi等[8]研究发现宫颈癌治疗前血清VEGF-C 和VEGF 检测出高浓度,经过放疗或手术后,其浓度降低明显,认为治疗前VEGF-C 高浓度与难治及易复发相关。Watanabe S 等[9]通过检测有淋巴结转移和无淋巴结转移宫颈癌患者中VEGF-C 的表达情况,VEGF-C 升高的淋巴结转移者1 年生存率为38%,而VEGF-C 无升高的淋巴结转移者1 年生存率为81%,认为淋巴结转移且有VEGF-C 升高者,预后不良。殷敏敏等[10]研究认为VEGR 对宫颈癌的血管生成过程具有正性调节作用。托娅等[11]研究发现VEGF-C 的表达率与宫颈癌患者的年龄、宫颈癌的分期、病理类型、分化程度无关,但与淋巴结的转移情况有关,认为VEGF-C 可以促进癌组织的毛细血管及淋巴管增生,使癌细胞生长和淋巴结转移。我们研究认为VEGF-C 的表达与组织学分级无明显相关性,但与淋巴结转移具有相关性。因此,可以通过检测宫颈癌组织中VEGF-C 及VEGFR-3表达水平,可用来预测淋巴结转移的可能性[12]。
迄今为止,对LACC 进行NACT 的疗效评估方面没有一个统一的标准,一般根据临床体征和症状变化情况进行判断,如局部肿块缩小、阴道出血减少等,受主观因素影响较大。我们对LACC 患者NACT 前后检测VEGF-C、VEGFR-3 的表达情况,发现NACT 后VEGF-C、VEGFR-3 的表达明显降低,同时NACT 可以改善临床症状,降低宫颈癌临床分期;通过NACT,可以杀灭癌细胞,减少癌细胞分泌VEGF-C,从而减少癌细胞淋巴管和血管的生成,减少癌细胞的营养和氧供,使癌细胞进入休眠状态或凋亡,使肿物的体积缩小,使阴道、宫旁病灶消退,降低肿瘤分期,为LACC 患者创造手术条件[13-14],为年轻患者创造保留卵巢功能的机会[15]。Gong L 等[16]研究表明,NACT 可以降低局部晚期宫颈癌患者宫颈癌手术时相关并发症的发生率,同时可以降低同步放化疗或术后放疗的相关副反应。Angioli R 等[17]研究证实,局部晚期宫颈癌患者后手术与单独放疗相比,患者的无病生存期和总生存期明显延长,认为NACT 是有效的治疗方案。Yin M 等[18]对476 例ⅠB2-ⅡB 期宫颈癌患者进行回顾性分析,NACT 后宫颈癌手术与宫颈癌手术和同步放化疗两组相比,NACT 后宫颈癌手术可以提高患者的无进展生存期和总生存期。
综上所述,NACT 能缩小病灶,降低临床分期,提高手术切除率和放疗敏感性,延长患者总生存期。检测宫颈癌组织中VEGF-C/VEGFR-3 的表达水平,可用来确定有无淋巴结转移。NACT 前、后VEGF-C/VEGFR-3 的改变,可以进一步从血管生成层面证明NACT 是LACC 的一种有效、可行的辅助治疗方法,可作为判断NACT 疗效的一个客观指标,远期疗效有待于扩大样本量,进一步研究随访。

