顺德地区12237例新生儿遗传性耳聋基因突变分析
魏楚洪 张金凤 曾 娜 文 芳 张 静 邓惠英 麦富巨 郭润民,3, 曾巧莉
1.广东医科大学顺德妇女儿童医院(佛山市顺德区妇幼保健院)新生儿疾病筛查中心,广东佛山 528300;2.广东医科大学顺德妇女儿童医院(佛山市顺德区妇幼保健院)检验科,广东佛山 528300;3.广东医科大学顺德妇女儿童医院(佛山市顺德区妇幼保健院)内科,广东佛山 528300;4.广东医科大学顺德妇女儿童医院(佛山市顺德区妇幼保健院)妇幼研究所,广东佛山 528300
听力障碍是最为常见的先天性缺陷之一,居各类先天性遗传疾病之首,约占全部出生缺陷的20%左右[1],其中75%~80%为常染色体隐性遗传。目前,已经有许多与遗传性聋相关的基因被定位,其遗传性致聋易感基因有100 种,常见的遗传性致聋易感基因有15 种[2]。开展15 种常见的遗传性耳聋基因突变检测对在分子水平明确耳聋病因具有重要意义,同时可为广东省顺德地区遗传性致聋易感基因诊断和预防、遗传咨询提供实验室数据支持。本实验采用基因芯片法对12 237 例新生儿遗传性耳聋基因突变进行检测分析,现报道如下。
1 资料与方法
1.1 一般资料
选取2017 年6 ~10 月在顺德区各助产机构出生的活产新生儿12 237 例,其中男婴6420 例(52.46%),女婴5817 例(47.54%),釆血时间为出生后3 ~7d,本研究所有新生儿监护人签署知情同意书,并经医院医学伦理委员会审核通过。
1.2 方法
1.2.1 取血样 所有新生儿出生后72h 均按卫生部《新生儿疾病筛查血片采集技术规范》采集婴儿足跟血,填写相关的信息卡(母亲姓名、住院号、居住地址、联系电话、新生儿性别、孕周、出生体重、出生日期及采血日期等),其主要步骤:(1)按摩或热敷新生儿足跟,并用75%酒精消毒皮肤;(2)使用一次性采血针刺足跟内或外侧,深度<3mm,用干棉球拭去第一滴血,取第二滴血;(3)将滤纸片接触血滴,切勿触及足跟皮肤,使血自然渗透至滤纸背面,至少采集三个血斑,每个血斑直径>8mm;(4)将血片平置于清洁空气中,避免阳光直射,自然晾干呈深褐色,血斑无污染;(5)将检查合格的滤纸干血片,置于塑料袋内,保存在2 ~8℃冰箱中备检;(6)在3d 内将滤纸干血片运送至北京博奥医学检验顺德分公司进行新生儿遗传性耳聋基因突变检测。
1.2.2 DNA 提取
1.2.2.1 器材与方法 (1)用打孔器(杭州博圣生物技术有限公司):用于取直径为6mm 的干血斑1片至1.5mL 离心管(泰兴市博美医疗器械厂);(2)低温离心机:湘仪TGL-16K 台式高速冷冻离心机(湖南湘仪离心机仪器有限公司);(3)检测试剂盒:北京天根生化科技有限公司;(4)步骤:严格按试剂盒使用说明提取外周血基因DNA。
1.2.2.2 质量控制 应用Thermo NanoDrop 2000 微量紫外分光光度计(北京科誉兴业科技发展有限公司)测定DNA 浓度/纯度,满足浓度2 ~20ng/μL,纯度A260/A280=1.7 ~2.0,储存于HYCD-282 验室医学用冰箱(青岛海尔集团有限公司)-20℃备用。
1.2.3 基因突变位点检测
1.2.3.1 检测范围 4 个耳聋基因15 个常见突变位点,分别为:(1)GJB2:176del16 杂合突变型、235delC 杂合突变型、299delAT 杂合突变型、35delG杂合突变型。(2)GJB3:538C >T 杂合突变型。(3)SLC26A4:2168 A >G 杂合突变型、IVS7-2 A >G纯合突变型、1174 A >T 杂合突变型、1226 G >A杂合突变型、1229C >T 杂合突变型、1975 G >C杂合突变型、2027 T >A 杂合突变型、IVS15+5 G>A 杂合突变型。(4)线粒体12SrRNA:1494 C >T均质突变型、1555 A >G 均质突变型。
1.2.3.2 应用微阵列芯片法检测 (1)样品DNA PCR 扩增:PCR 反应体系合计为20.0μL,主要包括PCR 扩增引物混合物12.5μL、新生儿样品DNA提取物3.0μL 和PCR 扩增试剂混合物4.5μL,把PCR 反应体系加热到95℃,变性5min,立即取出浸入到冰水混合物中冰浴3min,取2.5μL 的PCR 产物,加入含有10μL 的杂交缓冲液管内,把混合液加至15 项遗传性耳聋基因检测芯片的点样区域,接着加盖玻片,最后再封闭杂交仓,并放入到温度为50℃的杂交仪内孵育1h 后取出芯片,放进洗干机内进行洗涤并快速甩干备用。(2)扫描芯片:运用晶芯LuxScan 10K 微阵列芯片扫描仪及配套软件(北京博奥晶典生物技术有限公司)进行对应的遗传性耳聋基因检测芯片的读取和结果判断确认。(3)质量控制:每批次均设置阴性质控和阳性质控,试剂盒由北京博奥生物集团有限公司提供,步骤严格按试剂盒使用说明操作,检测服务由北京博奥生物集团有限公司提供。
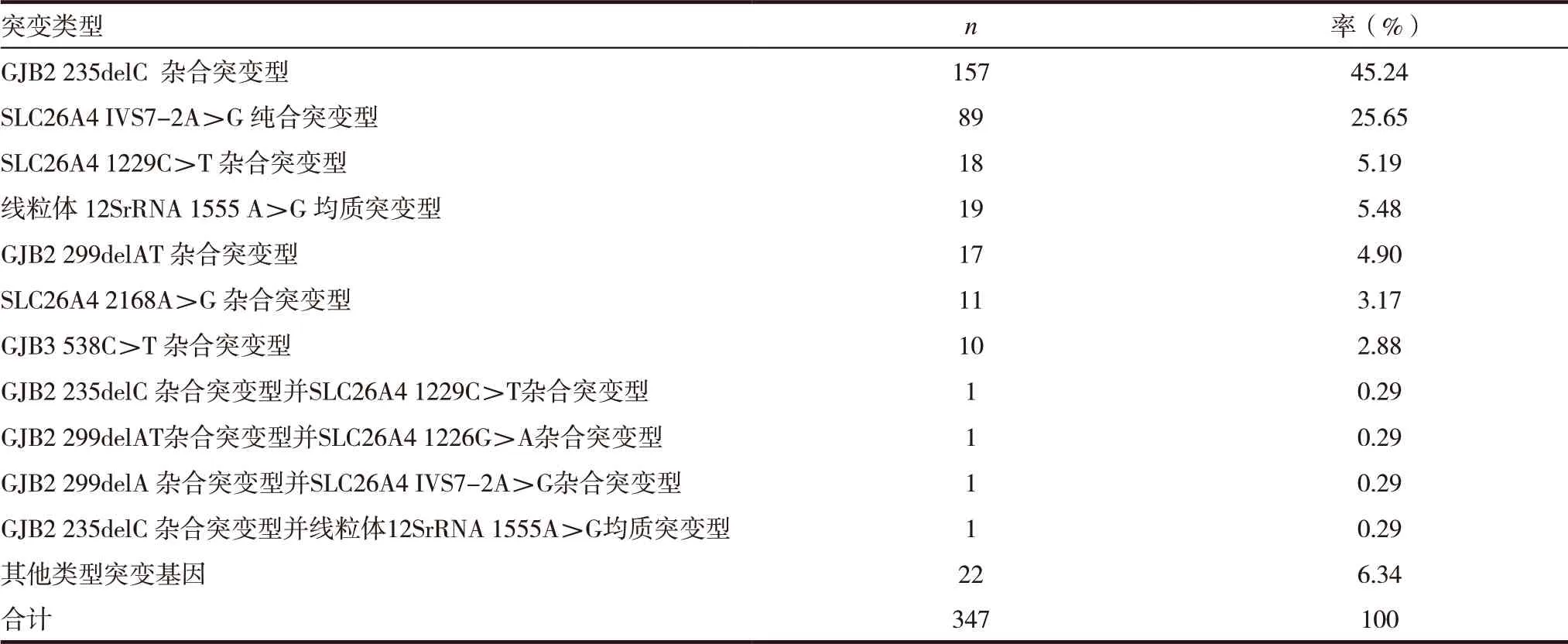
表1 不同类型耳聋易感基因阳性率比较
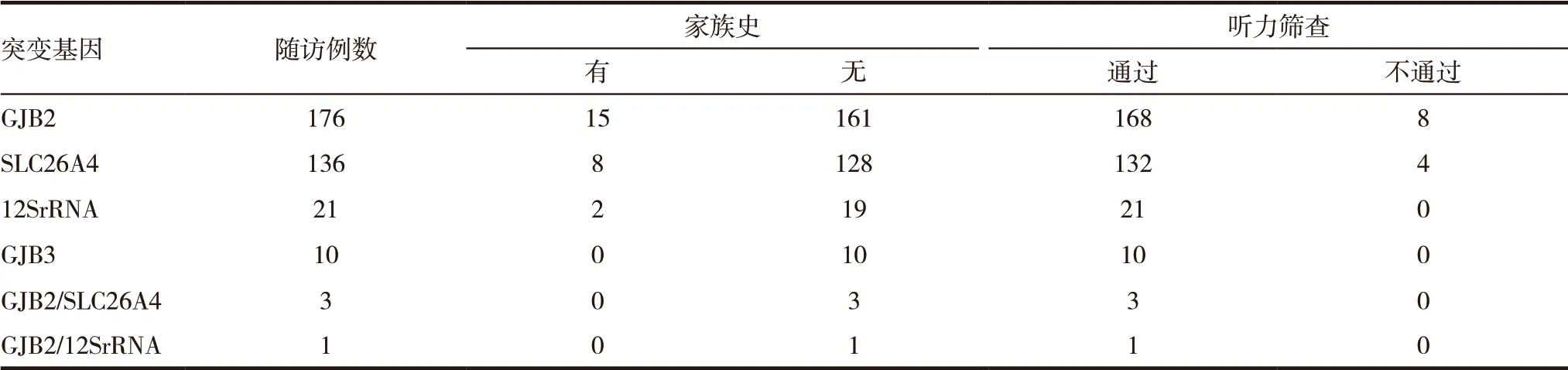
表2 347例耳聋基因阳性新生儿听力初筛结果
1.2.4 听力初筛 新生儿出生后采用耳声发射(OAE)进行听力初筛,初筛结果以“通过”“不通过”表示,不通过初筛的新生儿于出生42h 后回医院体检复查时进行听力复筛,未通过复筛的新生儿于3个月后到五官科进行听力学诊断。
2 结果
2.1 各类耳聋易感基因筛查情况
12 237 例新生儿遗传性耳聋基因突变检测阳 性 共 有347 例 占2.84%(347/12 237),其 中GJB2 235delC 杂合突变型基因为157 例占总阳性45.24%(157/347),SLC26A4 IVS7-2 A >G 纯 合突变型基因89 例占总阳性25.65%(89/347),线粒体12SrRNA 1555A >G 均质突变型基因阳性19 例占总阳性5.48%(19/347),SLC26A4 1229C >T 杂合突变型基因阳性18 例占总阳性5.19%(18/347),GJB2 299delAT 杂合突变型基因阳性17 例占总阳性4.90%(17/347),SLC26A4 2168A >G 杂合突变型基因阳性11 例占总阳性3.17%(11/347),GJB3 538C >T 杂合突变基因阳性为10 例占总阳性2.88%(10/347),其他少见类型突变基因阳性共26例占总阳性7.49%(26/347),其中同时具有2 种基因突变者为4 例占总阳性1.16%(4/347),见表1。
2.2 听力筛查情况
运用耳声发射方法对12 237 例新生儿进行听力初筛,结果初筛单侧不通过或双侧同时不通过例数为235 例,听力初筛阳性率1.92%(235/12 237),听力初筛通过率为98.08%(12 002/12 237)。347例耳聋基因突变阳性新生儿听力筛查显示“未通过”的有12 例:GJB2 235delC 杂合突变型8 例占阳性突变2.30%(8/347),听力初筛阳性基因突变检出率3.40%(8/235)、SLC26A4 IVS7-2A >G 杂合突变型3 例占阳性突变0.86%(3/347),听力初筛阳性基因突变检出率1.28%(3/235)、SLC26A4 1229 C >T 杂合突变型1 例占阳性突变0.29%(1/347),听力初筛阳性基因突变检出率0.43%(1/235),见表2 ~3。
3 讨论
常见耳聋基因突变位点检测有助于明确听力障碍患儿的遗传学病因,并能提早发现迟发性耳聋,避免药物性耳聋,以达到预防后天耳聋发生的目的;初筛耳声发射是一种声能量,它产生于耳蜗,并经过听骨链和鼓膜传导到外耳道,只有在中耳功能正常的前提下才能检测到此声信号;初筛耳声发射的临床意义为提供了一条检测耳蜗放大功能和外毛细胞功能完整性的途经,但它并不能检测出听觉中枢及神经传导通路有无病变;据了解,约1/800 ~ 1/1000 的新生儿在出生时有严重的听力障碍,而出生后1 年内是小儿听觉中枢及语言发育的最关键时期,此时若得不到早期诊断及相应的干预治疗,儿童可能出现听力残疾。对此,卫生部提出把新生儿听力筛查作为保健的常规检查,其中耳声发射是新生儿听力筛查的常用方法,耳声发射包括瞬态诱发耳声发射(TE)和畸变产物耳声发射(DP),将两者结合起来可以避免漏筛,对听力障碍患儿做到早发现、早干预。目前已有一种TE+DP 型二合一耳声发射筛查仪可筛查听力障碍,该仪器在小儿处于睡眠状态下进行,只需3 ~5min 即可完成检查,无创伤,无痛苦,有助于听力障碍患儿早发现、早诊断、早治疗。

表3 12例未通过听力筛查耳聋基因突变阳性结果
本研究中受检的12 237 名新生儿中检出致聋基因突变携带者347 例,总携带率为2.84%,虽然顺德地区致聋基因突变总携带率比成都地区(总携带率为3.19%)低[3],成都地区及顺德地区均是使用博奥生物有限公司提供的微阵列芯片法检测4 个耳聋基因15 个耳聋基因突变位点,包括GJB2 基因(35delG、176del16、235delC、299delAT)、GJB3基 因(538C >T)、SLC26A4 基 因(IVS7-2A >G、2168A >G)、线 粒 体DNA 12SrRNA 基 因(1555A>G、1494C >T);GJB2 基因突变引起的耳聋为常染色体隐性遗传,其中GJB2 235delC 和GJB2 35delG/176del16 分别为犹太人、东亚人和高加索人群最常见的突变位点[4];本研究中我们检出携带GJB2 基因突变者180 例,占所有致聋基因携带人群的51.87%,其突变携带率为1.47%,其中235delC 突变者159 例,突变携带率1.30%,在GJB2 基因突变中占88.33%,这远高于67.7%的Dai 等[5]报道结果,不同地区的突变率不尽相同,其次是299delAT 和176del16突变者20 例,突变携带率为0.16%,在GJB2 基因突变中占11.11%,GJB2 是发病率最高的遗传性致聋基因,GJB2 杂合突变者具有高度的遗传易患性,本研究结果发现GJB2 235del C 突变位点为最常见位点,这与国内的研究文献报道GJB2 基因突变是我国非综合征型感音神经性耳聋的主要致病基因相一致[6-7];耳聋患者的螺旋神经节细胞数量正常,适合人工耳蜗植入,此类患者在耳蜗植入后,言语理解能力强,预后良好。因此,明确GJB2 基因突变致聋的分子病因学原因对新生儿遗传性致聋治疗和预后具有重要意义。
SLC26A4 基因突变引起的耳聋为常染色体隐性遗传,可引起非综合征或综合征型大前庭水管伴感音神经性耳聋,但是在各国和各地区之间存在差异,Tsukada 等[8]报道在美国患者中该突变基因的检出率为20%,东亚地区检出率为5.5%~12.6%,西班牙检出率为27%,法国为40%;本研究中我们检出SLC26A4 基因突变者139 例,占所有致聋基因携带人群的40.06%,其突变携带率为1.14%,是仅次于GJB2 基因突变导致感音神经性耳聋的遗传性病因[9],其中SLC26A4 IVS7-2 突变者90 例,突变携带率0.74%,在SLC26A4 基因突变中占64.75%,患儿感冒、头部轻微撞击、潜水等外界因素均可导致听力的下降,因此对SLC26A4 基因的筛查,可明确诊断,提示对耳聋高危患儿采取严格的防护措施,保护听力免受外界因素影响。
线粒体12SrRNA 基因为母系遗传性基因,对氨基糖苷类抗生素耳毒性具有高度的敏感性,本研究中线粒体12SrRNA 基因突变者22 例,占所有致聋基因携带人群的6.34%,突变携带率0.18%,线粒体12SrRNA 基因突变率极低,明显低于我国线粒体12SrRNA 基因4.4%的携带率[10]。
在正常人群中GJB3 基因的突变频率比较小,胡华梅等[11]未发现GJB3 基因的突变。但在本研究中,检出GJB3 基因突变者10 例,占所有致聋基因携带人群的2.88%,突变携带率0.08%,GJB3 基因突变属于散发性耳聋患病,也要引起高度重视。
本研究运用耳声发射方法对新生儿进行听力初筛,结果初筛单侧或双侧同时不通过为235 例,不通过率为1.92%,稍高于北京市不通过率1.35%[12];其中因基因突变引起听力筛查不通过占5.11%,未通过听力筛查的新生儿是携带耳聋基因突变的高危人群,应引起各临床工作者的高度重视[13],并对患儿家属进行遗传性耳聋相关知识的宣教及育儿指导;Norris 等[14]研究发现,携带有GJB2 纯合突变基因型的新生儿患儿最终确诊听力损失的时间大部分发生在出生后12 ~60 个月,对携带有耳聋基因突变的新生儿应定期进行听力学检测,密切关注其听力变化情况,定期监测,早期诊断,积极治疗原发病,对听力改善是有很大意义[15]。
综上所述,广东省顺德地区新生儿遗传性耳聋基因突变携带以GJB2 突变基因及SLC26A4 突变基因为主,线粒体12S rRNA 基因及GJB3 基因突变均有散发性,本次筛查发现的8 例GJB2 杂合突变型、1 例GJB2 基因纯合突变和3 例SLC26A4 杂合突变型新生儿,听力筛查均“不通过”,进行新生儿遗传性耳聋基因突变筛查和分析,有助于发现高发突变类型,联合听力筛查可以有效提高新生儿遗传性耳聋病的检出,对进一步遗传学研究有指导意义,对本地区遗传性耳聋疾病的早发现、早诊断和早干预具有重要的临床意义。

