基于iTRAQ技术的黄曲霉胁迫花生蛋白质组分析
李春娟闫彩霞王 娟孙全喜苑翠玲单世华赵小波
(山东省花生研究所,山东 青岛 266100)
花生(ArachishypogaeaL.)是世界四大油料作物之一,是人类食用植物蛋白质和植物油的重要来源[1]。我国是世界花生生产大国,占世界花生总产的40%以上,居世界第一位[2]。但是花生产业的进一步发展深受黄曲霉毒素污染的影响。黄曲霉毒素污染可发生在花生全产业链的各个环节,如生长、收获、晾晒、储藏和加工等过程,并容易进入食物链形成累积效应[3],从而危害食品安全。在我国,南方产区黄曲霉毒素污染主要发生在生产环节,而北方产区污染主要发生在收获、加工等过程中[4]。国家近年来提高了花生相关质检标准,加之花生黄曲霉毒素污染问题难以解决,导致我国花生出口受到严重影响[5]。
花生防治黄曲霉毒素污染的方法目前主要有三类:物理方法、生物防治和育种方法。目前认为,培育抗黄曲霉花生品种是控制毒素污染最理想的途径[6]。通过基因工程手段将抗黄曲霉基因导入花生,使花生获得抗黄曲霉性状,是快捷、方便培育抗黄曲霉花生种质的途径。高通量测序是系统整体的研究花生抗黄曲霉分子机制、筛选抗黄曲霉基因的重要方法。目前,已有一些研究利用转录组测序技术分析了花生抗黄曲霉分子机制[7-10]。
但是,基因表达存在转录后调控编辑过程,转录组与蛋白组也存在互作因素,总体而言两者的相关性不高[11]。利用这种差异可以区别真正的mRNA与蛋白质之间的一致性或不一致性,避免出现假阳性,透露出更多的转录后调控情况。目前,关于花生抗黄曲霉蛋白质研究较少,因此本研究应用iTRAQ技术分析黄曲霉侵染下花生蛋白质组表达变化,以期从蛋白质组学的角度分析其抵抗机制,为探明花生抗黄曲霉的机制提供基础。
1 材料与方法
1.1 实验材料与处理
以在以往研究中被证实为高抗黄曲霉品种[8,12]的J11为材料,种植于山东省花生研究所莱西试验基地。所用黄曲霉菌株NRRL3357购自USDA-ARS Culture Collection。菌株在察氏培养基上28℃培养7d,收集菌丝于无菌蒸馏水中。花生田间生长120d后,侵染花生荚果,方法参照本团队的国家发明专利(一种花生种子的黄曲霉田间侵染方法,ZL201510758036.0)。采集侵染0、3、5、7和10d后的花生种皮,混合样品液氮冷冻后保存于-80℃。以0d的花生种皮为对照,设3次重复。
1.2 蛋白质组提取与iTRAQ标记实验
标记实验采用冷丙酮方法提取花生根部组织蛋白质。提取的蛋白质以SDS-PAGE法检测质量。质量合格的样品,每份取蛋白100μg用于后续实验。采用iTRAQ Reagent8 Plex Multi-plex试剂盒(AB Sciex,美国)进行样品处理和标记。混合标记后的样品用C18色谱柱进行分级。采用Thermo ScientificTMVanquishTMUHPLC系统高效液相色谱仪(赛默飞公司,美国)和Orbitrap ID-XTMTribridTM质谱仪(赛默飞公司,美国)进行液相分离和质谱分离。
1.3 生物信息学分析
利用Mascot search engine 2.3.02分析软件(Matrix Science,英国),对质谱的原始数据RAW文件进行定性分析。检索数据库为花生基因组数据库(https://peanutbase.org)。肽段搜库假阳性率FDR设定为1%。设定蛋白的差异倍数(fold change)>1.2或<0. 83,且统计检验p<0. 05为差异表达蛋白(DEPs,different expression proteins)。差异表达蛋白分别进行GO(Gene Ontolog)和KEGG(Kyoto Encyclopedia of Genes and Genomes)富集分析。花生Ahhevamine-A基因生物信息学分析参照本课题组前期的研究[13]。
1.4 Ahhevamine-A基因生物信息学分析
Ahhevamine-A基因编码的蛋白在之前的研究中被证实具有直接抑制黄曲霉菌生长的功能[10]。以Peanut Base(http://peanutbase.org/)上的数据(Arahy.RKK33X)为参考,设计引物5'- ATTAGTTCACAGTCTCTATGC-3'与5'-AAAGTAGGTCTACG-3'扩增其CDS序列。扩增产物与栽培花生基因组中的结果进行比对。使用DNAMAN对扩增后的产物进行生物信息学分析。利用ClustalW软件对Ahhevamine-A基因PCR扩增获得的序列与GenBank中已有序列信息进行比对与排序。选择Kimura 2-parameter公式[14]计算遗传距离。并在MEGA6.0中采用邻近法(Neighbor-Joining,NJ)构建系统树,自举值Bootstrap为1000次重复。
1.5 差异表达蛋白质对应的基因表达模式验证
根据扩增得到的序列,用 Beacon Designer 7.0设计荧光定量PCR特异引物(表1)。依据之前使用的方法,提取花生黄曲霉胁迫的种皮的RNA。使用7500 FAST荧光定量PCR仪(ABI公司)分析14个基因的相对表达情况。反应条件95℃10 s;95℃5 s,60℃30 s,72℃10 s,40个循环;绘制溶解曲线,温度每10 s升高0.5℃。实验设3次重复。相对表达量的计算采用2-ΔΔCT方法[15],选择Actin 11作为内参基因[18],实验数据采用SPSS12.0分析(SPSS Inc., Chicago, USA)。
2 结果与分析
2.1 差异表达蛋白鉴定结果
本试验共获得肽段(unique peptide)5245个。经过基因组数据库筛选,共鉴定了1382个蛋白质。鉴定的蛋白质肽段长度主要分布在7~26。在本研究中,黄曲霉侵染胁迫下共计84个蛋白质的表达发生变化,包括74个上调表达与10个下调表达,差异倍数范围为-1.25~13.04。
2.2 差异蛋白的功能分析

表1 荧光定量PCR所用引物Table 1 Primers used for analysis of gene expression by Real Time-qPCR
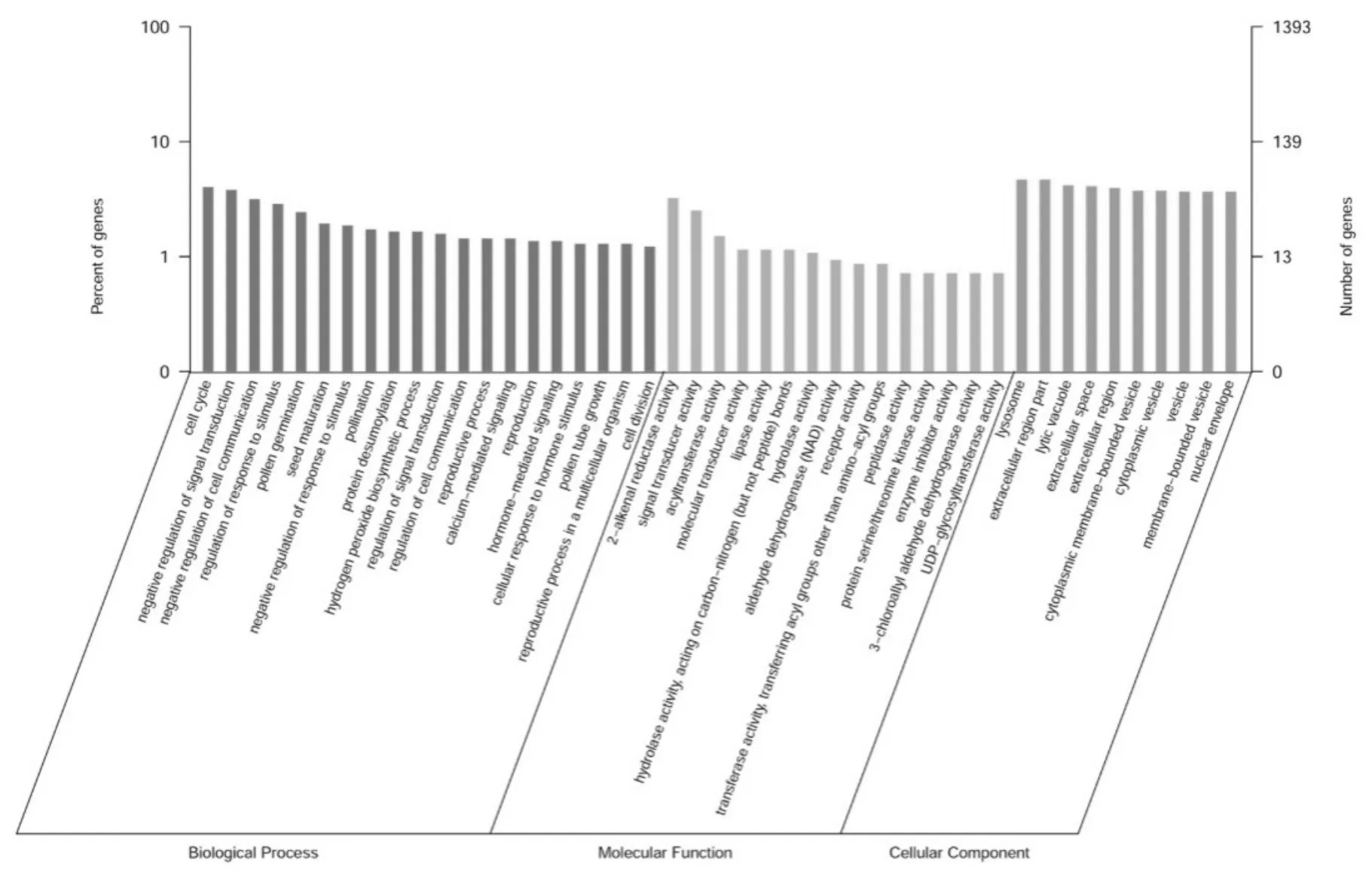
图1 差异表达蛋白GO分析Fig.1 GO classifications of proteins differentially expressed in peanut
对鉴定到的84个差异表达蛋白质进行GO(gene ontology)和KEGG数据库功能分析。其中67个蛋白质GO注释成功,并将注释成功的蛋白质分成细胞组分CC、生物学过程BP和分子功能MF三大类。最为富集的GO项目为“cell cycle”、“negative regulation of signal transduction”、“2-alkenal reductase activity”与“signal transducer activity”。其他一些GO项目也在花生应答黄曲霉侵染中发挥作用,例如“regulation of response to stress”、“detection of external stimulus”和“flavonoid biosynthetic process”(图1)。KEGG分析发现,差异蛋白质主要富集于“plant pathogen interaction”和“lysosome”及“fatty acid metabolism”(图2)。综合GO与KEGG分析的结果, 黄曲霉侵染主要影响花生的代谢通路,且诱导植株抗性机制的运行。
2.3 Ahhevamine-A基因生物信息学分析
经过比对,发现J11的Ahhevamine-A基因序列与栽培花生基因组(Tifrunner)中相关序列一致。Ahhevamine-A基因开放阅读框有1023个碱基,编码蛋白质含有340个氨基酸。其中异亮氨酸、丝氨酸、甘氨酸为含量前三位的氨基酸,分别为36个,29个及26个,占比分别为10.59%,8.53%及7.65%。其编码蛋白的分子量大小为37.981kD、等电点为5.31,其二级结构见图3。由TMpred程序预测该编码蛋白质的跨膜结合区域由内到外为6个、由外到内的跨膜区域为4个(图4)。
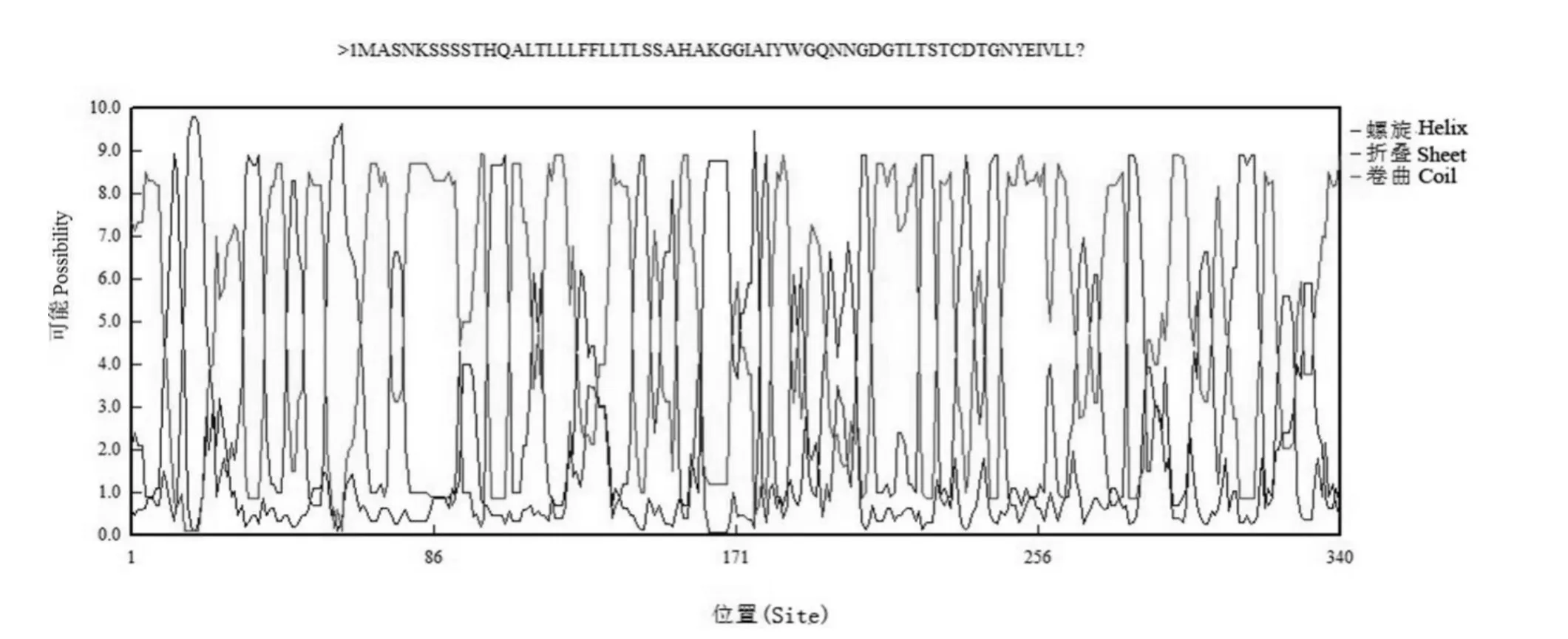
图3 Ahhevamine-A基因氨基酸序列的二级结构Fig.3 Secondary structure of three Ahhevamine-A amino acids

图4 Ahhevamine-A基因氨基酸序列的多肽跨膜结合区域Fig.4 Polypeptide transmembrane binding region of Ahhevamine-A amino acid

图5 Ahhevamine-A序列系统进化树Fig.5 Neighbor-Joining (NJ) phylogeny estimated using Ahhevamine-A sequence
2.4 系统进化分析
利用MEGA软件对Ahhevamine-A基因与部分已知序列在核苷酸水平上进行聚类分析(图5),结果表明,落花生属的几个种聚成一类,显示Ahhevamine-A基因在该属内的保守性较强。分析发现Ahhevamine-A基因与Arachisduranensis和A.ipaensis相关基因的相似度极高,均达99%以上。2016年公布的花生基因组测序结果表明,Arachis duranensis与A.ipaensis经自然杂交,形成了今天栽培花生的祖先。Arachisduranensis的基因组与A亚基因组、A.ipaensis的基因与B亚基因组几乎完全相同[16]。该研究也印证了作为栽培花生,J11的Ahhevamine-A基因与Arachisduranensis及A.ipaensis相关基因高相似度这一发现。
3 讨 论
目前检索的有关花生蛋白质组学方向研究论文,数量较少,且使用的是双向(two-dimensional electrophoresis,2-DE)或单向电泳技术(1-DE)[17-21]。该技术通过切断条带,再用质谱方法测量条带中的蛋白质。但是电泳技术敏感度与精确度相对较低,获取的数据也偏少。iTRAQ技术具有高度敏感性和精确性,可获得相对和绝对定量的蛋白质结果,其操作也较为简便,不需要凝胶[22-23]。
赤霉素是主要的植物激素,且具有调控植物免疫的功能[24]。本研究发现赤霉素相关基因gibberellin20oxidase2-like编码的蛋白在黄曲霉侵染时上调表达,相对于转录组研究的结果,更加证实其在花生响应黄曲霉侵染时的作用。
转录因子在植物响应生物胁迫中发挥重要作用。bZIP转录因子被证实参与了植物响应生物胁迫,并发挥了重要作用[25-26]。本研究发现,一些属于bZIP家族的转录因子,例如bZIP17,在花生受到黄曲霉胁迫时上调表达。这一结果与之前的发现类似[27]。此外,ERF转录因子家族也参与了花生应答黄曲霉胁迫的响应过程。本研究中,ERF9编码的蛋白上调表达,与Wang等[27]的一致。
大量的抗菌蛋白,例如几丁质酶参与了花生抵御黄曲霉菌侵染的过程[28]。几丁质酶可降解细胞壁中的几丁质,从而抑制菌丝的生长。此外,几丁质酶可参与合成例如低聚糖等诱导因子,从而激发植物防御体系[29]。Moore等发现,几丁质酶基因的大量表达是玉米抵御病菌侵染的主要因素。当几丁质酶基因编码的蛋白含量达到20 μg/mL时,黄曲霉菌的生长速率降低了50%;当蛋白含量达到2.0 mg/mL时,黄曲霉菌的含量趋近为0[28]。在本课题组之前的研究中,也发现了花生几丁质酶蛋白具有明显的体外抑制黄曲霉菌生长的特点[10]。

