探究高中化学图像题的解题技巧
◇ 河北 王凤文
融合新课改及核心素养理念的图象题需要学生具备较强的解题思维,学生在解答此类试题的同时,他们的各项能力也得到了发展和提升.高中化学图象题的解答需要一定的技巧,高中化学试题中的图象包括结构图、流程图、坐标图等,常结合化学反应、化学实验等知识综合考查.本文结合2019年高考化学真题中的常见题型,探究此类试题的解题技巧.
1 电解质溶液类题型
电解质溶液类的题型主要包括电解质溶液的稀释、酸碱中和滴定及难溶电解质溶解平衡三个内容,学生在解答时要看清纵坐标和横坐标所代表的量,分析图中出现的点及所对应的数据,结合试题情境中的信息和所学化学知识,即可准确得到答案.

图1
A.混合溶液的导电能力与离子浓度和种类有关
B.Na+与A2-的导电能力之和大于HA 的
C.b 点的混合溶液pH=7
D.c 点的混合溶液中,


在解答图象题时,我们要做到以下几点:看清轴,关注点,分析线,解读面,运用数,掌控律.
看清轴:本题中横坐标表示所加NaOH 溶液的体积,纵坐标表示混合溶液的相对导电能力,可知本题考查的是电解质溶液类题型中酸碱中和反应的定性判断;关注点:a 点是反应的起点,b 点为反应的终点,c 点为添加NaOH 溶液的终点.分析线:图象中的相对导电能力的变化是a 点到b 点缓慢增大,b 点到c点明显增大,说明相对导电能力与离子的浓度和种类是有关的.解读面:图中只有一条曲线,表示相对导电能力随所加溶液体积的变化情况.运用数:本题图象中没有明确的数字,但从题意我们可知,a 点处反应还未开始,此时导电能力最低,b 点时反应结束,导电能力比a 点高但比c 点低,相对于a 点,b 点溶液中Na+的浓度较高,由此可知Na+与A2-的导电能力之和大于HA 的,c 点时所加溶液过量,导电能力最强.掌控律:本题考查导电能力与溶液中离子浓度的关系,需分析图中各点溶液中的主要成分,a 点时溶液中的溶质为KHA,b 点时溶液中的溶质为Na2A、K2A,此时溶液呈碱性,c 点时NaOH 过量,此时溶液中的溶质为Na2A、K2A 和NaOH,溶液中的离子浓度大小关系为c(Na+)>c(K+)>c(OH-).答案为C.
2 化学反应速率类题型
化学反应速率类图象题涉及的数据较多,解答时要分析物质与所给数据之间的关系,要清楚知道化学反应速率随着影响因素的变化产生的变化,主要查考学生对图象的观察能力.
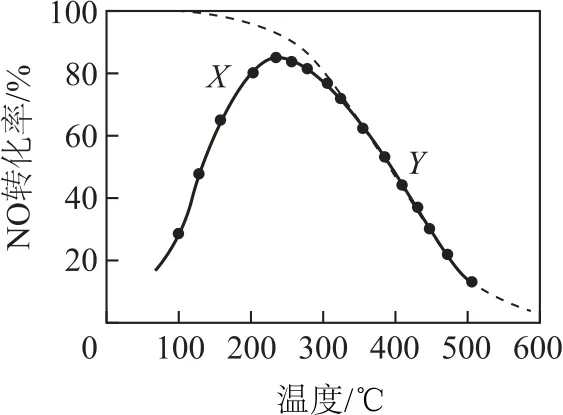
图2
A.反应2NO(g)+O2(g)=2NO2(g)的ΔH >0
B.图中X 点所示条件下,延长反应时间能提高NO 转化率
C.图中Y 点所示条件下,增加O2的浓度不能提高NO 转化率
D.380 ℃下,c起始(O2)=5.0×10-4mol·L-1,NO 平衡转化率为50%,则平衡常数K>2000

本题主要考查温度对化学反应速率的影响.依据图象分析步骤,解读图象和题干.
看清轴:图中的横坐标表示的是温度,纵坐标表示的是NO 的转化率.关注点:图中指出的有2个点,X 点是在化学反应平衡前,Y 点是在化学反应平衡后.分析线:实线表示的是NO 转化为NO2的转化率随温度的变化,先升高后降低,虚线表示的是相同条件下NO 的平衡转化率随温度的变化,两者结合可知,在化学反应达到平衡后,随着温度的升高,NO 的转化率逐渐降低.解读面:图中涉及两条线,实线上的X 点处化学反应正向移动,延长反应时间能提高NO的转化率,实线与曲线重合上的Y 点化学反应已达平衡,O2是反应物,增加其浓度可以使化学反应正向移动,NO 的转化率提高.运用数:依据图象可知,化学反应达到平衡时温度在200~300℃,380℃时反应已达平衡,可依据化学方程式2NO(g)+O2(g)⇌2NO2进行计算.掌控律:本题应用了勒夏特列原理和化学平衡常数计算公式,由勒夏特列原理可知该反应是放热反应,ΔH <0,由化学平衡常数公式可知,K 的计算需要知道达到化学反应平衡时反应物和生成物的浓度,设NO 的起始浓度为x mol·L-1,依据化学方程式可知,NO 的转化率为50%时,化学平衡式NO 的浓度为0.5x mol·L-1,O2的浓度为(5.0×10-4-0.25x)mol·L-1,NO2的浓度为0.5x mol·L-1,计算可知K>2000.因此,本题答案为B、D.
通过对以上试题的分析可知,高中化学图象题一般包括题干、图象和问题三个部分,解答试题的关键在于图象的解读.对于图象中的轴、点、线、面、数、规律的解读都要认真,每一步都事关我们解题能否顺利进行.同样,通过对图象中各个要素的解读会使得所设置问题的解题思路清晰明了,在解读过程中就会把问题解决,进而降低了试题的难度.特别是近几年高考化学试题中图象题题量增加,掌握准确的图象题解题技巧对学生来说是非常必要的.

