与“量”有关的离子方程式的书写技巧与方法
◇ 山东 张丽花
与“量”有关的方程式的书写是教学中的重难点,快速解决此类问题的关键在于厘清思路,熟练掌握书写方法.笔者通过查阅相关文献并结合自身教学体会,对此类题型进行了系统归纳与总结,成果如下.
1 非氧化还原反应方程式的书写
【书写技巧】“以少定多”,即先根据题给条件判断“少量物质”,以少量物质的离子数目(充分反应)确定所需“过量物质”的离子数目.

CO2少量:第1步,“以少定多”,CO2少量,产物为Al(OH)3、,设CO2前面化学计量数为1,先大致写出+CO2→Al(OH)3↓+;第2步,根据电荷、原子守恒可得

CO2过 量:少 量,产 物 为Al(OH)3、,设前面化学计量数为1,先大致写出+CO2→Al(OH)3↓+;根据电荷、原子守恒得+CO2+2H2O=Al(OH)3↓+.

Ca(OH)2少 量:第1 步,“以 少 定 多”,Ca(OH)2少量,设其前面化学计量数为1;第2步,把少量物质拆成离子:Ca2++2OH-,2 mol OH-会消耗2mol,则反应物可写为Ca2++2OH-+,根据电荷、原子守恒得Ca2++2OH-+=CaCO3↓++2H2O.
Ca(OH)2过量:NaHCO3少量,设其前面化学计量数为1;把少量物质拆成离子并去掉不反应的离子得,1molH会消耗1molOH-,生成1 mol水和1mol,1mol消耗1molCa2+,则反应物可写为OH-++Ca2+,根据电荷、原子守恒得Ca2++OH-+=CaCO3↓+H2O.

Ba(OH)2少 量:第1 步,“以 少 定 多”,Ba(OH)2少量,前面化学计量数为1;第2步,把少量物质拆成离子:Ba2++2OH-,OH-少量,首先与反应,不与反应,不参与反应,2molOH-会消耗2mol,生成2mol水和2mol,1molBa2+消耗1mol,则反应物可写为2OH-++Ba2+,根据电荷、原子守恒得2OH-++Ba2+=BaCO3↓++2H2O.
Ba(OH)2过量:NH4HCO3少量,设其前面化学计量数为1;把少量物质拆成离子:+,1mol消耗1 molOH-,1 mol消耗1molOH-,即共消耗2 molOH-,1 molBa(OH)2可提供2molOH-,反应物可写为++Ba2++2OH-,由电荷、原子守恒得:++Ba2++2OH-=BaCO3↓+NH3·H2O+H2O.
2 氧化还原反应方程式的书写
【书写技巧】首先确定反应先后顺序,如向FeI2溶液中通入Cl2,I-先与Cl2发生反应.其次根据用量判断反应程度,如少量Cl2与FeI2溶液反应时只有I-与Cl2反应:2I-+Cl2=2Cl-+I2.最后用“少量定1法”书写离子方程式,即将量少物质的化学计量数定为“1”进行书写.参加反应的物质前面的化学计量数即为反应掉的物质的量的最简整数比.

FeBr2溶液中通入等物质的量的Cl2,设FeBr2的物质的量为a mol,则n(Fe2+)=a mol,n(Br-)=2a mol,n(Cl2)=a mol,还原性:Fe2+>Br-,a molFe2+消耗a molCl2,剩余a molCl2消耗a molBr-,即参加反应的n(Fe2+)∶n(Br-)∶n(Cl2)=1∶1∶1;参加反应的物质前面的化学计量数为反应的物质的量之比,则离子方程式可表示为Fe2++Br-+Cl2=Fe3++Br2+2Cl-,等式两边同时乘以2可得,
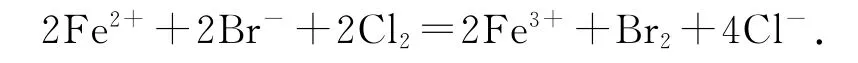
基于以上分析,与“量”有关的方程式的书写,首先应该厘清思路,认真分析题给条件,掌握一些常见的书写技巧与方法,并进行适当的强化训练,即可快速解答该类型题目.

