高考化学计算题的常见类型及解题路径
◇ 北京 孔德靖
《普通高中化学课程标准(2017年版)》在描述学科核心素养和学业质量水平时对定量计算均提出了要求.化学计算融入实验探究、物质及其应用、结构与反应规律、社会发展等主题中,促进了学生对物质组成、结构、性质的认识,提高了学生对基本概念、基本理论和变化规律的理解,发展了学生的定量分析和论证能力.在高考中,化学计算是一个重要的考查点,常出现于解决实际问题的情境中,与科研、生产、生活等密切结合,是学生学习的难点.笔者梳理了近年来高考中常见的几类化学计算题并进行了剖析.
1 求物质的化学式

若能得出钴氧化物中钴元素与氧元素的物质的量之比,即可求出其化学式.根据元素守恒可知,煅烧产物中钴元素与碳元素的物质的量之比为1∶2.
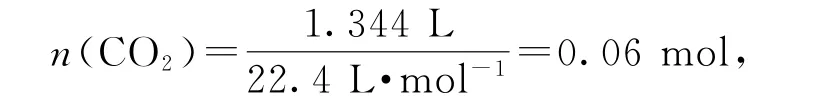
则n(Co)=0.03 mol.那么钴氧化物中氧元素的质量为

所以钴氧化物的化学式为Co3O4.
查阅资料:①由短周期元素组成的抗酸药的有效成分有碳酸氢钠、碳酸镁、氢氧化铝、硅酸镁铝、磷酸铝、碱式碳酸镁铝.
②Al3+在pH=5.0时沉淀完全;Mg2+在pH=8.8时开始沉淀,在pH=11.4时沉淀完全.
实验过程:Ⅰ.向化合物X 粉末中加入过量盐酸,产生气体A,得到无色溶液.
Ⅱ.用铂丝蘸取少量Ⅰ中所得的溶液,在火焰上灼烧,无黄色火焰.
Ⅲ.向Ⅰ中所得的溶液中滴加氨水,调节pH 至5~6,产生白色沉淀B,过滤.
Ⅳ.向沉淀B 中加过量NaOH 溶液,沉淀全部溶解.
Ⅴ.向Ⅲ中得到的滤液中滴加NaOH 溶液,调节pH 至12,得到白色沉淀C.
若上述n(A)∶n(B)∶n(C)=1∶1∶3,则X 的化学式是_____.

该题是基于物质鉴别的化学式计算.加入过量盐酸产生无色气体,结合资料①中抗酸药的有效成分,可知化合物X 是碳酸氢钠、碳酸镁、碱式碳酸镁铝中的一种,气体A 为CO2.根据焰色反应(无黄色火焰)可判断化合物X 不含钠元素.向Ⅰ中所得溶液中滴加氨水至pH 为5~6,产生白色沉淀B,而向B中加过量NaOH 溶液,沉淀全部溶解,结合资料②中Al3+在pH=5.0 时沉淀完全,可知沉淀B 是Al(OH)3.化合物X 含有铝元素而不含钠元素,即X为碱式碳酸镁铝.再向Ⅲ中得到的滤液中滴加NaOH溶液至pH 为12,产生的白色沉淀C为Mg(OH)2.由于n(CO2)∶n(Al(OH)3)∶n(Mg(OH)2)=1∶1∶3.根据元素 守 恒,则 化 合 物X 中n()∶n(Al3+)∶n(Mg2+)=1∶1∶3,结合电荷守恒(阴离子所带的负电荷之和等于阳离子所带的正电荷之和)有可计算出n()∶n(Al3+)∶n(Mg2+)∶n(OH-)=1∶1∶3∶7,故X 为Mg3Al(OH)7CO3.
2 测定样品的纯度或混合物中某物质的浓度
A.取ag混合物充分加热,质量减少bg
B.取ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得bg固体
C.取ag混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,质量增加bg
D.取ag混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得bg固体

该题以选择题的形式考查定量计算.假设混合物中Na2CO3的物质的量为x mol,NaHCO3的物质的量为y mol,只要能列出两个二元一次方程,即可求出x 和y 的值,进而能确定混合物中Na2CO3的质量分数.四个选项中混合物均取ag,可列出方程106x+84y=a.选项A 中,发生反应质量减少的bg,即为生成的水和二氧化碳的质量和,可列出方程(18+44)×=b,所以选项A 的方案正确.选项B中,Na2CO3和NaHCO3均和稀盐酸反应,剩余的稀盐酸加热挥发,通过蒸干、灼烧,bg固体全部为NaCl,根据钠元素守恒可列出方程(2x+y)×58.5=b,选项B 的方案正确.选项D 中,Na2CO3和NaHCO3均与足量Ba(OH)2溶液反应,生成沉淀BaCO3.过滤、洗涤、烘干后得到b g 固体为纯净的BaCO3,根据碳元素守恒,可列方程(x+y)×197=b,选项D 的方案正确.选项C 中,Na2CO3和NaHCO3均与稀硫酸反应,但逸出的二氧化碳中混有水蒸气,碱石灰同时吸收二氧化碳和水蒸气,所以不能根据碱石灰增加的质量列方程,选项C的方案错误.
步骤Ⅰ:移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL.
步骤Ⅱ:移取y mLBaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL.
BaCl2溶液的浓度为_____mol·L-1.

该题利用间接滴定法测定样品中某物质的浓度.步骤Ⅰ和步骤Ⅱ所取Na2CrO4的物质的量完全相同.步骤Ⅰ中,CrO2-4完全与H+反应,消耗盐酸体积为V0mL;步骤Ⅱ中,先与Ba2+反应,待Ba2+完全沉淀后,剩余的再与H+反应,消耗盐酸体积为V1mL;原本能与(V0-V1)mL盐酸恰好完全反应的与Ba2+发生了反应.依据已知的化学方程式可得出关系式:Ba2+~~H+.故样品溶液中

Ⅰ.用已准确称量的KBrO3固体配制一定体积的a mol·L-1KBrO3标准溶液;
Ⅱ.取V1mL上述溶液,加入过量KBr,加H2SO4酸化,溶液颜色呈棕黄色;
Ⅲ.向Ⅱ所得溶液中加入V2mL废水;
Ⅳ.向Ⅲ中加入过量KI;
Ⅴ.用b mol·L-1Na2S2O3标准溶液滴定Ⅳ中溶液至浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗Na2S2O3溶液V3mL.
已 知:I2+2Na2S2O3=2NaI +Na2S4O6,Na2S2O3和Na2S4O6溶液颜色均为无色.
废水中苯酚的含量为_____g·L-1(苯酚摩尔质量:94g·mol-1).

该题比较复杂,是对氧化还原滴定的综合利用,同时体现了无机化学和有机化学的完美融合.“苯酚与溴的反应很灵敏,可用于苯酚的定性检验和定量测定”是人教版化学选修5教材中的原文.步骤Ⅱ中发生了反应+5Br-+6H+=3Br2+3H2O,根据关系式~3Br2,可算出生成的Br2的物质的量:

步骤Ⅲ中废水中的苯酚与溴水发生反应

待苯酚完全反应后,剩余的Br2与加入的过量KI发生反应Br2+2I-=I2+2Br-,生成的I2与Na2S2O3发生反应I2+2Na2S2O3=2NaI+Na2S4O6.
根据关系式Br2~I2~2Na2S2O3,可计算出与KI发生反应的Br2的量:
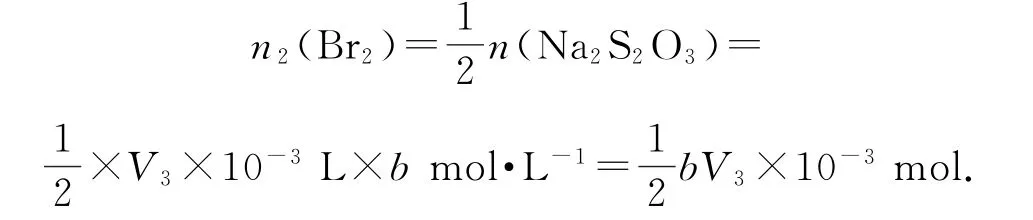
则与苯酚发生反应的Br2的量为:

根据苯酚与溴水反应的化学方程式,可算出废水样品中苯酚的物质的量为浓度为
3 利用电化学原理计算反应后电解质溶液的质量变化

图1 电化学降解


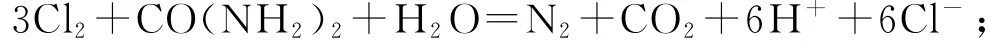

图2 电化学方法除去代谢产物中的尿素
根据电解池的工作原理,右侧为阴极室,阴极的电极反应式为2H++2e-=H2↑或者2H2O+2e-=H2↑+2OH-;左侧为阳极室,阳极的电极反应式为2Cl--2e-=Cl2↑,产生的氯气和尿素进一步发生反应电解质溶液中H+经质子交换膜从左侧的阳极室迁移入右侧的阴极室.若转移了6 mole-时,阴极产生了3molH2,阳极产生了3molCl2,3 molCl2进而与1molCO(NH2)2反应生成了1 molN2和1 mol CO2,即1molCO(NH2)2被除去时会产生5mol气体分子(3molH2、1molN2和1molCO2).故当两极共收集到气体13.44L(标准状况)时,除去的尿素的质量为

4 利用化学平衡常数计算离子浓度

关于化学反应速率、转化率、化学平衡常数等的计算也是常见的题型.该题是利用难溶电解质的溶度积常数来计算溶液中离子的浓度.当有沉淀析出时,溶液达到饱和,溶液中有关离子浓度幂的乘积等于溶度积常数.当溶液中Cl-恰好完全沉淀时,c(Cl-)=1.0×10-5mol·L-1,根据可算出此时c(Ag+)=2.0×10-5mol·L-1.再根据Ksp(Ag2CrO4)=c2(Ag+)·c()=2.0×10-12,可算出c()=5.0×10-3mol·L-1.
化学计算不是考查学生纯粹的数学计算,主要是从物质的量的角度,考查学生对基本概念、基本理论和变化规律的理解和应用,重在提高学生定量研究问题的能力.

