杂色蛤酶解物的降糖活性初步评价及其物质基础研究
,3,3,*,3,*
(1.江苏省海洋药用生物资源研究与开发重点实验室,江苏南京 210023;2.南京中医药大学江苏省中药资源产业化过程协同创新中心,江苏南京 210023;3.南京中医药大学药学院,江苏南京 210023)
杂色蛤[Ruditapesphilippinarum(Adams et Reeve)]是一种分布广泛的药食两用海洋生物,蛤蜊肉性咸、寒,归胃、肝、膀胱经[1]。宋《嘉佑本草》记载,蛤蜊肉“润五脏,止消渴,开胃解酒毒”[2]。研究表明,蛤蜊肉的主要成分为多糖类、蛋白质肽类、核苷类、氨基酸类等[3-4]。蛤蜊肉经水提醇沉得到的粗多糖部分,可降低四氧嘧啶诱导的糖尿病小鼠的血糖、血清胰岛素和甘油三酯水平,具有较好的降血糖作用[5-6]。
近年来,相关研究陆续发现食物来源的降糖活性多肽[7-8],如牛奶[9]、牡蛎[10]、苦瓜等[11-12]。二肽基肽酶-IV(DPP-IV)抑制肽作为重要的一类降糖活性肽受到广泛关注。胰升血糖素样肽-1(GLP-1)作为内源性的脑肠肽,可通过多种途径降低血糖,体内DPP-IV可分解GLP-1使其失活,而DPP-IV抑制肽可通过减少GLP-1降解失活发挥降低血糖的作用[13],食物来源的DPP-IV抑制肽成为近年来健康产品研究的方向之一[14]。课题组前期从杂色蛤的木瓜蛋白酶酶解产物中分离纯化获得4个具有DPP-IV抑制活性的多肽[15]。这些食物来源的生物活性肽具有生物相容性好、安全性高、抑制活性确切等特点[16]。
本文以杂色蛤蛋白质为研究对象[17],通过生物酶水解获得活性多肽类成分,以体外DPP-IV抑制活性评价及HepG-2胰岛素抵抗模型寻找确定降糖活性部分,采用Nano LC-MS/MS技术分析活性肽类组成,以明确杂色蛤降糖活性肽类物质基础,从而促进江苏特色贝类资源的充分开发利用。
1 材料与方法
1.1 材料与仪器
杂色蛤软体 江苏省海洋水产所提供,批号201606;HepG-2细胞 中科院上海细胞库;酸性蛋白酶(50000 U/g)、盐酸罗格列酮 北京索莱宝科技有限公司;CCK-8试剂盒 上海碧云天生物技术有限公司;棕榈酸 日本东京化成工业株式会社;高糖培养基(Dulbecco’s modified eagle medium,DMEM)、低糖DMEM、双抗(Penicilin-Streptomycin,PS)、胰酶 美国Hyclone公司;胎牛血清(fetal bovine serum,FBS) 美国Gibco公司;葡萄糖测定试剂盒(GOD-POD法) 上海荣盛生物药业有限公司;1.5 mol/L Tris-HCl缓冲液 翼飞雪生物科技有限公司;DPP-IV美国Bio Legend公司;甘氨酰脯氨酸对硝基苯胺(Gly-Pro-PNA)、抑二肽素A(Diprotin A,Ile-Pro-Ile) 美国Sigma公司;超纯水 实验室自制;其余试剂 均为分析纯。
BT 125D型电子分析天平 德国Sartorious有限公司;FA2004型电子分析天平 上海上平仪器有限公司;R-210旋转蒸发仪 德国BUCHI公司;SHZ-Ⅲ循环水式真空泵 南京科尔仪器设备有限公司;冷冻干燥器 美国Labconco公司;MP512-01型精密pH计 上海三信仪表厂;MO-AOR型培养箱 美国Major Science公司;Elix Essential5水纯化系统 美国Merck Millipore公司;BB 150二氧化碳培养箱、ST16R台式低温高速离心机 美国Thermo scientific公司;SW-CJ-2FD洁净工作台 苏州净化设备公司。
1.2 实验方法
1.2.1 杂色蛤酶解肽制备工艺流程 工艺流程图如图1所示。
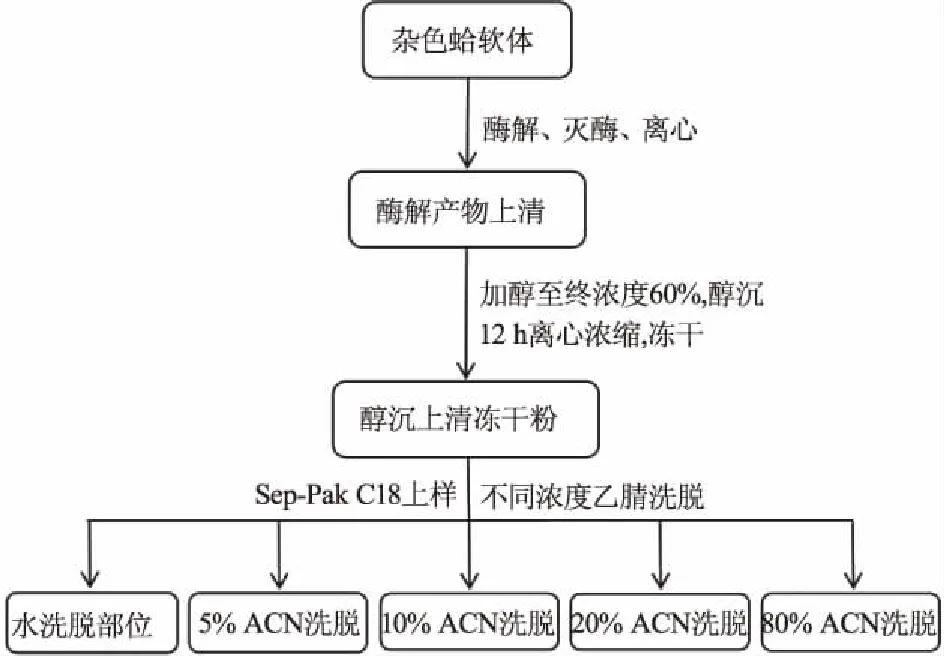
图1 杂色蛤多肽样品制备流程图Fig.1 Flow chart of preparation of peptide sample from Ruditapes philippinarum
1.2.2 杂色蛤不同酶解时间样品的制备 取杂色蛤软体200 g,充分沥干,加入3倍量水充分匀浆处理后,以1 mol/L盐酸调节pH至3.0,平均分为6份,置于下述条件下利用酸性蛋白酶进行酶解:50 ℃,酶底比(E/S)4%,酶解0.5、1.0、2.0、3.0、4.0、5.0 h,酶解结束后,在100 ℃条件下加热灭酶10 min,冷却至室温,离心(5000 r/min,25 ℃)10 min后收集上清,加入乙醇至终浓度为60%,醇沉12 h,离心(5000 r/min,25 ℃)10 min,收集上清,50 ℃旋转浓缩,浓缩至原体积的1/5,冷冻干燥后,得到不同酶解时间的酶解样品,对其体外DPP-IV抑制活性及胰岛素抵抗细胞葡萄糖摄取量进行测定。
1.2.3 杂色蛤不同极性酶解样品的制备 取酶解样品600 mg,用超纯水(含0.1%TFA)复溶,采用Waters Sep-Pak C18固相萃取小柱进行分离,上样后,分别用超纯水、5%、10%、20%、80%乙腈(均含0.1%TFA)进行洗脱,收集不同浓度乙腈洗脱液,分别得到不同乙腈洗脱部分,冻干,以上样品均保存于-20 ℃。
1.2.4 DPP-IV抑制活性评价方法
1.2.4.1 主要溶液的配制 Tris-HCl缓冲溶液配制:Tris-HCl缓冲溶液浓度15 mmol/L,pH8.8,以下简称缓冲液。
DPP-IV、底物Gly-Pro-PNA和阳性药Ile-Pro-Ile配制:取Gly-Pro-PNA粉末约6.64 mg,加入缓冲液配制成浓度为3.2 mmol/L底物溶液;取Ile-Pro-Ile粉末约5 mg,加入缓冲液配制成0.3 mmol/L阳性药溶液;DPP-IV(0.2 mg/mL),加入缓冲液配制成0.1 μg/mL DPP-IV溶液。
1.2.4.2 活性评价 在96孔板中分别加入杂色蛤不同时间酶解样品溶液25 μL、不同极性洗脱样品溶液25 μL、阳性药Ile-Pro-Ile25 μL,再各自加入25 μL底物Gly-Pro-PNA,放入孵育箱37 ℃缓慢振摇10 min充分混合均匀,加入50 μL DPP-IV溶液,此时各样品终浓度为1.25 mg/mL,启动反应,于37 ℃继续孵育1 h,反应结束后迅速加入100 μL 1 mmol/L醋酸钠水溶液终止实验并于405 nm下测量吸光度[18],抑制率计算公式如下:
1.2.5 HepG-2胰岛素抵抗模型评价方法
以往的SEC储量评估工作,在评估单元的增减变化上均以采油厂为限,建立SEC评估单元、建立经济评估参数以采油厂为限;以采油厂(或油公司)为界限提交技术与经济资料已经有数年之久,且经过了不断地调整与完善,为采油厂全面参与SEC储量评估打下了基础。
1.2.5.1 样品溶液配制 取不同酶解时间样品和不同浓度乙腈洗脱部分样品的冻干粉末约10 mg,加入单一培养基(高糖DMEM,以下简称单培)分别配制成10 mg/mL样品溶液,经0.22 μm微孔有机滤膜过滤除菌,-20 ℃保存备用。
1.2.5.2 细胞活性评价 HepG-2细胞接种于完全培养基(高糖DMEM含10% FBS,以下简称全培),于37 ℃、5% CO2培养箱中培养。细胞生长至90%融合时,弃去原培养基,使用PBS洗涤,加入0.25%胰酶,37 ℃消化90 s,消化完成后,于1000 r/min,4 ℃离心5 min。弃去上清,加入全培将细胞沉淀吹打均匀,按2×105cell/mL细胞密度,每孔100 μL接种到96孔板,孵育24 h后,吸去原培养基,开始给药。
将细胞分为空白组、模型组、阳性对照组、给药组;空白和模型组加入180 μL单培,阳性和给药组加入160 μL单培后各加入20 μL 0.2 mg/mL的盐酸罗格列酮溶液和20 μL样品溶液,于孵育箱中孵育30 min后,除空白组加入20 μL全培外,其余各组加入20 μL 1 mg/mL棕榈酸诱导液,诱导24 h后,将各组细胞内培养液更换为新鲜低糖DMEM继续孵育12 h后,采用GOD-POD微量法测剩余葡萄糖浓度,在505 nm下测量剩余葡萄糖含量,利用标准品吸光度(OD)值,计算葡萄糖消耗量[19-20]。
1.2.6 Nano-LC MS/MS分析
1.2.6.1 多肽分析 色谱条件:戴安U3000 nano RSLC纳升液相系统,Reprosil C18AQ色谱柱(75 μm×150 mm,5 μm);上样量5 μL;流速400 nL/min;流动相A为乙腈-甲酸-水溶液(2∶0.2∶98,V/V),B为乙腈-甲酸-水溶液(80∶0.2∶20,V/V);线性梯度洗脱:2%~30% B,140 min[21]。
质谱条件:选用 Thermo Q-Exactive Orbitrap MS质谱仪进行肽段分析,喷雾电压2.5 kV,离子传输毛细管温度200 ℃;质谱一级全扫描范围为m/z 100~2000,分离宽度为3 Da;串联质谱分析首先获得总离子色谱图(TIC),通过碰撞诱导解离(CID)将双电荷离子碎裂,并产生一系列二级质谱MS/MS谱。
1.2.6.2 数据库比对 串联质谱数据采用MaxQuant软件进行搜库分析鉴定,选择软体动物门数据库(Mollusca,2019年7月下载于 www.uniprot.org);检索参数:前体离子误差20 ppm,子离子误差0.2 Da;Deamidation(N,Q),允许2个位点误切,假阳性率(FDA)≤1%;酶切方式:unspecific;其他为默认参数[22],在上述检索条件下所得分值有显著性意义(P<0.05),被认定为有效的鉴定结果。
1.3 数据处理
2 结果与分析
2.1 不同酶解时间样品活性评价结果
如图2A所示,与其它酶解时间样品相比,在终浓度为2.5 mg/mL时,酶解1 h样品具有更好的DPP-IV抑制活性,抑制率可达63.13%±3.50%,抑制率显著高于其余各组(P<0.05);图2B显示,在终浓度为1 mg/mL时,不同酶解时间样品对于棕榈酸诱导的HepG-2胰岛素抵抗模型均具有极显著的促进葡萄糖消耗的作用(P<0.01),除酶解5 h样品效果相较其他组较差之外(P<0.05),其余各组之间没有明显差异,葡萄糖的消耗量均处于36%左右。综合两种评价模型结果,酶解1 h样品活性最佳,故选酶解1 h样品进行后续分离研究。
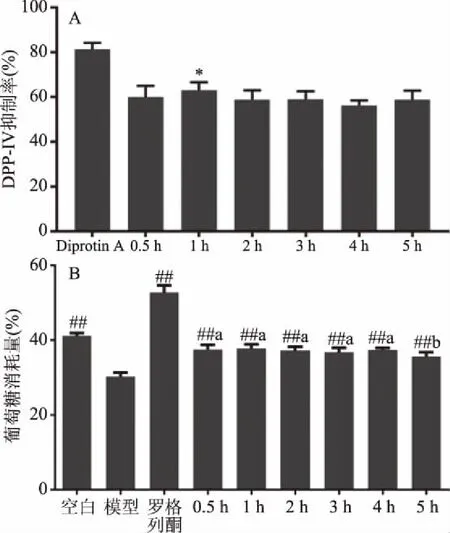
图2 不同酶解时间样品(A)DPP-IV抑制率和(B)葡萄糖消耗量Fig.2 DPP-IV inhibition rate(A)and glucose consumption of samples from different enzymatic time注:图A中*表示1 h样品组与其他样品组差异显著P<0.05;图B中,与模型组相比,##表示差异极显著P<0.01;不同小写字母表示0.5~5 h样品组差异显著P<0.05。
2.2 不同洗脱部位活性评价结果
对于酶解1 h样品的不同浓度乙腈洗脱部分的DPP-IV抑制活性评价如图3所示,在终浓度为1.25 mg/mL的情况下,10%乙腈洗脱部分具有最佳抑制活性,且极显著高于其余三组(P<0.01),抑制率为43.12%±2.01%(图3A)。在促进细胞葡萄糖摄取方面,给药浓度为1 mg/mL的情况下,相较于其他样品组及模型组,10%乙腈洗脱部分能够明显提升细胞葡萄糖消耗量,此时10%乙腈洗脱部分葡萄糖消耗量为38.50%±3.14%(图3B),效应优于其他部分(P<0.01)。综合以上结果,对10%乙腈洗脱部分进行成分分析鉴定。
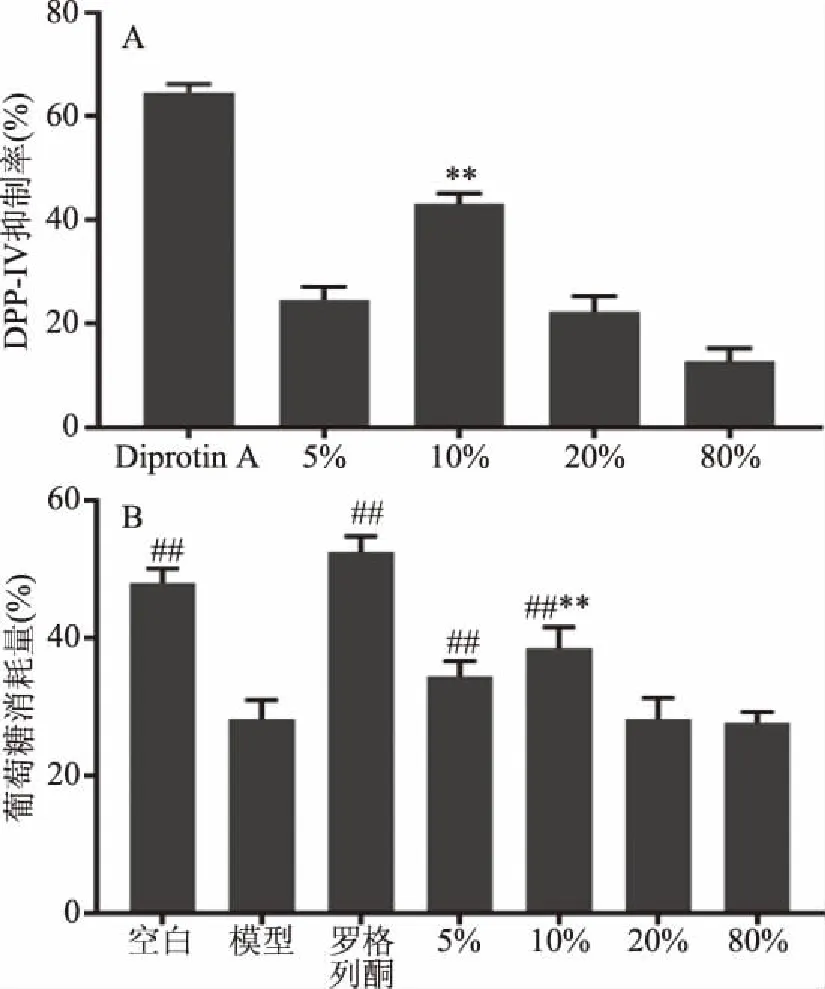
图3 不同浓度乙腈洗脱样品DPP-IV抑制率(A)和葡萄糖消耗量(B)Fig.3 DPP-IV inhibition rate(A)and glucose consumption of samples eluted with different concentrations of acetonitrile注:**表示10%样品组与其他样品组差异极显著P<0.01;图B中,与模型组相比,##表示差异极显著P<0.01。
2.3 Nano-LC MS/MS分析
采用Nano-LC MS/MS对10%乙腈洗脱部分进行多肽成分分析鉴定,结合MaxQuant搜库软件共鉴定出114种多肽,并确定了相应序列,已知质谱数据和数据库中的数据越吻合所得分数(Score)越高[23],本文列出了得分最高的前20种多肽为例(表1),经鉴定这些肽段主要来自肌球蛋白、肌动蛋白、微管蛋白、组蛋白等。
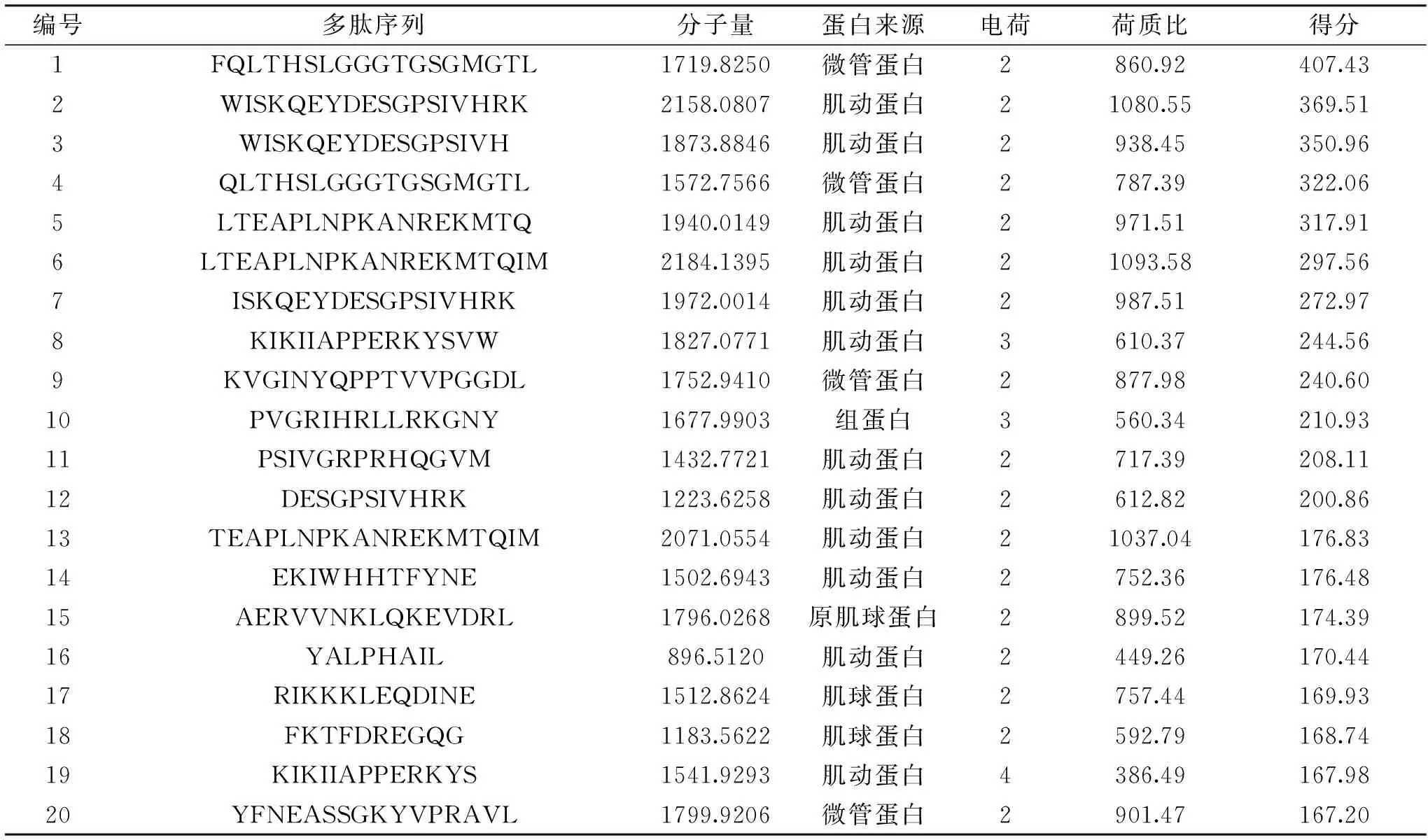
表1 得分最高的前20种多肽Table 1 Top 20 peptides with the highest score
以肽段YALPHAIL为例,该肽段[M+H]2+m/z 1719.825,MS/MS(图4A)显示其主要碎片离子有b7+(766.4246)、b6+(653.3406)、b5+(582.3035)、b3+(348.1918)、b2+(235.1077)、y1+(132.1019)、y2+(245.186)、y3+(316.2231)、y4+(453.282)、y5+(550.3348)、y6+(663.4188)、y7+(734.4559),经搜库可确定该肽段来自肌动蛋白,具体位置见图4B。综合信息显示,质谱数据与数据库吻合,确定肽段的氨基酸序列为YALPHAIL。

图4 YALPHAIL的MS/MS(A)及YALPHAIL在肌动蛋白中的位置(B)Fig.4 MS/MS(A)and location in Actin(B)of YALPHAIL
共统计到114个肽段中每种氨基酸残基的出现频次(图5C),其中亲水性氨基酸为822个,疏水性氨基酸为641个;数量最多前5种氨基酸分别是:亲水性氨基酸赖氨酸(Lys,119个)、精氨酸(Arg,112个)、谷氨酸(Glu,106个)和疏水性氨基酸亮氨酸(Leu,120个)、异亮氨酸(Ile,111个)。总体而言,亲水性氨基酸数量多于疏水性氨基酸数量,比例接近1.3∶1。结合亲水平均值(GRAVY)来评估肽段的亲水性和疏水性(图5A),GRAVY值低于0显示为亲水性,结果显示在鉴定出的多肽中,83.3%为亲水性多肽,但其中25%的肽段N端具有2个疏水氨基酸,85%的肽段N端至少含有1个疏水氨基酸,研究证明位于肽段N-末端侧的两个氨基酸的疏水性与肽的DPP-IV抑制效力正相关[24-25],由此可见,10%乙腈洗脱部位具有发掘高DPP-IV抑制肽的潜力。对多肽分子量分布情况进行统计(图5B),发现所鉴定的多肽分子量(MW)主要分布在811.38~2658.40 Da,其中90.4%的肽分子量低于2000 Da,研究发现二肽,三肽或10~20个氨基酸组成的短肽易被人体完整吸收而发挥生物活性[26-27],表明所鉴定出的这些低分子量的短肽具有穿过膜屏障而发挥生物效应的可能。
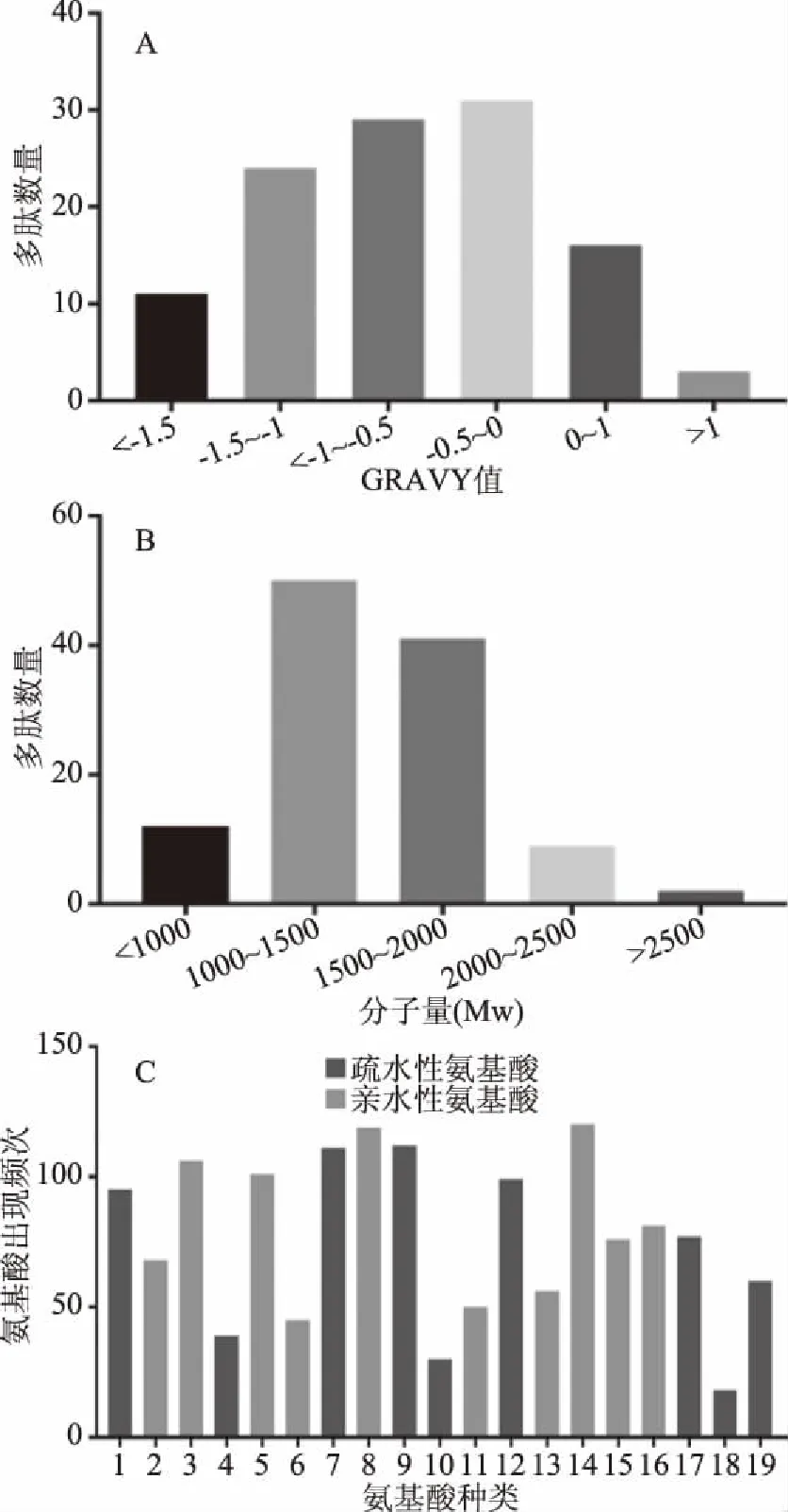
图5 肽的鉴定Fig.5 The identified peptide注:A:亲水平均值(GRAVY)指数值;B:鉴定的肽的分子量(MW)分布;C:鉴定的肽中所有氨基酸的出现频率;1~19分别表示:丙氨酸、天冬氨酸、谷氨酸、苯丙氨酸、甘氨酸、组氨酸、异亮氨酸、赖氨酸、亮氨酸、蛋氨酸、天冬酰胺、脯氨酸、谷氨酰胺、精氨酸、丝氨酸、苏氨酸、缬氨酸、色氨酸、酪氨酸;所有的值都基于肽的总数。
3 结论
本文使用两种模型:DPP-IV体外抑制模型和HepG-2棕榈酸诱导的IR模型,前者是DPP-IV能够剪切去除底物Gly-Pro-PNA氨基末端第2个氨基酸为脯氨酸(Pro),使PNA游离显色[28],最终以显色的吸光度值比较DPP-IV的被抑制效果;选择后者的原因主要是因为糖尿病患者产生胰岛素抵抗的原因是不尽相同的,棕榈酸长时间作用使细胞产生胰岛素抵抗[29],是目前广泛使用的体外胰岛素抵抗模型,造模简便快捷,效果明显。
本实验发现杂色蛤酶解产物的10%乙腈洗脱部分具有最佳的抑制DPP-IV,增加细胞葡萄糖摄取作用,经质谱鉴定发现10%乙腈洗脱部分含有的一系列分子量较低的肽段,其中83.3%为亲水性多肽,与洗脱极性相对应。但DPP-IV 抑制肽通常含有较高比例的疏水性氨基酸,疏水性氨基酸可能会加强与DPP-IV的S1疏水口袋的作用,肽段N-末端侧的前两个氨基酸的疏水性与多肽的DPP-IV抑制效力呈正相关[24-25],10%乙腈洗脱部分中85%的肽段N-末端侧的前两个氨基酸中至少含有1个疏水氨基酸,结果表明,10%乙腈洗脱部分的DPP-IV的抑制作用与其N-末端的疏水氨基酸相关。
另外,通过前期两种评价模型数据可以看到,10%乙腈洗脱部分确实在两种模型中均表现出最佳的活性,表明10%乙腈洗脱部分是两者模型的活性重合部位,10%乙腈洗脱部分可能通过DPP-IV相关途径发挥降糖作用,这将在后续实验中对这一假设进行验证。
后续可对10%乙腈洗脱部分进行进一步的分离纯化,得到单一或多个肽段,结合分子对接技术[30]研究对DPP-IV的抑制作用影响,并联系细胞实验与在体实验,将对10%乙腈洗脱部分的降糖作用机理进行深入研究,验证蛤蜊酶解肽的DPP-IV抑制作用及其发挥降糖功效之间的联系。

