植物乳杆菌ZU018增殖培养基的优化
金玉洁,何国庆
(浙江大学生物系统工程与食品科学学院,浙江杭州 310058)
植物乳杆菌(Lactobacillusplantarum)属于乳杆菌科乳杆菌属,是一种同型发酵乳酸菌,革兰氏染色呈阳性,不产芽孢,且兼性厌氧,具有很强的发酵碳水化合物的能力,较耐盐、耐酸[1]。其最适生长温度为30~35 ℃,最适pH在6.5左右,在MRS培养基中菌落形态均为白色圆形凸起菌落,有大有小。植物乳杆菌作为一种重要的益生菌,具有改善食品风味[2]、增强免疫力[3]、调节肠道健康[4]、降低胆固醇[5]、改善焦虑抑郁[6]等功能,在食品发酵、工业发酵及医疗保健等领域都有着广泛的应用。获得高密度植物乳杆菌对其商业化生产具有重要作用。
高密度培养是一个相对的概念,通过一定的培养技术和装置使得菌体的发酵密度较普通培养有显著性提高,从而提高特定产物的生产率[7]。影响植物乳杆菌生长的因素有很多,如菌种活力、培养代数、培养周期、培养基、培养温度以及接种量等[8]。植物乳杆菌的高密度培养一般采用补料、膜过滤、细胞固定化等方式来减少代谢废物对植物乳杆菌生长的抑制,提高菌体密度,但这些方法往往较为复杂且成本较高[9]。相比来说,培养基的成分优化获得高密度细胞是最为经济、有效的途径。梁璋成等[10]采用均匀设计及正交试验优化植物乳杆菌R23培养基,结果显示在培养基中引入苹果酸钠,增菌效果明显。蔡丽丽等[11]利用响应面法对植物乳杆菌培养基成分中的碳源、缓冲溶剂、氮源进行了优化,确定最终菌液光密度 OD600最大为 2.0577。郝永伟等[12]对植物乳杆菌高效培养基碳源进行优化后发现蔗糖能部分替代葡萄糖作为碳源,节约了成本。
根据植物乳杆菌的生长特点,本文探究了培养基成分对植物乳杆菌生长繁殖的影响,确定了优化培养基配方,提高植物乳杆菌的菌体密度,为今后植物乳杆菌高密度发酵提供了依据。
1 材料与方法
1.1 材料与仪器
植物乳杆菌ZU018 由浙江大学生物系统工程与食品科学学院食品微生物实验室筛选并鉴定,于15%(V/V)甘油的MRS培养基中-80 ℃冻存,保藏编号为J-180312;MRS液体培养基 蛋白胨10 g/L、牛肉浸膏5 g/L、酵母浸粉4 g/L、葡萄糖20 g/L、磷酸氢二钾2 g/L、乙酸钠5 g/L、柠檬酸三铵2 g/L、硫酸镁0.2 g/L、硫酸锰0.05 g/L,吐温80 1.0 mL,pH6.2~6.4,用蒸馏水定容至1000 mL,121 ℃灭菌15 min;MRS固体培养基 MRS液体培养基中加入质量浓度为1.5%~2%的琼脂粉,121 ℃灭菌15 min,用于活菌计数;基础培养基 MRS培养基根据实验设计调整各组成分的种类及含量。
Multiskan GO全波长酶标仪 赛默飞世尔科技(中国)有限公司;LRH-250生化培养箱 上海一恒科学仪器有限公司;BSA124S电子天平、PB-10 pH计 德国Sartorius;YXQ-LS-50 SII立式压力蒸汽灭菌锅 上海博迅实业有限公司;UPR纯水仪 西安优普(Ulupure)仪器设备有限公司;SW-CJ-1D超净工作台 苏州苏洁净化设备公司。
1.2 实验方法
1.2.1 菌种活化 将甘油冻存的菌种划线于MRS固体培养基上,37 ℃培养24 h后挑取单菌落于MRS液体培养基中,静止培养24 h。再以2%的接种量接种于MRS液体培养基中,活化两代,即得实验用活化菌种。
1.2.2 活菌数的测定 发酵液中活菌数的测定采用稀释平板计数法,参照陈燕飞[13]的方法。
1.2.3 发酵培养基成分优化
1.2.3.1 单因素实验 碳源及添加量:分别以20 g/L的麦芽糖、葡萄糖、蔗糖、复配比为1∶1的蔗糖和葡萄糖(m/m)、D-果糖、山梨醇替换基础培养基中的碳源,2%接种量,37 ℃下培养18 h,测定活菌数,确定最佳碳源;将最佳碳源分别以10、15、20、25、30 g/L的浓度加入到基础培养基中,2%接种量,37 ℃下培养18 h,测定活菌数,确定最佳添加量。
氮源及添加量:分别以20 g/L的大豆蛋白胨、蛋白胨、胰蛋白胨、酵母浸粉、牛肉浸粉替换基础培养基中的氮源,2%接种量,37 ℃下培养18 h,测定活菌数,确定最佳单一氮源;在此基础上,将其他有机氮源分别与最优单一氮源进行复配,复配比为1∶1 (m/m),2%接种量,37 ℃下培养18 h,测定活菌数,确定最佳复合氮源;将最佳氮源分别以20、30、40、50、60 g/L的浓度加入到基础培养基中,2%接种量,37 ℃下培养18 h,测定活菌数,确定最佳添加量;在最佳氮源及添加量的基础上,选择1∶2、1∶1、2∶1的氮源复配比配制培养基,2%接种量,37 ℃下培养18 h,测定活菌数,确定最佳复配比。
1.2.3.2 部分因子实验设计(Fractional factorial design,FFD) 相关研究表明,磷酸氢二钾、乙酸钠、柠檬酸三铵作为培养基中的缓冲盐,与细胞生物量密切相关[7],因此,在单因素实验所筛选出的碳源和氮源的基础上,选取磷酸氢二钾、乙酸钠、柠檬酸三铵为缓冲盐,采用部分因子实验初步确定培养基中的这些组分对植物乳杆菌ZU018生长影响最为重要的三个因素,根据单因素实验结果,应用Design Expert 10软件对培养基组分进行部分因子实验设计,如表1所示。
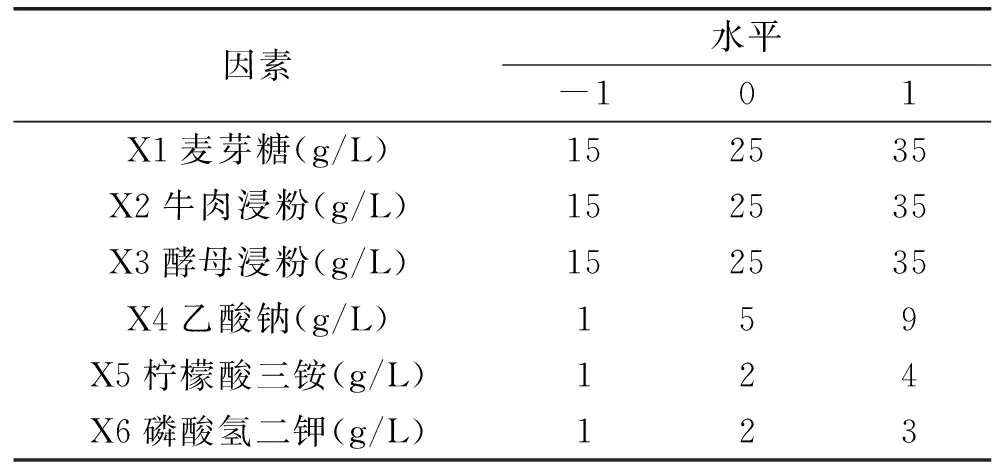
表1 部分因子实验因素水平表Table 1 Factors and levels of FFD
1.2.3.3 最陡爬坡路径实验(Path of steepest ascent) 基于1.2.3.2筛选出对活菌数影响显著的因素,对实验数据平均值与中心点试验数据的平均值进行方差分析检验,若结果表明不显著,这说明最优点不在实验范围之内,需进行最陡爬坡实验,通过各显著因素的正负效应来确定最陡爬坡试验的路径(包括变化方向及变化步长),快速的逼近最大响应区域[14],其中,显著影响因素以部分因子实验设计的0水平为基础步移[15]。
1.2.3.4 Box-Behnken Design试验(BBD) 基于1.2.3.2与1.2.3.3,进行Box-Behnken设计试验,以部分因子实验筛选得到的对植物乳杆菌ZU018活菌数具有显著影响的因素作为设计因子,以最陡爬坡路径试验活菌数最多时的变量值作为中心点,对实验结果进行响应面分析,实验因素及水平如表2所示。

表2 Box-Behnken中心组合试验因素水平表Table 2 Factors and levels of BBD
为了验证模型预测值与实际值之间的偏差,利用优化培养基对植物乳杆菌ZU018进行培养,测定最终活菌数。
1.3 数据处理
所有试验数据均重复三次。采用Design Expert 10.0设计软件进行实验设计,并对试验数据作回归分析;采用SAS(Version9.4)统计软件进行显著性差异分析,P<0.05即认为存在显著性差异;采用Origin8.5.1软件进行绘图,采用Microsoft Excel 2016软件进行数据计算。
2 结果与分析
2.1 单因素实验
2.1.1 培养基成分的优化
2.1.1.1 不同碳源对植物乳杆菌ZU018生长的影响 合适的碳源有利于细胞的吸收和利用,加快微生物增殖。常见碳源有糖类、低碳醇和油脂等[16],本实验选取麦芽糖、葡萄糖、蔗糖、果糖、山梨醇为碳源,研究其对植物乳杆菌ZU018生长的影响。
不同碳源的培养基对植物乳杆菌ZU018活菌数的影响具有显著性差异(P<0.05),如图1所示。麦芽糖作为碳源时,植物乳杆菌ZU018活菌数最高,达到5.68×109CFU/mL。果糖及山梨醇作为碳源时,活菌数较低。张岩春等[17]发现果糖为促进植物乳杆菌C88生长最为合适的碳源,刘香英等[18]发现当葡萄糖与蔗糖的比例为1∶1时,有利于植物乳杆菌K25的生长,但本实验中果糖、蔗糖等对植物乳杆菌ZU018的增殖并无明显优势,麦芽糖更符合植物乳杆菌ZU018的生长需要。初步确定麦芽糖作为植物乳杆菌ZU018的碳源。
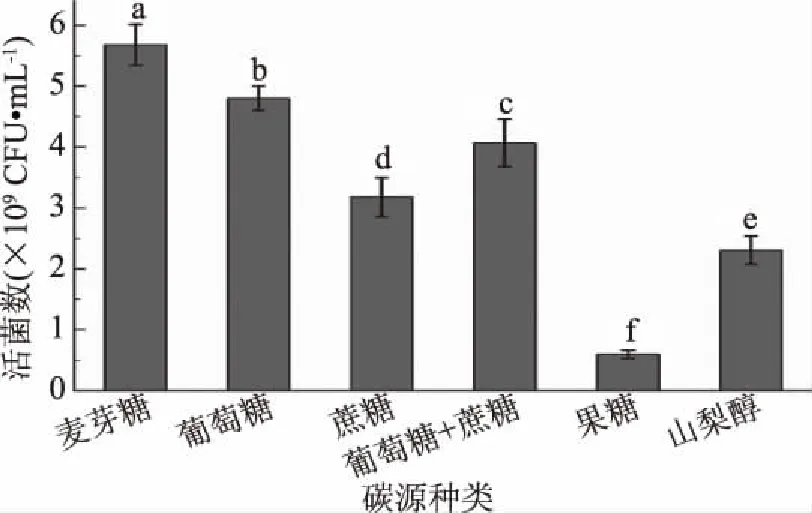
图1 不同碳源对植物乳杆菌ZU018生长的影响Fig.1 Effect of different carbon source on the growth of Lactobacillus plantarum ZU018注:不同小写字母表示具有显著性差异(P<0.05);图2~图4同。
2.1.1.2 碳源浓度对植物乳杆菌ZU018生长的影响 如图2所示,随着麦芽糖浓度的增加,植物乳杆菌ZU018的活菌数逐渐增加,当浓度达到25 g/L时,活菌数最大,达到5.74×109CFU/mL,麦芽糖的浓度增加到30 g/L,活菌数反而有所下降,这可能是因为过高的糖浓度会导致培养环境偏酸性化,从而抑制了植物乳杆菌ZU018的生长[19]。选择以25 g/L的麦芽糖为植物乳杆菌ZU018的碳源。
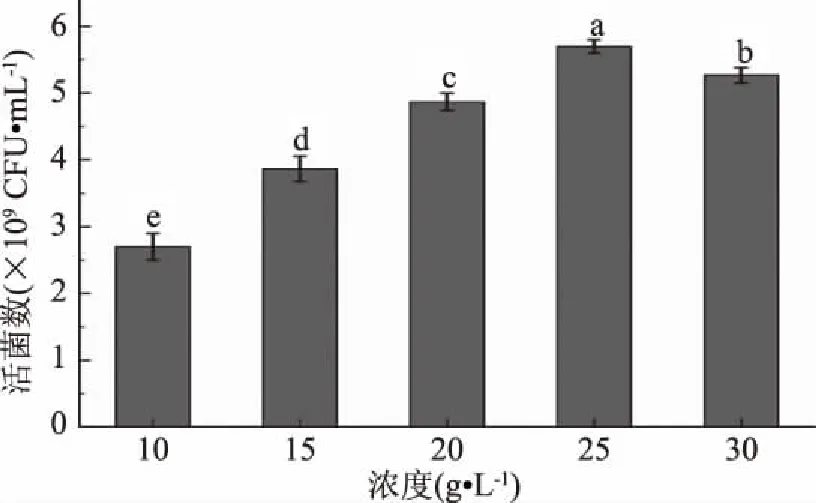
图2 碳源浓度对植物乳杆菌ZU018生长的影响Fig.2 Effect of concentration of carbon source on the growth of Lactobacillus plantarum ZU018
2.1.1.3 不同氮源对植物乳杆菌ZU018生长的影响 不同环境中的乳酸菌具有菌株和环境特异的氮代谢系统,氮源的利用是制约乳酸菌生长的关键因素[20]。不同种类的氮源经过不同的水解工艺后,会产生不同组成的氨基酸、寡肽和多肽,此外,有机氮源往往还会含有少量的糖类、脂肪、无机盐、维生素及某些生长因子,更能促进微生物的生长[21]。本实验选取大豆蛋白胨、蛋白胨、胰蛋白胨、酵母浸粉和牛肉浸粉为氮源,研究其对植物乳杆菌ZU018生长的影响。
不同氮源的培养基对植物乳杆菌ZU018活菌数的影响具有显著性差异(P<0.05),如图3A所示。酵母浸粉作为氮源,活菌数最高,此外,牛肉浸粉作为氮源也能获得较高的活菌数。朱奇奇等[22]分析了5种有机氮源对植物乳杆菌I4菌体密度的影响,其结果也表明酵母浸粉最适宜该菌的增殖培养。
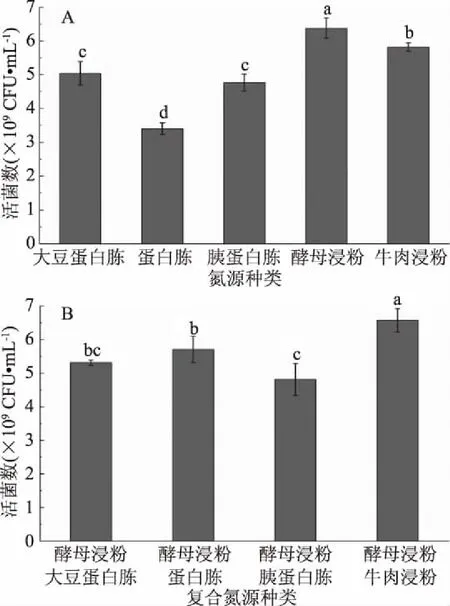
图3 不同氮源对植物乳杆菌ZU018生长的影响Fig.3 Effect of different nitrogen source on the growth of Lactobacillus Plantarum ZU018
与单独使用有机氮源培养植物乳杆菌ZU018相比,多数使用有机混合氮源进行培养的实验组,活菌数有所增加,如图3B所示,这与韩爽等[23]的研究结果相似。以牛肉浸粉和酵母浸粉作为混合氮源培养时,活菌数最高,达到6.58×109CFU/mL,且高于仅以牛肉浸粉或酵母浸粉作为单一氮源。初步确定以复配比为1∶1 (m/m)的牛肉浸粉和酵母浸粉作为植物乳杆菌ZU018的氮源。
2.1.1.4 氮源浓度对植物乳杆菌ZU018生长的影响 氮源浓度对菌体生长、产物和副产物的代谢均有着重要影响[24]。氮源含量过低,菌体生长会因营养不足受到影响;氮源含量过高,则会使微生物生长过快,容易导致细胞老化和自溶[25]。合适的氮源浓度对菌体生长至关重要。如图4A所示,随着氮源总量的增加,活菌数也逐渐增加,复合氮源浓度为50 g/L时,活菌数最高。
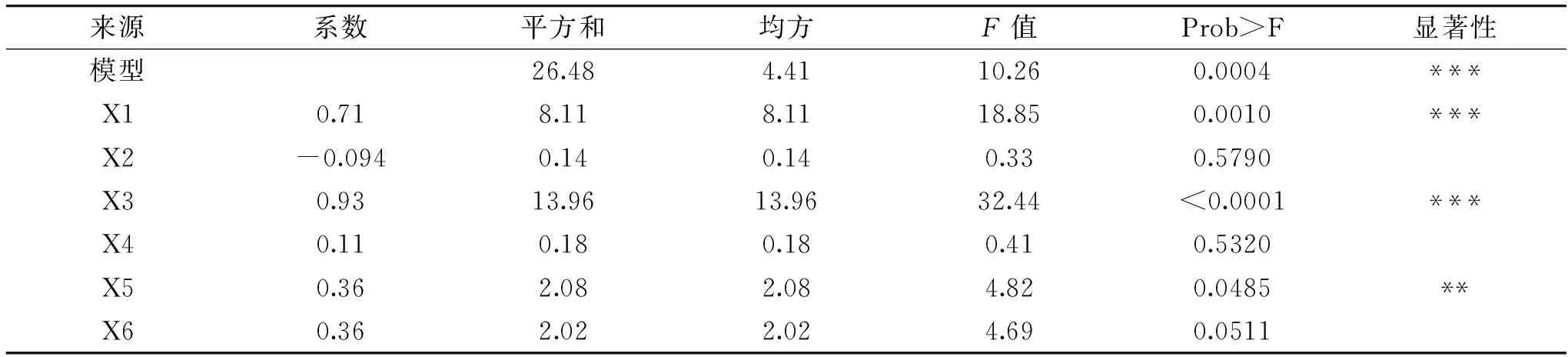
表4 部分因子实验回归分析结果Table 4 Regression results of FFD
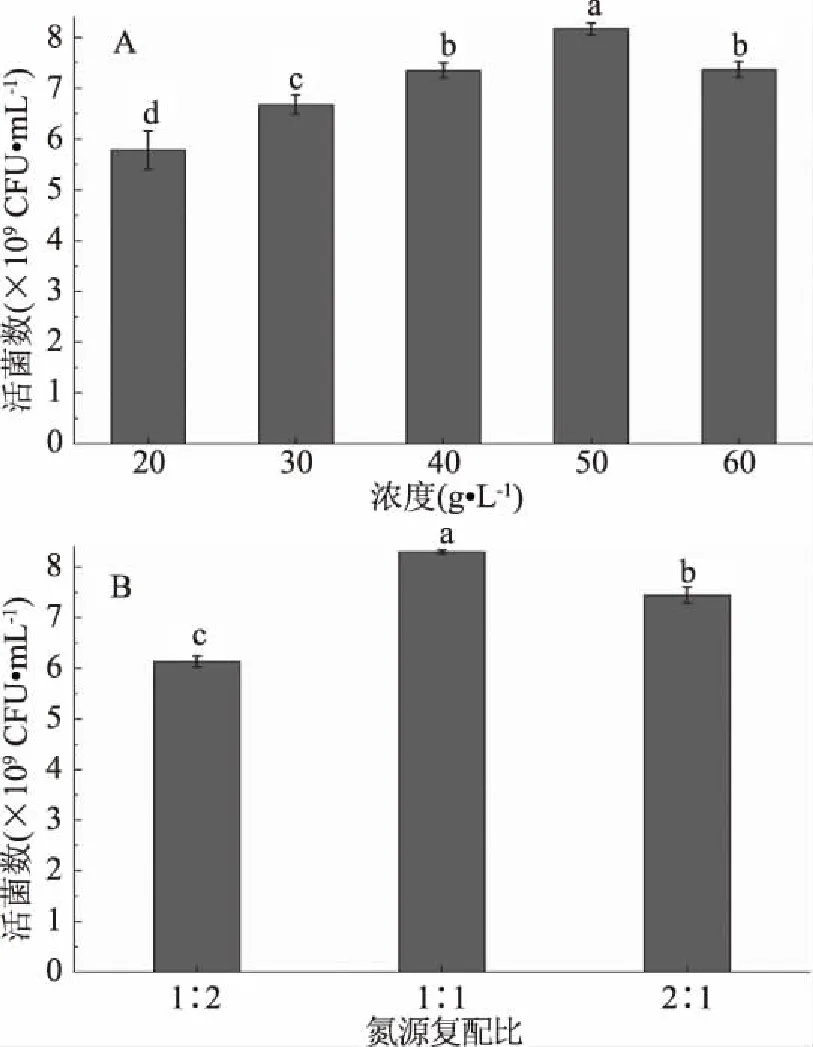
图4 氮源浓度及复配比对植物乳杆菌ZU018生长的影响Fig.4 Effect of concentration of nitrogen source and compounding ratio on the growth of Lactobacillus plantarum ZU018
同时,复合氮源的比例对乳酸菌的生长也有一定的影响[26],以不同复配比例的复合氮源对植物乳杆菌ZU018进行培养,其结果如图4B所示,当氮源复配比例为1∶1时,活菌数显著(P<0.05)高于氮源复配比为1∶2或2∶1的实验组,达到8.31×109CFU/mL。有研究表明酵母浸粉成本高,不能在大规模发酵中使用,故而可增加其他氮源减少酵母浸粉的用量[27]。本实验以牛肉浸粉与酵母浸粉进行复配,丰富蛋白营养成分、可溶性强,有利于植物乳杆菌的生长代谢。选择以50 g/L复配比为1∶1的牛肉浸粉和酵母浸粉作为植物乳杆菌ZU018的氮源。
2.1.2 部分因子实验设计 以植物乳杆菌ZU018活菌数(Y)为响应值,选择单因素实验选出的碳源(麦芽糖)和氮源(牛肉浸粉和酵母浸粉)以及缓冲物质(乙酸钠、柠檬酸三铵、磷酸氢二钾)共6个因子作为筛选因素,每个因子分别确定高(+1)和低(-1)两个水平,另设3个为零水平实验用于误差估计,共进行19次试验以确定每个因子的影响水平,实验设计及结果如表3所示。
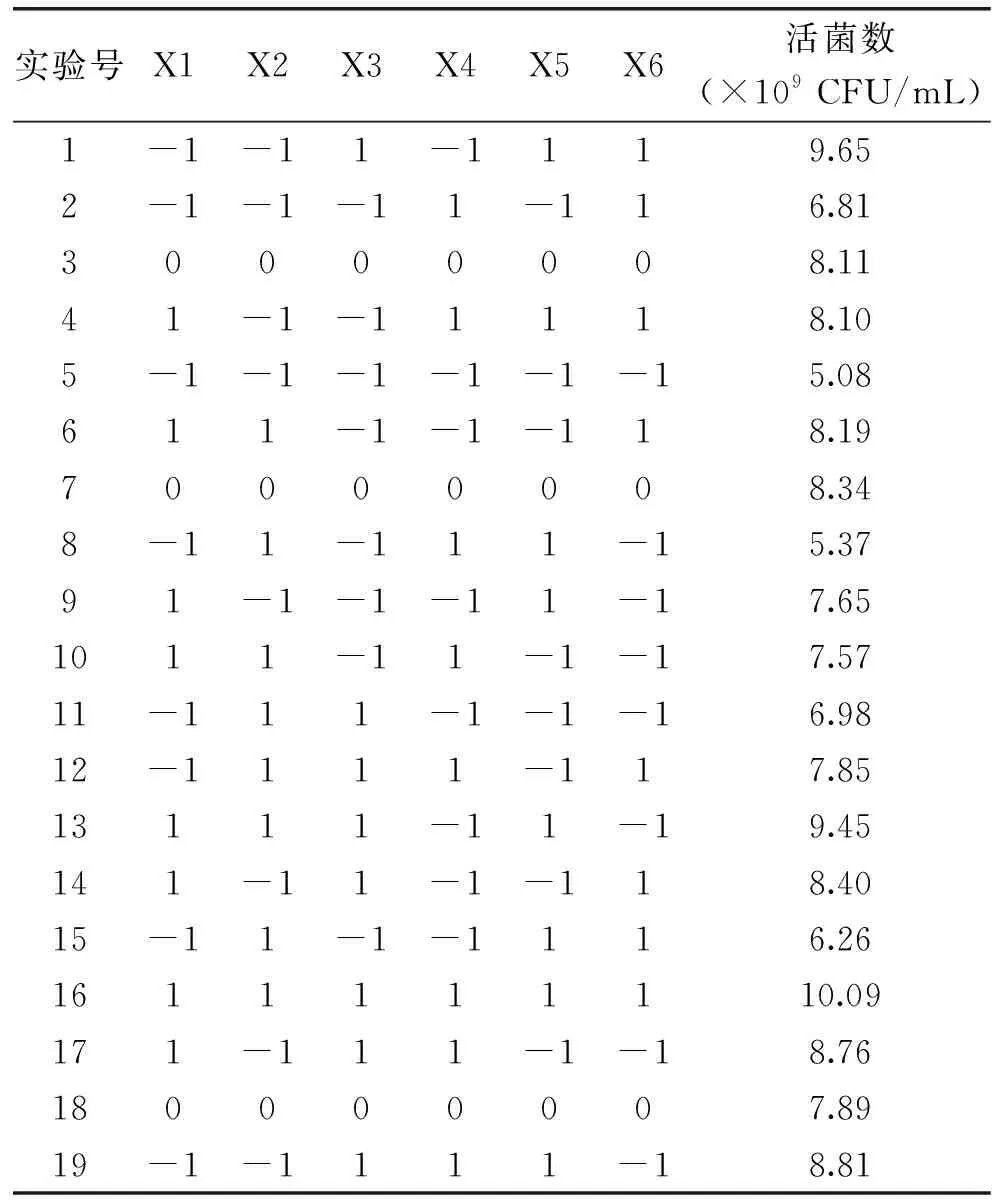
表3 部分因子实验设计与结果Table 3 Fractional factorial design and its experimental results
运用Design Expert 10软件,对表3的实验结果进行回归分析,并进行方差检验,结果如表4所示,P值为0.0004,小于0.05,表明该拟合模型显著。影响植物乳杆菌ZU018生长的主次顺序为:X3>X1>X5>X6>X4>X2,选取影响最为显著的X1(麦芽糖)、X3(酵母浸粉)、X5(柠檬酸三铵)为后续最陡爬坡实验的影响因子;此外,根据表4中回归系数的大小和符号,确定X1(麦芽糖)、X3(酵母浸粉)、X5(柠檬酸三铵)此三个显著因素对应的系数均为正,呈现为正效应。
2.1.3 最陡爬坡路径实验 由部分因子实验结果可知,牛肉浸粉和磷酸氢二钾对植物乳杆菌ZU018活菌数均无显著影响,这些值保持不变,麦芽糖、酵母浸粉、柠檬酸三铵有显著正效应,应增加其浓度[28],最陡爬坡路径设计及结果如表5所示,处理4对应的活菌数(Y值)达到最大值10.12×109CFU/mL。将处理4选作后续试验的中心点。
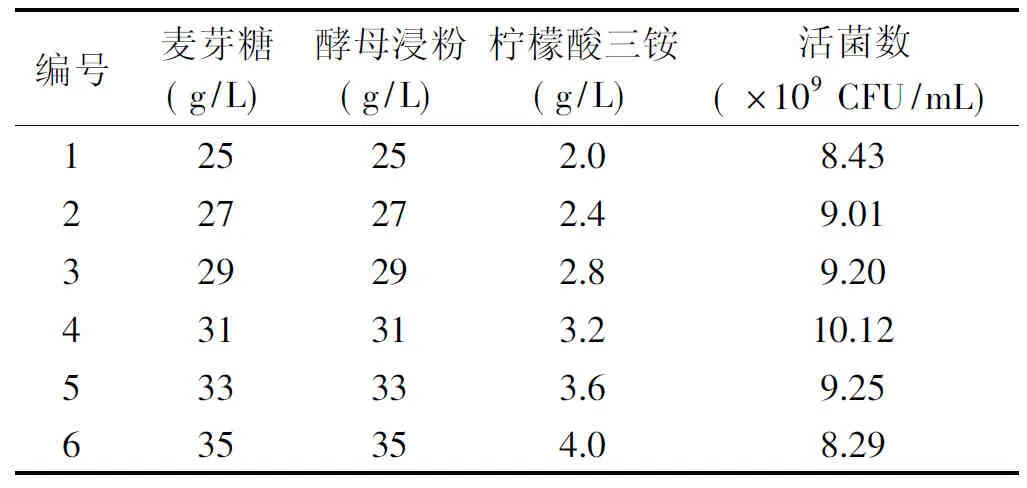
表5 最陡爬坡路径实验设计与结果Table 5 Path and its experimental result of steepest ascent
2.1.4 Box-Behnken中心组合 根据部分因子实验和最陡爬坡路径实验的结果,初步确定最适中心值为:麦芽糖31.00 g/L、酵母浸粉31.00 g/L、柠檬酸三铵3.20 g/L,取此三个因子为实验因素,以植物乳杆菌ZU018活菌数(Y值)作为响应值,进行Box-Behnken中心组合试验,设计及结果如表6所示。
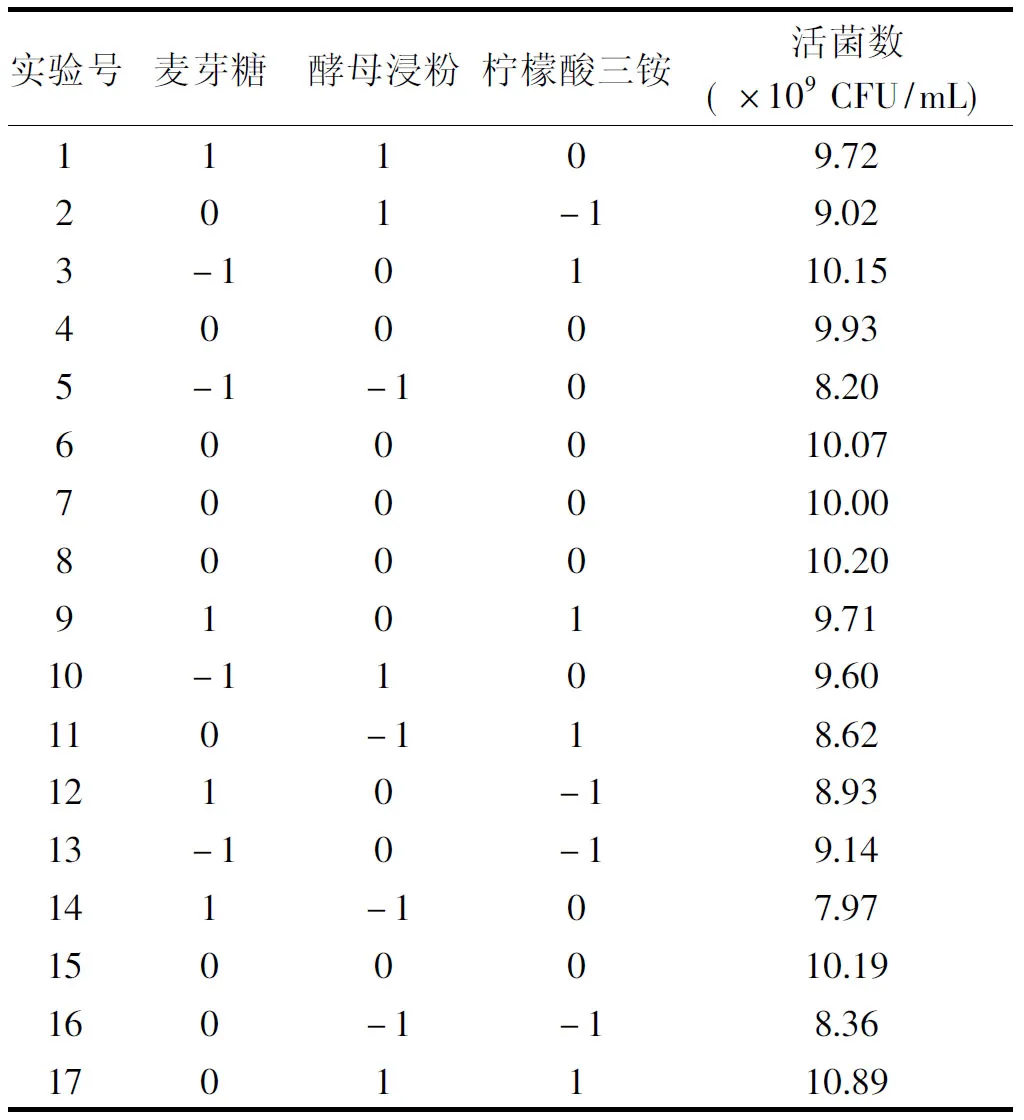
表6 Box-Behnken试验设计及结果Table 6 Design and its experimental results of Box-Behnken
运用Design Expert 10软件对实验数据进行分析。以植物乳杆菌ZU018活菌数作为响应值,对结果进行多元回归分析,建立回归方程:
Lg(Y)=1.00-0.004458A+0.036B+0.022C+0.004337AB-0.002326AC+0.017BC-0.022A2-0.035B2-0.005352C2。
对上述回归方程模型进行方差分析如表7所示,结果表明,所选用的二次多项式模型高度显著性(P<0.001),与实际情况拟合良好。其中实验因素B(酵母浸粉)、实验因素C(柠檬酸三铵)对植物乳杆菌ZU018活菌数影响极显著(P<0.001),而A(麦芽糖)对其的影响较小。同时三个因素之间的两两交互作用中,BC(即酵母浸粉与柠檬酸三铵)的交互作用对植物乳杆菌ZU018的活菌数影响极显著。

表7 Box-Behnken设计方差分析表Table 7 ANOVA results of BBD
根据Design-Expert 10软件得到的回归分析结果如图5所示,回归模型存在最大值,一次项B、C极显著,二次项A2、B2极显著,交叉项BC极显著;此外,麦芽糖和酵母浸粉、麦芽糖和柠檬酸三铵的交互作用较小,近似圆形:该回归模型得出Box-Benhnken试验设计的最优结果为麦芽糖30.03 g/L、酵母浸粉37.50 g/L、柠檬酸三铵4.39 g/L,在此优化条件下的活菌数为10.96×109CFU/mL。
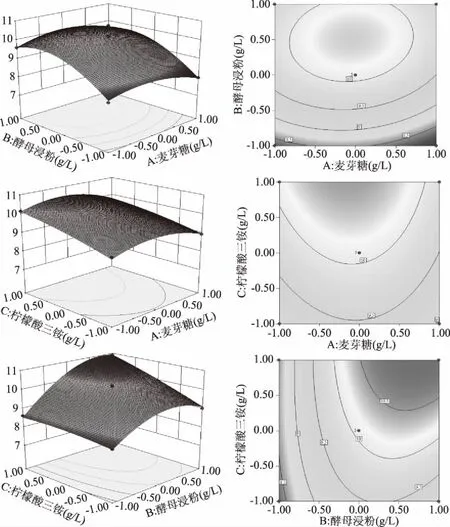
图5 麦芽糖、酵母浸粉和柠檬酸三铵交互作用对植物乳杆菌ZU018生长影响的响应面图Fig.5 Response surface of effect of maltose,yeast extract and triammonium citrate interaction on growth of Lactobacillus plantarum ZU018
为了检验模型优化结果的准确性,按优化的结果配制培养基进行发酵试验,设置平行组,3次试验结果的平均活菌数为10.67×109CFU/mL,和模型预测值接近,验证了此模型的准确性。优化后最终活菌数比优化前的1.82×109CFU/mL提高4.86倍。
3 结论
通过单因素实验对培养基中碳源、氮源的研究,得到培养基的最佳碳源为麦芽糖,最佳氮源为复配比为1∶1的酵母浸粉和牛肉浸粉;通过中心组合实验得到影响植物乳杆菌ZU018活菌数的最主要因素为:麦芽糖、酵母浸粉、柠檬酸三铵;通过最陡爬坡路径试验得到了响应面设计因素水平的中心点:麦芽糖31.00 g/L、酵母浸粉31.00 g/L、柠檬酸三铵3.20 g/L;通过响应面优化设计实验得到最佳优化培养基配方为:麦芽糖30.03 g/L、酵母浸粉37.50 g/L、牛肉浸粉25.00 g/L、柠檬酸三铵4.39 g/L、磷酸氢二钾2.00 g/L、乙酸钠5.00 g/L、硫酸镁 0.20 g/L、硫酸锰 0.05 g/L、吐温80 1.00 g/L。最终发酵液中植物乳杆菌ZU018活菌数相比优化前提高4.86倍,达到10.67×109CFU/mL。本研究植物乳杆菌菌体浓度有显著提高,为今后植物乳杆菌ZU018的扩大培养和制备高活性乳酸菌发酵剂提供了理论基础和参考依据。

