肝硬化患者肠道菌群失调的特征及驱动因子分析
郭晓霞,胡 娜,廉晓晓,孙元培,李玉珍,吕 蕾,叶永安,李小科
1 山西省中医药研究院,太原 030012;2 山西中医药大学,太原 030024;3 北京中医药大学东直门医院,北京 100700
肝硬化是由一种或多种病因长期或反复作用形成的弥漫性肝损伤,属慢性进行性肝病的终末期阶段。肝硬化的早期发现和有效干预措施仍然是当务之急。近年来研究表明,肠道微生态改变与肝脏疾病的发生发展密切相关[1],可能促进肝硬化患者病情的进展[2]。有效的干预肠道菌群失衡有利于延缓或阻止肝病的发生发展[3]。ALBI指数是利用临床指标Alb和TBil通过计算得到的数值[4],可用于评估肝癌及慢性肝病患者的进展及预后[5-7]。研究[8]表明ALBI评分在预测肝硬化患者的严重程度和长期预后方面优于MELD评分。本研究通过分析肝硬化患者肠道菌群结构及功能的变化,探索其在肝硬化病情演变过程中的作用,为肝硬化的预防和治疗提供理论依据及思路。
1 资料和方法
1.1 研究对象 选取2017年8月-2019年8月于山西省中医院肝病科就诊的肝硬化患者70例为研究对象,另选取10例健康志愿者为健康对照组。入选标准:(1)所有患者经临床诊断、形态学诊断及影像学检查确诊均符合肝硬化诊断标准,年龄18~70周岁,根据肝功能ALBI分级标准分为1、2、3级;(2)健康对照组年龄18~70周岁,体格检查、血尿常规、肝功能、肾功能均在正常范围内。排除标准:(1)高血压、糖尿病、肥胖、代谢综合征及各种胃肠道疾病患者;(2)入组前2周内系统使用过抗生素、微生态制剂及质子泵抑制剂患者;(3)孕期及哺乳期妇女。
1.2 研究方法
1.2.1 粪便菌群检测 留取受试对象的粪便标本3~5 g,于排便后2 h内收集在密闭的粪便储存盒内,置-80 ℃冰箱冷冻,统一送至上海派森诺生物科技有限公司,提取粪便样本总DNA,根据细菌16S rDNAV3-V5区设计引物进行扩增(引物名称338F/806R,F:ACTCCTACGGGAGGCAGCA,R:GGACTACHVGGGTWTCTAAT),利用Illumina Miseq平台进行高通量测序;测序结果经过Reads拼接,分类单元(operational taxonomic unit, OTU)聚类,物种注释,α多样分析,主成分分析,最终得到样品物种信息。
1.2.2 CDR、HBCDI、CDIG的计算 CDR=(毛螺菌科+瘤胃菌科+韦荣氏菌科+梭菌科)相对丰度/(拟杆菌科+肠杆菌科)相对丰度[9]。HBCDI =(肠球菌属+链球菌属+乳杆菌属)相对丰度/(瘤胃球菌属+普氏菌属+拟杆菌属)相对丰度[10]。本研究以存在显著差异的菌属为主体,建立新的评价肝硬化患者肠道菌群失衡度的参数(cirrhosis dysbiosis index of genus, CDIG)[CDIG=(粪球菌属+梭菌属)相对丰度/(罗斯氏菌属+韦荣球菌属+链球菌属+嗜血杆菌属)相对丰度],即特定有益原籍菌属相对丰度与非原籍有害菌属比值。
1.2.3 临床指标的检测 受试者血液标本在山西省中医院检验科检测,包括血肌酐(SCr)、ALT、AST、Alb、TBil、PLT、PT、内毒素。
1.2.4 ALBI指数的计算 ALBI分数=0.66×log10[TBil(μmol/L)]-0.085×[Alb(g/L)]。分级标准:1级,ALBI评分≤-2.60;2级,-2.60
1.3 伦理学审查 本研究经山西省中医院伦理委员会审批通过(省中医伦字:2016-05006),患者均签署知情同意书。

2 结果
2.1 一般资料 本研究共纳入70例肝硬化患者,女28例,男42例,年龄(54.38±9.57)岁;病毒性肝硬化50例,酒精性肝硬化6例,原发性胆汁性肝硬化8例,不明原因6例;ALBI 1级31例,2级32例,3级7例。健康对照者10例,女4例,男6例,年龄(46.13±11.68)岁。肝硬化不同级别与健康对照组之间性别、年龄差异均无统计学意义(P值均>0.05),具有可比性。肝硬化不同级别的患者合并腹水、PLT、ALT、AST、TBil、Alb、PT及内毒素水平比较,差异均具有统计学意义(P值均<0.05),SCr及肝硬化病因比较,差异均无统计学意义(P值均>0.05)(表1)。
2.2 肝硬化组和健康对照组的肠道菌群多样性改变 从菌群组成来看,本研究发现在门水平上,健康对照组和肝硬化组中,厚壁菌门、放线菌门、变形菌门和拟杆菌门占总肠道菌群的95%以上,其中厚壁菌门占绝对优势。属水平上,健康对照组和肝硬化组的肠道微生物组成有明显不同,双歧杆菌在两组中均为优势菌属,但与健康对照组相比,肝硬化组双歧杆菌占比有所下降,链球菌属占比有所上升(表2)。
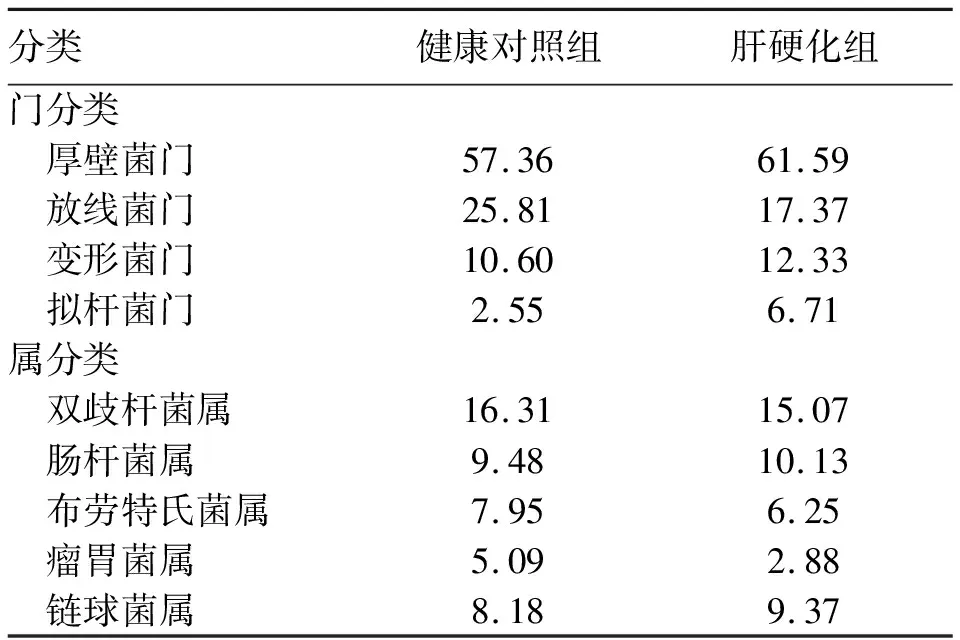
表2 所有物种的分类学组成(%)
本研究对所有鉴定的细菌操作OTU进行序列对比分析,结果显示与健康对照组相比,有81个OTU是肝硬化患者肠道菌群宏基因组中特有的,其中ALBI 1级、2级、3级分别独有39、34、8个OTU(图1),这表明肝硬化患者肠道菌群的种类发生了特异性变化。
本研究应用Alpha多样性反应肠道物种的丰富度和均匀度。Chao1指数、ACE指数反映的是群落的丰富度,Shannon指数、simpson指数反映的是群落的多样性。Alpha多样性分析结果表明,相对于健康对照组,肝硬化各组Chao1、ACE指数降低,丰富度明显减少(P值均<0.05),Chao1、ACE指数与ALBI分级呈显著负相关(r值分别为-0.287、-0.297,P值分别为0.016、0.012);但是多样性指数(shannon和simpson)并未在健康对照组和肝硬化组间发现差异及相关性(P值均>0.05)(表3)。

表1 研究对象的一般资料
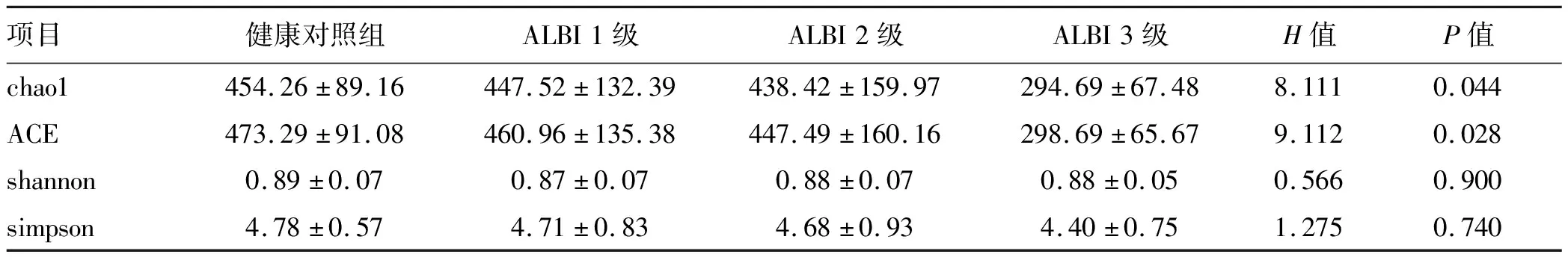
表3 Alpha多样性指数

表4 各组菌属相对丰度变化
2.3 肝硬化患者肠道菌群的属水平分析 为了进一步探明菌群宏基因组变化的原因,本研究对肠道菌群中菌种进行了分析。与健康对照组相比,随着肝功能ALBI分值增加,罗斯氏菌属、韦荣球菌属、链球菌属和嗜血杆菌属的相对丰度显著升高,粪球菌属和梭菌属相对丰度明显下降,差异均具有统计学意义(P值均<0.05)(表4)。将差异菌属进行相关性分析,结果发现有益菌粪球菌属与梭菌属之间呈正相关(P<0.05),致病菌罗斯氏菌属、韦荣球菌属、链球菌属、嗜血杆菌属四者之间彼此呈正相关(P值均<0.001),有益菌粪球菌属与致病菌罗斯氏菌属、韦荣球菌属、链球菌属之间呈显著负相关(P值均<0.001)(图2)。
2.4 肝硬化差异菌属与临床指标的相关性 将差异菌属与临床指标进行相关性分析,如表5所示,粪球菌属与Alb呈正相关,与PT、ALBI评分呈负相关(P值均<0.05);罗斯氏菌属、韦荣球菌属、链球菌属、嗜血杆菌属均与Alb呈负相关,与PT、TBil、ALBI评分呈正相关(P值均<0.05)。
为了更好的探究肝硬化肠道菌群结构与临床指标的内在联系,本研究利用CANOCO5.0软件进行RDA分析。如图3所示,菌群分布与临床指标之间的关系较复杂,利用BioEnv分析表明ALT、AST、Alb、PT、TBil、EXT、ALBI这7个指标是影响肠道细菌群落变异的主要临床指标组。根据箭头长度可以看出PT、TBil、AST与肠道菌群分布相关性较大,PT、AST、TBil作为单因子对群落变异的解释度分别是15.5%、5.1%、4.7%,其中PT对群落变异的影响最具有显著性(P=0.002),可以认为PT是驱动肠道群落变异的主要因子。
2.5 肝硬化患者肠道菌群失衡度与肝病严重程度的相关性 对各组进行肝硬化菌群失衡度的计算,结果显示健康对照组、ALBI 1级、ALBI 2级、ALBI 3级的CDR、HBCDI差异均无统计学意义(P值均>0.05)。健康对照组、ALBI 1级、ALBI 2级、ALBI 3级的CDIG差异具有统计学意义(P<0.001)(表6)。
将肠道菌群失衡指标CDIG与临床指标进行相关性分析,结果显示CDIG与TBil、PT及ALBI呈显著负相关(r值分别为-0.313、-0.323、-0.366,P值分别为0.008、0.006、0.002),与Alb呈显著正相关(r=0.331,P=0.005)。
3 讨论
肠道菌群是微生物群的重要组成部分,维持着肠黏膜的完整性及通透性,它们的相对丰度变化可以改变生理平衡,导致肠内外疾病的发生。肠道微生物已被证明参与诱导和促进早期肝病中的肝损伤[11]。肠道菌群失调导致肠道屏障功能受损,肠道通透性增加,内毒素穿过肠黏膜进入血循环,血浆内毒素升高,形成内毒素血症。肠屏障功能的破坏与内毒素血症互为因果,形成恶性循环,导致肝损伤加重[12-14]。血浆内毒素水平升高的程度, 可反映出肠黏膜屏障损伤的程度[15],及作为临床监测肝硬化疾病进程的重要指标。因此针对肠道菌群失衡对肝硬化进行早期检测和干预,在减慢或逆转肝硬化进展方面具有不可忽视的作用。
本研究对健康人和肝硬化患者粪便样本中微生物的多样性进行了初步分析, 发现随着肝硬化疾病发展,肠道菌群多样性逐渐降低,且与疾病病程呈明显负相关,表明肝硬化程度越重,肠道菌群多样性降低愈明显。健康人和肝硬化患者粪便中优势菌群以厚壁菌门和放线菌门为主;但具体到属的水平上则出现较大的个体差异性。与健康人群相比,同一种主导菌群双歧杆菌属在肝硬化组比例降低。双歧杆菌属可调节机体免疫,增加抗炎及抗感染能力[16],越来越多的证据[17-18]显示肝硬化患者粪便中双歧杆菌总数减少。OTU分析显示有81个OTU是肝硬化患者肠道菌群宏基因组中特有的,这表明肝硬化患者肠道菌群的种类发生了特异性变化。本研究发现健康人群与肝硬化组的粪便菌群存在显著差异,肝硬化组有2种菌属含量明显减少,分别是增加肠道抗炎功能的梭菌属和维持肠道完整性的粪球菌属。粪球菌属和梭菌属的减少有可能是肝硬化患者肠道黏膜屏障损伤的主要原因。与文献报道[4,19]有所不同的是,本研究发现肝硬化患者尤以罗斯氏菌属、韦荣球菌属、链球菌属和嗜血杆菌属4种潜在致病菌增多为特征,且彼此之间呈明显正相关。韦荣球菌属、链球菌属和嗜血杆菌属菌属为人类口腔的3大定植菌,是重要的条件致病菌[20],沿着消化道异位定植到肠道后发挥协同作用,导致肝硬化病情加重。肝硬化与口腔微生物群之间的联系已经得到证实[21]。值得注意的是本研究发现产丁酸的罗斯氏菌属在肝硬化患者显著富集,且与韦荣球菌属、链球菌属和嗜血杆菌属呈明显正相关,相关研究[22]中也曾发现类似现象,可见罗斯氏菌属丰度增加是与疾病进展相伴随的。物种间的菌株差异决定了罗斯氏菌属在肝硬化的发展中是致病菌或益生菌,还是作为一种代偿性机制参与疾病的过程还有待进一步研究。

表5 差异菌属与临床指标的相关性分析

表6 肝硬化患者不同肠道菌群失衡指标的比较
ALBI评分反应肝硬化严重程度,从肝硬化整个病程来看,罗斯氏菌属、韦荣球菌属、链球菌属和嗜血杆菌属与肝硬化严重程度呈正相关,粪球菌属与肝硬化严重程度呈负相关,梭菌属与肝硬化严重程度之间无明显相关性,与国内外研究结果具有部分一致性[23-24]。故本研究认为梭菌属作为次要因素,对肝硬化病情影响较小。肝硬化患者血浆内毒素水平明显高于健康组,且随着肝病严重程度而渐升高,但与差异菌属均无明显相关性,说明本研究中的差异菌属并不能反映内毒素水平的变化,对肠道屏障功能可能无调节作用,而参与内毒素调节也许存在特定的条件致病菌[25-26],提示肠通透性增加并不是导致肝硬化患者发生肠道菌群失调的决定性因素。与临床指标的相关性分析中发现罗斯氏菌属、韦荣球菌属、链球菌属、嗜血杆菌属与Alb呈负相关而与PT、TBil呈正相关,粪球菌属与Alb呈正相关而与PT呈负相关,因此通过调节肠道菌群可以改善肝硬化患者的临床生化指标[27]。对肝硬化患者的肠道菌群中的差异菌群与临床指标进行RDA分析,结果显示PT、TBil、AST与肠道菌群分布相关性较大,其中PT对群落变异的影响最具有显著性,可以认为PT是驱动肠道群落变异的主要因子。PT是反映肝脏合成、病变严重程度及预后的重要指标[28-29]。PT延长表明肝硬化程度加重,胃肠道淤血和组织水肿明显,肠腔内环境改变而发生肠道菌群变异。
本研究初步探讨了菌群失衡与肝硬化严重程度的关系,结果提示菌群失衡的严重程度和肝功能ALBI分级程度有关。ALBI分级程度越高,肠道菌群失衡越严重。因此定量评价肠道菌群失衡程度有助于分析菌群失衡与肝病的相关性。作者选取肝硬化不同ALBI分级间差异菌属中非原籍有害菌属为分母,有益原籍菌属为分子来构建CDIG参数。该参数反映的是个体有益原籍菌群与非原籍有害菌群的偏离度,数值越小,菌群失调程度越重。结果显示CDIG参数在肝硬化不同ALBI分级间存在显著差异。肝硬化病情越重,CDIG越小,肝硬化患者肠道菌群失衡越严重。其中ALBI 3级患者的菌群失衡度是ALBI 2级和1级患者的6和19倍,表明肠道菌群失衡在终末期肝硬化患者中尤为明显,肠道菌群失调可能促进肝功能恶化。CDIG与TBil、PT及ALBI指数呈显著负相关,与Alb呈显著正相关,因此CDIG可在一定程度上反映肝病的严重程度及肝硬化病情的进展。既往研究中定量评价肠道菌群失衡程度的指标如CDR[9]和HBCDI[10]在本研究肝硬化不同ALBI分级间差异均无统计学意义,提示CDR和HBCDI在本研究人群中评价肠道菌群失衡的效能不佳。考虑与本研究群体包括多种病因引起的肝硬化有关,具体到不同病因的肝硬化是否适用CDIG还应进一步扩大样本量进行研究。
本研究在证实肝硬化与肠道菌群有密切关系的基础上,进一步观察了肝硬化的发展及演变过程中肠道菌群结构的改变。肝硬化肠道菌群中关键菌属的存在并不能保证其对菌群的影响,还有临床指标中的PT来决定关键菌群的分布和效应。但本研究也存在不足之处,肝硬化不同ALBI间差异菌属虽然被鉴别为关键物种,但并不代表他们所包含的菌种都对肝硬化的肠道群落结构和功能产生影响,还有待更加深入全面的研究。
综上所述,肝硬化患者存在菌群失调的主要特征为致病菌的过度增长协同有益菌的缺乏及各菌属之间的比例失调。肠道菌群是肝硬化发生发展和疾病控制的重要环节,通过菌群移位和内毒素加重炎症反应,促进肝硬化疾病的病理过程,并对疾病活动产生影响,从而影响肝硬化预后。本研究所建立的CDIG可评估肝硬化患者肠道菌群失衡状态及进展风险,为肝硬化的治疗提供新的作用方向和靶点。

