合并腺肌病对子宫内膜癌临床病理特征及预后的影响*
殷 敏 陈爱平 王 畅 赵 飞 季雪超
1 青岛大学医学部,山东省青岛市 266000; 2 青岛大学附属医院妇科
子宫内膜癌是女性生殖道常见的恶性肿瘤[1],近年来其发病率呈上升趋势。在我国居女性生殖系统恶性肿瘤的第二位,据2015年国家癌症中心统计,我国发病率为63.4/10万,死亡率21.8/10万。根据其与雌激素的关系分为雌激素依赖型(Ⅰ型)和非雌激素依赖型(Ⅱ型)。子宫内膜癌最常见的组织学类型是子宫内膜样腺癌,与其他组织学类型的子宫内膜癌相比,具有较低的侵袭性和较高的生存率。组织学分级、肌层浸润深度、淋巴管脉管间隙侵犯、淋巴结转移等是影响子宫内膜癌患者预后的重要因素。子宫腺肌病是子宫内膜异位症的一种,由子宫内膜腺体及间质侵入子宫肌层并在其中生长而引起。与子宫内膜癌相比,子宫腺肌病是一种常见的良性疾病,通常表现为月经过多和痛经。目前对合并子宫腺肌病的子宫内膜癌临床病理特点及其对复发与预后意义的研究较少且存在争议。有研究表明,合并子宫腺肌病的子宫内膜癌患者预后较好[2],然而也有研究认为对预后无影响[3-4]。本研究旨在探讨合并子宫腺肌病的子宫内膜癌患者的临床病理特征及对其预后的影响,从而为子宫内膜癌的临床处理及预后评估提供指导意义。
1 资料和方法
1.1 临床资料 对2012年9月—2015年9月期间在我院接受手术治疗且病理诊断为子宫内膜癌的528例患者进行回顾性分析,患者年龄范围31~82岁。根据术后子宫标本是否合并子宫腺肌病分为两组:合并子宫腺肌病组(106例,20%)、单纯子宫内膜癌组(422例,80%)。两组患者均接受手术治疗,根据患者病情选择不同的手术方式,主要包括筋膜外全子宫+双侧附件切除术、筋膜外全子宫+双侧附件切除术+盆腔淋巴结清扫术、筋膜外全子宫+ 双侧附件切除术+盆腔淋巴结清扫术及腹主动脉旁淋巴结清扫及肿瘤细胞减灭术。根据患者病理及高危因素,术后给予相应的放化疗。
1.2 观察指标 比较分析两组患者的年龄、是否合并高血压、糖尿病等一般特点及手术病理分期、肿瘤分化程度、病理类型、肌层浸润深度、淋巴脉管间隙浸润、淋巴结转移等临床病理特点以及复发率、5年无病存活率、5年总存活率等预后指标。手术病理分期及肿瘤组织病理分级采用 FIGO 2009 标准,其中Ⅰ期 443 例,Ⅱ期 31例,Ⅲ 期 42例,Ⅳ期12例。
1.3 统计学方法 用SPSS20.0统计学软件对数据进行分析。应用秩和检验进行组间比较,计数资料用χ2检验进行比较。P<0.05表示差异具有统计学意义。
2 结果
2.1 两组间年龄、高危因素比较 与单纯子宫内膜癌组相比,合并子宫腺肌病组患者年龄较低,另外,合并子宫内膜癌发生的高危因素,如合并高血压、糖尿病人数的比例在两组中的差异无统计学意义(P均>0.05)。见表1。
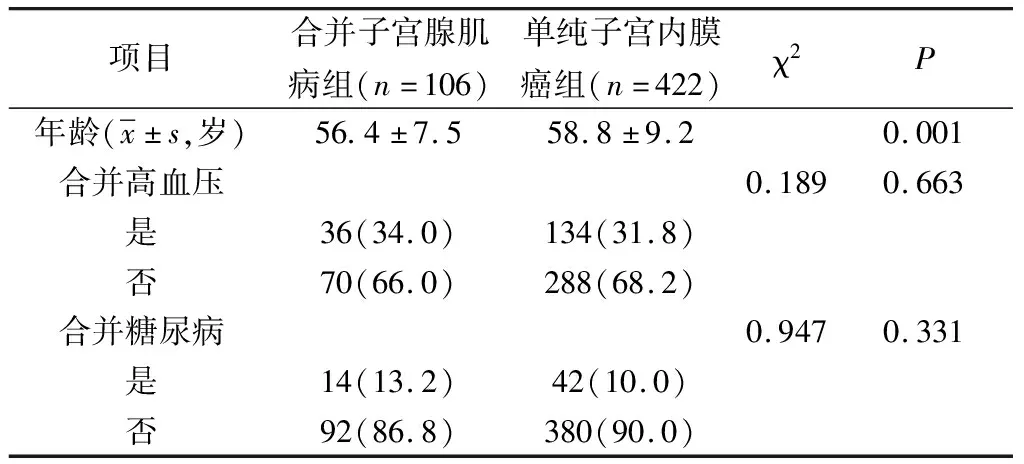
表1 两组间年龄、高危因素比较[n(%)]
2.2 两组间病理类型、组织分级、肌层浸润、肿瘤分期的比较 两组间组织病理类型比较,差异无统计学意义(P>0.05);与单纯子宫内膜癌组相比,合并子宫腺肌病组组织分化程度高,肌层浸润浅,肿瘤分期早,差异均具有统计学意义(P<0.05)。见表2。
2.3 两组淋巴结转移、淋巴脉管间隙浸润、腹水细胞学的比较 两组淋巴结转移、淋巴脉管间隙浸润、腹水细胞学阳性率之间的差异均无统计学意义(P>0.05)。见表3。
2.4 两组复发率、无病存活率、总存活率的比较 与单纯子宫内膜癌组比较,合并子宫腺肌病组的复发率低,5年无病存活率和总存活率高,差异有统计学意义(P<0.05)。见表4。

表2 两组病理类型、组织分级、肌层浸润、肿瘤分期情况比较[n(%)]

表3 两组淋巴结转移、淋巴脉管间隙浸润、腹水细胞学比较[n(%)]
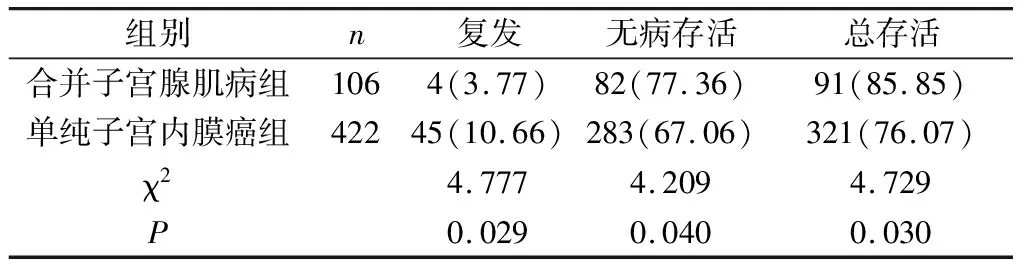
表4 两组复发率、5年无病存活率、5年总存活率比较[n(%)]
3 讨论
子宫内膜癌是常见的妇科恶性肿瘤之一,子宫内膜样腺癌是最常见的组织类型。子宫内膜样腺癌为雌激素依赖性,组织分化程度较高,总体预后良好。相比之下,Ⅱ型子宫内膜癌不依赖雌激素,主要包括浆液性癌和透明细胞癌,预后差。组织学类型、肌层浸润深度、肿瘤分化程度、淋巴脉管间隙浸润、腹腔细胞学和淋巴结是否转移等是影响其预后的重要因素[5]。
子宫腺肌病是子宫内膜异位症的一种,由子宫内膜腺体及间质侵入子宫肌层并在其中生长而引起,是一种常见的妇科良性疾病。文献报道,因子宫内膜癌行子宫切除的标本中,合并子宫腺肌病的比例为16%~34%不等[6]。虽然子宫内膜癌与子宫腺肌病之间的关系已被证实,但是子宫腺肌病在子宫内膜癌进展中的作用仍不清楚,合并子宫腺肌病对子宫内膜癌患者预后的影响也存在争议。本研究通过回顾性分析并比较两组患者的临床病理特点及预后指标,以期为子宫内膜癌的临床处理及预后评估提供指导意义。
在本研究中,因子宫内膜癌行手术治疗获得的子宫标本中,合并子宫腺肌病的检出率为20%,与先前研究报告的检出率相似。合并子宫腺肌病的子宫内膜癌常为Ⅰ型,这可能与子宫腺肌病病灶中雌激素受体的过度表达有关。绝经年限越长,子宫腺肌病病灶萎缩变小的可能性越大,越不易在病理切片上体现。而年龄较大的患者,合并症多,难以耐受系统分期手术,术后辅助治疗也可能受到限制,导致患者预后生存率较低。合并子宫腺肌病组的肿瘤分期较早,组织分化程度高,肌层浸润较浅,这表明子宫腺肌病的存在可能对癌细胞扩散具有限制性作用。Shen等人[7]提出了一种在子宫腺肌病病灶中反复发生炎性和损伤的循环机制,这导致子宫肌层形成纤维化微环境。虽然起初肌层的允许作用是子宫腺肌病形成的理想微环境,但最终由子宫腺肌病引起的子宫肌层微环境的改变可能引起屏障效应并抵抗肿瘤的侵袭。Machida 等人[8]的数据表明,与单纯子宫内膜癌相比,合并子宫腺肌病患者的总生存率相对较高,可能是由于子宫腺肌病周围肥厚和增生的子宫肌层及间质限制了肿瘤侵袭。同时,子宫腺肌病具有独特的细胞因子环境[9],包括干扰素-α、干扰素-γ、肿瘤坏死因子-α和白细胞介素-10在内的细胞因子分泌增加。干扰素-α/γ调节并激活免疫反应,导致抗肿瘤免疫增强。白细胞介素-10作为一种抗炎细胞因子,能控制肿瘤生长。肿瘤坏死因子-α可诱导细胞凋亡,产生抗肿瘤作用。因此,这些细胞因子的分泌加强了抗肿瘤作用,并限制肿瘤的进展。
淋巴管脉管间隙浸润、淋巴结转移等是影响子宫内膜癌患者预后的重要因素。Guntupalli等人[10]回顾性分析了757例子宫内膜癌患者的预后危险因素,研究发现在多因素分析中,肌层浸润深度和淋巴脉管间隙浸润是淋巴结是否受累的预测因素。无淋巴脉管间隙浸润对淋巴结转移的阴性预测值约为95%。淋巴脉管间隙浸润还与无进展生存率和总生存率的降低相关,证实了其可作为子宫内膜癌预后不良的标志物。然而,本研究发现两组间淋巴结转移、淋巴脉管间隙浸润的比较无统计学差异,这可能与本研究病例数偏少有关,因此还应进一步扩大病例数进行深入研究。
合并子宫腺肌病对子宫内膜癌患者预后的影响目前也存在争议。在Koshiyama等人最近的一项研究中,将179例子宫内膜癌患者分为对照组、合并子宫腺肌病组、合并子宫内膜异位症组和合并子宫肌瘤组,并对其预后进行了观察,结果发现合并子宫腺肌病组和合并子宫内膜异位症组具有较好的预后结局。然而Akiyo Taneichi等人的研究发现子宫腺肌病对子宫内膜样腺癌的预后没有显著影响。本研究发现,与单纯子宫内膜癌组相比,合并子宫腺肌病组的复发率低,5年无病存活率和总存活率高,差异有统计学意义(P<0.05)。这可能与合并子宫腺肌病组肿瘤分期较早、组织分化程度高、肌层浸润较浅有关,提示合并子宫腺肌病可作为预后良好的预测指标。
综上所述,合并子宫腺肌病与子宫内膜癌的分期较早、组织分化程度高、浅肌层浸润显著相关,此外,合并子宫腺肌病可能是子宫内膜癌良好预后的预测因素。由于本研究为回顾性队列研究,因此需要扩大病例数和前瞻性设计的进一步研究,从而更好地指导子宫内膜癌的临床诊治,为预后评估提供指导意义。

